Biochemia
opracowanie zagadnień egzaminacyjnych
Rozmieszczenie wody w organizmie:
Ciało dorosłego człowieka o normalnej budowie zawierać może przeciętnie 40 - 45 l. wody. Rozkład jej w ustroju nie jest równomierny, gdyż w niektórych tkankach zbiera się w większym stopniu niż w innych, ale wszystkie one zawierają wodę. Niewątpliwie woda nie jest magazynowana w żadnym stałym miejscu , ale jest natychmiast wykorzystywana z mniejszą lub większą skutecznością do różnych celów. Woda stanowi podstawowa część krwi i limfy ; jest rozpuszczalnikiem różnych substancji i środowiskiem dla wszystkich reakcji chemicznych . Jest ona nieodzowna w procesie trawienia , ponieważ przy rozszczepianiu białek , węglowodanów i tłuszczów, na każda parę cząsteczek cukru prostego albo aminokwasów zużywana jest cząsteczka wody, a przy rozszczepianiu tłuszczów 3 cząsteczki wody na każda cząsteczkę tłuszczu.
Woda w organizmie występuje w postaci niezwiązanej jako tak zwana wolna woda oraz związanej z różnego rodzaju wodochłonnymi koloidami
woda jako płyn pozakomórkowy ( między komórkowy, osocze stanowi 5 % )
woda jako płyn wewnątrz komórkowy ( stanowi 50 % masy ciała )
Woda w organizmie człowieka odgrywa bardzo ważną rolę, woda w każdym okresie rozwoju zajmuje ponad połowę masy ciała osobnika. I tak na przykład u noworodka woda stanowi 77% masy ciała, u 3 miesięcznego płodu 94%, przy czym zaczyna wzrastać tak do starości, u ludzi starych zawartość wody spada poniżej 60%. Jej niedobór może mieć poważne konsekwencje w naszym organizmie.
Istotna role odgrywa tutaj rozmieszczenie wody, szczególnie proporcje pomiędzy wodą , która jest zawarta w przestrzeni pozakomórkowej (krew, limfa, płyn mózgowo - rdzeniowy) i przestrzeni śródkomórkowej. Wchłanianie i wydalanie wody u małych dzieci jest o wiele szybsze niż u dorosłych. Dlatego też małe dzieci ciężko znoszą niedobór wody w ustroju.
Ilość pobieranej wody na dobę rośnie wraz z wiekiem:
1 - 4 lat wynosi 800- 950 ml.
5 - 10 lat wynosi 1200- 1350 ml.
Koło 14 lat wynosi 1500 ml.
Jednak ilość wraz ze starzeniem się maleje.
Regulacja bilansu wodnego:
Woda spełnia wiele ważnych biologicznie i fizjologicznie funkcji. Stanowi środowisko dla procesów życiowych przebiegających w organizmie oraz jest materiałem budulcowym, gdyż stanowi strukturalną część wszystkich komórek i tkanek. Woda jest potrzebna do prawidłowego przebiegu procesu trawienia. Umożliwia formowanie kęsów pożywienia w jamie ustnej, przesuwanie treści pokarmowej w przewodzie pokarmowym, właściwe działanie enzymów trawiennych. Do funkcji, jakie pełni woda w organizmie należy również udział w procesie regulacji temperatury ciała.
Dodatni bilans wody w organizmie występuje tylko w okresie wzrostu i w czasie ciąży. Znaczna część, około 2100 ml, pobierana jest z całodzienną dietą w postaci napojów lub wraz ze spożywanymi produktami i potrawami. Ponad 200 ml wody syntezowane jest w organizmie każdego dnia jako rezultat utleniania węglowodanów. Łącznie stanowi to 2300 ml. Dane przedstawiające przykładowy bilans wody w organizmie (u młodego, dorosłego mężczyzny, prowadzącego siedzący tryb życia, spożywającego dziennie 2110 kcal) ilustruje poniższa tabela.
Centralną rolę w regulacji bilansu wodnego odgrywa ośrodek pragnienia w mózgu oraz dwa powiązane z nim funkcjonalnie i strukturalnie ośrodki na podwzgórzu. Istotne znaczenie posiada tu hormon wazopresyna. Mechanizm regulacji bilansu wodnego w organizmie jest na tyle precyzyjny, że całkowita zawartość wody u zdrowego mężczyzny o masie ciała 70 kg, regulowana przede wszystkim przez ośrodek pragnienia, waha się w granicach 500 ml. Należy również podkreślić, iż w przypadku młodego mężczyzny niezbędne jest wydalenie nie mniej niż 500-600 ml moczu w ciągu doby, aby usunąć z organizmu wszystkie produkty przemiany materii, m.in. mocznik i kwas moczowy.
Osmoreceptory:
Osmoreceptory - to receptory wrażliwe na zmianę ciśnienia osmotycznego w organizmie, które znajdują się w podwzgórzu mózgu. Wzrost ciśnienia osmotycznego w płynach ustrojowych (głównie we krwi) powoduje pobudzenie osmoreceptorów, w wyniku czego następuje wyzwolenie uczucia pragnienia oraz wzmożone wydzielanie hormonu wazopresyny, który przyczynia się do zwiększonego wchłaniania zwrotnego wody w kanalikach nerkowych, zapobiegając nadmiernemu jej wydalaniu z moczem.
Hormony biorące udział w regulacji bilansu wodno - elektrolitowego organizmu:
Homeostaza, czyli utrzymanie składu środowiska wewnętrznego, jest istotna dla zdrowia, zapewnia rozdział wody w organizmie i utrzymanie właściwego pH i stężenia elektrolitów.
Regulacja równowagi wodnej jest złożona i zależy przede wszystkim od podwzgórza, kontrolującego pragnienie, hormonu antydiuretycznego (ADH) i czynności nerek.
Wazopresyna, której nazwa wywodzi się stąd, że hormon ten podawany w dawkach farmakologicznych podnosi ciśnienie tętnicze, określana jest również jako hormon antydiuretyczny (ADH). Ta ostatnia nazwa jest bardziej właściwa, ponieważ główne działanie fizjologiczne tego hormonu polega na pobudzaniu resorpcji wody w dystalnych kanalikach nerkowych. ADH jest syntetyzowana głównie w jądrach nadwzrokowych. Hormon ten transportowany jest aksonami wraz ze swoistymi białkami nośnikowymi, zwanymi neurofizynami.
Regulacja sekrecji. Bodźce nerwowe, stymulujące uwalnianie ADH, ulegają aktywacji przez wiele różnorodnych czynników. Najważniejszym bodźcem fizjologicznym dla uwalniania ADH jest wzrost molalności osocza. W uwalnianiu ADH biorą udział osmoreceptory umiejscowione w podwzgórzu oraz baroreceptory, zlokalizowane w sercu w innych obszarach układu naczyniowego. Rozcieńczenie krwi, obniżając molalność osocza, wywiera odwrotny (hamujący) wpływ na wydzielanie ADH.
Wazopresyna, aldosteron, peptydy natriuretyczne:
Hormon antydiuretyczny ADH (wazopresyna) jest cyklicznym nonapeptydem o masie cząsteczkowej 1084 Da. Hormon ten wytwarzany jest przez podwzgórze w postaci preprowazopresynoneurofizyny i wydzielany w ostatecznej postaci przez tylny płat przysadki mózgowej. Powoduje zagęszczanie moczu poprzez resorpcję wody i jonów sodu w kanalikach nerkowych poprzez pobudzanie receptorów V2. Oddziałuje również na naczynia krwionośne powodując ich skurcz dzięki obecnym w ścianie naczyń receptorom V1. Wydzielanie wazopresyny jest pobudzane przez wzrost ciśnienia osmotycznego osocza krwi i płynu mózgowo-rdzeniowego, hipowolemię lub angiotensynę II. Spadek osmolarności osocza lub hiperwolemia hamują jej wydzielanie. Niedobór hormonu antydiuretycznego (wazopresyny) lub brak jego działania powoduje moczówkę prostą. Jeśli dotyczy ona zaburzenia wydzielania na poziomie podwzgórza lub przysadki jest to moczówka prosta ośrodkowa. Jeżeli występuje niewrażliwość cewek nerkowych na działanie hormonu antydiuretycznego - jest to moczówka prosta nerkowa. Nadmiar wazopresyny wywołuje Zespół Schwarza - Barttera.
Aldosteron należy do hormonów sterydowych wytwarzanych przez warstwę kłębkowatą kory nadnerczy. Aldosteron należy do grupy hormonów kory nadnerczy określanych jako mineralokortykoidy (Aldosteron i 11-dezoksykortykosteron).
Regulują one gospodarkę wodno-mineralną ustroju, w ramach tzw. układu RAA. Razem z 11-dezoksykortykosteronem działa on na nabłonki kanalików nerkowych, wzmagając resorpcję zwrotną soli sodowych, hamują ich wydalanie do moczu sodu w postaci chlorku sodu. Wraz z NaCl w ustroju zatrzymana jest woda oraz występuje obniżenie się ilości potasu w płynach ustrojowych.
Aldosteron i słabiej od niego działający 11- dezoksykortykosteron ma istotny wpływ na mineralny skład moczu. Zwiększa on wchłanianie zwrotne sodu w kanalikach dystalnych oraz jego wymianę na jon potasu i jon wodorowy. Skutkiem tego rośnie ilość sodu we krwi i w tkankach, spada zaś jego wydalanie w moczu. Wzrost stężenia sodu w organizmie wywołuje wzrost ciśnienia osmotycznego płynów ustrojowych, zwiększa się więc wydzielanie wazopresyny, która hamuje diurezę i wydalanie wody, aż do ustalenia się normalnych stosunków osmotycznych.
Istnieje wzajemne ścisłe powiązanie między aldosteronem i wazopresyną. Na wydzielanie jednego i drugiego wpływa zmiana objętości krwi krążącej. Na regulację wydzielania aldosteronu ma duży wpływ angiotensyna, oktapeptyd o bardzo silnym działaniu zwężającym naczynia krwionośne. Dzięki temu mimo że wywołuje wzrosty ciśnienia tętniczego, zmniejsza przepływ krwi przez nerki, to działanie powoduje w konsekwencji zmniejszenie przesączania kłębuszkowego i zmniejszenie ilości wydalanego moczu. Wywiera ona wpływ na procesy transportowe w nerkach a w konsekwencji wydzielanie aldosteronu w korze nadnerczy.
Peptydy natriuretyczne są oligopeptydowymi neurohormonami uczestniczącymi w regulacji gospodarki wodno-sodowej i utrzymaniu homeostazy układu sercowo-naczyniowego. Powodują zwiększenie filtracji kłębuszkowej i zmniejszenie resorpcji zwrotnej sodu w nerce oraz hamują wydzielanie reniny i aldosteronu. Ponadto hamują aktywność współczulnego układu nerwowego i bezpośrednio rozszerzają naczynia krwionośne.
Skład elektrolitowy płynu środ - i pozakomórkowego:
Płyn wewnątrzkomórkowy (śródkomórkowy) (ICF - intracellular fluid) obejmuje 2/3 całkowitej ilości wody. Stanowi środowisko dla wytwarzania, magazynowania i wykorzystania energii, procesów samonaprawczych, replikacji i wykonywania określonych funkcji komórki.
Płyn zewnątrzkomórkowy (pozakomórkowy) (ECF - extracellular fluid) zawiera 1/3 wody ustrojowej. Rozdzielony jest między osocze krwi i płyn śródmiąższowy. Ten płyn jest układem dostawczym. Tą drogą dostarczane są do komórek składniki odżywcze (np. glukoza, kwasy tłuszczowe, aminokwasy, tlen, jony, hormony). Płyn pozakomórkowy usuwa dwutlenek węgla, substancje odpadowe, składniki toksyczne ze środowiska komórek.
Różnica w składzie jonowym obu płynów jest bardzo znaczna. Środowisko wewnętrzne komórki jest bogate w kationy K+ i Mg+2 a podstawowym anionem jest anion fosforanowy. Jest tutaj także kilkadziesiąt razy więcej białka i znacznie mniej glukozy. Płyn pozakomórkowy charakteryzuje się dużą zawartością kationów Na+ i Ca+2 a podstawowym anionem jest Cl-. Stężenie glukozy jest tutaj znacznie większe a białka znacznie mniejsze. Żeby utrzymać tę różnicę komórki utworzyły bariery - błony z wbudowanymi w nie pompami.
Iloczyn jonowy wody. Pojęcie pH. Skala pH roztworów wodnych:
Dwie stałe (stała dysocjacji wody i stężenie molowe wody) w równaniu opisującym stan równowagi dysocjacji wody:
![]()
można zastąpić jedną:
[H+][OH-] = 1∙10-14
zwaną iloczynem wody. Zależność ta musi być spełniona w każdym roztworze wodnym: iloczyn stężeń jonów wody w temperaturze pokojowej wynosi 1∙10-14 . Wystarczy zatem podać stężenie jednego z jonów wody, aby można było obliczyć stężenie drugiego. Jeżeli stężenie jonów OH- wynosi na przykład 1∙10-9 mol/dm3 to stężenie jonów H+ oblicza się z równania:
![]()
W chemicznie czystej wodzie (odczyn obojętny) stężenia obu jonów są równe i wynoszą 1∙10-7 mol/dm3
Ilościowe określenie odczynu roztworu w formie stężenia jonów nie jest wygodnie z uwagi na rząd wielkości spotykanych liczb. Dlatego chemicy oprócz stężenia jonów używają do określenia odczynu umownych „stopni kwasowości”, zwanych pH roztworu (inaczej: wykładnikiem stężenia jonów wodorowych). Jeżeli stężenie molowe jonów wodorowych można przedstawić w postaci liczby 1∙10n (np. 1∙10-5), a taka dokładność często wystarczy, to pH = 5, a więc w tym przypadku pH jest wykładnikiem potęgowym (n) ze zmienionym znakiem.
Jeżeli stężenie molowe jonów H+ wynosi 1∙10-1 to pH wynosi 1, a odczyn będzie silnie kwaśny.
Jeżeli stężenie molowe jonów H+ wynosi 1∙10-7 to pH wynosi 7, a odczyn będzie obojętny.
Jeżeli stężenie molowe jonów H+ wynosi 1∙10-13 to pH wynosi 13, a odczyn będzie silnie zasadowy.
Funkcja pH ma tę właściwość, że jej wartość zmienia się stosunkowo nieznacznie przy dużych zmianach stężenia: dziesięciokrotna zmiana stężenia daje zmianę pH o jednostkę. Warto zwrócić uwagę, że im bardziej kwaśny roztwór, czyli im większe stężenie jonów H+, tym mniejsza wartość pH.
pH<7 pH>7
odczyn kwaśny odczyn zasadowy
pH = - log [H+] (definicja)
pH krwi:
W bardzo wąskich granicach utrzymuje się aktualna reakcja krwi, czyli jej odczyn lub oddziaływanie kwasowo - zasadowe. Mimo nieustannego powstawania w organizmie wartości kwaśnych i zasadowych oraz częstych okazji wnikania ich z zewnątrz, krew jest prawie obojętna, a właściwie lekko zasadowa, gdyż jej pH wynosi 7,4 z wahaniami od 7,3 do 7,5. Tak wyrażony odczyn w krwi żylnej ma pH 7,34, a tętniczej 7,36, gdy oddychanie wynosi 40mm Hg. Wahanie powyżej pH 7,8 i poniżej 6,8 są zupełnie niedopuszczalne, gdyż wtedy nie mogą już działać enzymy, denaturują się białka i ustaje wymiana gazów oddechowych.
Udział buforów, płuc i nerek w utrzymaniu równowagi kwasowo - zasadowej ustroju:
Bufory krwi, czyli związki chemiczne, które pozwalają utrzymać stałą wartość pH (wskaźnika kwasowości) tej tkanki. W warunkach fizjologicznych pH krwi utrzymuje się w granicach od 7.35 do 7.45. Taka precyzyjna regulacja pH krwi jest niezwykle ważna dla organizmu, bo nadmierne obniżenie albo podwyższenie pH prowadzi do zmiany kształtu cząsteczek białka, zmian aktywności enzymów, nieprawidłowego przenikania jonów przez błony białkowo-lipidowe... Spadek pH krwi poniżej 7.0 albo jego wzrost powyżej 7.8 prowadzi do śmierci.
Nasze ciało potrafi regulować pH krwi (i innych tkanek) na różne sposoby. W kontrolowaniu gospodarki kwasowo-zasadowej organizmu uczestniczą m.in. nerki (które przy obniżeniu pH wydalają nadmiar kationów wodorowych m.in. w postaci jonów amoniowych NH4+) i płuca (usuwanie dwutlenku węgla z wydychanym powietrzem ułatwia podwyższenie pH krwi). Istnieją różne choroby, które prowadzą do zaburzeń kwasowości płynów ustrojowych, na przykład nie leczona cukrzyca może doprowadzić do kwasicy (nadmiernego spadku pH), a zbyt częste i głębokie oddechy - tak zwana hiperwentylacja, którą spotyka się w chorobach psychicznych, na przykład w nerwicy - do zasadowicy. Te wszystkie zaburzenia można podzielić na cztery główne grupy w zależności od tego, czy ich przyczyną są zaburzenia procesów metabolicznych organizmu, czy też nieprawidłowe działanie układu oddechowego: kwasice metaboliczne, kwasice oddechowe, zasadowice metaboliczne i zasadowice oddechowe.
Rodzaje buforów i mechanizm ich działania. Bufor wodorowęglanowy i hemoglobinowy:
Roztwory buforowe służą do utrzymania stosunkowo stałego odczynu roztworów. Stosuje się je do wielu przemysłowych procesów, wymagających utrzymywania w miarę stałego pH - np. przy produkcji barwników, leków syntetycznych oraz w procesach fermentacyjnych, a także w poligrafii, przy druku w technice offsetowej. Wiele buforów jest też stosowanych do kontrolowania pH gotowych produktów spożywczych, kosmetyków i leków. Niektóre bufory (np. boranowy) są same stosowane jako substancje lecznicze - np. do przemywania poparzonej skóry lub oczu.
Do najważniejszych buforów należą:
bufor octanowy: CH3COOH, CH3COONa w zakresie pH = 3,5 - 6
bufor amonowy: NH3* H2O, NH4Cl w zakresie pH = 8 - 11
bufor fosforanowy: KH2PO4, K2HPO4 w zakresie pH = 5,5 - 8
bufor boranowy: H3BO3, Na2B4O7 w zakresie pH = 7 - 9
Bufory utrzymują ściśle określone pH ustroju wszystkich organizmów, którego zachwianie może spowodować śmierć organizmu. Bufory krwi człowieka utrzymują pH w granicach: 7.35 - 7.45.
W organizmach ludzkich znaczącą rolę pełnią bufory:
Mechanizm działania buforu najłatwiej jest prześledzić na przykładzie układu słabego kwasu i komplementarnej do niego soli. W tym przypadku głównym źródłem silnej zasady (A-) nie jest słabo dysocjujący kwas lecz mocno zdysocjowana sól (XA):
XA ↔ X+(aq) + A-(aq) (1)
Niezależnie od wyjściowych składników bufora, po ich rozpuszczeniu w wodzie i częściowej dysocjacji tworzy się równowaga słabego kwasu (HA) i sprzężonej z nim mocnej zasady (A-):
HA(aq) + H2O ↔ H3O+(aq) + A-(aq) (2)
która jest odpowiedzialna za odporność buforu na zmiany pH.
Ze względu na dużą ilość jonów A- dostarczanych w reakcji (1) przez sól, równowaga opisana równaniem (2) jest bardzo silnie przesunięta w stronę kwasu (HA). Można powiedzieć, że w tego rodzaju buforze niemal cała ilość jonów A- pochodzi z soli, zaś słaby kwas (HA) pozostaje w roztworze w formie prawie nie zdysocjowanej. Zadaniem soli jest więc w sumie blokowanie dysocjacji słabego kwasu.
W momencie dodania do roztworu buforowego silnej zasady, reaguje ona z jonami hydroniowymi (H3O+(aq)), które jednak są natychmiast regenerowane przez dysocjację kwasu (HA), którą uruchamia właśnie fakt znikania jonów hydroniowych w równowadze opisanej równaniem (2). W momencie dodania silnego kwasu, silna zasada sprzężona (A-), która występuje cały czas w dużym stężeniu po prostu reaguje z tym kwasem i w rezultacie pH całego układu się nie zmienia.
Na zmianę pH najszybciej reagują następujące uklady buforowe krwi. Pierwszy z nich to bufor wodorowęglanowy (HCO3+ = H2CO3). Cząsteczka kwasu węglowego (H2CO3) może rozpadać się na cząsteczkę wody (H2O) i dwutlenku węgla (CO2) i odwrotnie, może z tych cząsteczek powstawać - dlatego pH krwi może być regulowane przez oddychanie (usuwanie CO2 z wydychanym powietrzem prowadzi do spadku stężenia kwasu węglowego we krwi i podwyższenia pH). Bufor wodorowęglanowy to najważniejszy bufor krwi: odpowiada za mniej więcej trzy czwarte pojemności buforowej krwi.
Na drugim miejscu pod względem znaczenia jest bufor hemoglobinowy (HbH = Hb- + H+; HbHO2 = HbO2- + H+). Utlenowana hemoglobina łatwiej oddaje kationy wodorowe, niż hemoglobina nieutlenowana i odwrotnie - odłączenie się tlenu od hemoglobiny ułatwia przyłączenie się do niej jonów H+ (dzięki temu w tkankach obwodowych hemoglobina jednocześnie oddaje tlen i przyłącza kationy wodorowe, które powstały na przykład w beztlenowych przemianach metabolicznych).
Wiązanie peptydowe - powstawanie:
Wiązanie peptydowe to umowna nazwa wiązania amidowego występującego między aminokwasami, łączy grupę α-aminową jednego aminokwasu z grupą α - karboksylową drugiego aminokwasu. Występuje ono w dwóch formach rezonansowych: cis i trans. Dzięki bliskości wiązania podwójnego pomiędzy węglem karbonylowym i tlenem wiązanie peptydowe wykazuje częściowo cechy wiązania podwójnego. Możliwa jest rotacja wokół wiązania między atomem azotu oraz atomem węgla należącym do podstawnika R1 i R2, natomiast zahamowana jest rotacja wokół wiązania między węglem karbonylowym oraz azotem, co nadaje płaski charakter grupom peptydowym.
Wiązanie peptydowe
Wiele aminokwasów połączonych wiązaniami peptydowymi tworzy oligopeptydy (umownie, do 10 reszt aminokwasowych), polipeptydy (do 100 reszt) oraz białka (powyżej 100 reszt).
Najczęściej obiema cząsteczkami są α - aminokwasy naturalne. Polimery naturalne powstałe z połączenia aminokwasów wiązaniami peptydowymi to białka. Wiązania peptydowe występują też w polimerach syntetycznych zwanych poliamidami, w tym przypadku jednak identyczne chemicznie wiązania są nazywane wiązaniami amidowymi.
Fragment białka z zaznaczonym wiązaniem peptydowym
Wiązanie peptydowe tworzą też często łańcuchy boczne aminokwasów w białkach, takich jak lizyna, z cząsteczkami przyłączonymi do białka (koenzymami).
Aminokwasy - podział, własności:
Aminokwasy są związkami dwu - lub wielofunkcyjnymi, których cząsteczki zawierają grupy karboksylowe i aminowe. Ich wzór ogólny można zapisać następująco:
Najprostszym aminokwasem jest kwas aminooctowy zwany też glicyną. Jest on białą, krystaliczną substancją stałą, dość dobrze rozpuszczalną w wodzie/ Odczyn roztworu wodnego jest obojętny.
Jedną z najważniejszych reakcji aminokwasów jest proces kondensacji, w którym z dwóch cząsteczek aminokwasów powstaje związek zwany dipeptydem.
Poszczególne α - aminokwasy różnią się strukturą rodnika. Stosuje się różne kryteria ich podziału. Rozróżnia się aminokwasy alifatyczne i aromatyczne, a w zależności od ilości grup aminowych i karboksylowych aminokwasy mono - lub di - aminowe lub karboksylowe. Rodniki aminokwasów cysteiny i metioniny w swojej budowie zawierają atom siarki (są to aminokwasy siarkowe). Rodniki waliny, leucyny i izoleucyny posiadają rozgałęziony łańcuch alifatyczny (aminokwasy rozgałęzione). Prolina jest z kolei aminokwasem (kwasem pirolidyno - karboksylowym). Często aminokwasy dzieli się biorąc pod uwagę hydrofobowość lub hydrofilowość łańcucha bocznego. Aminokwasy z niepolarnymi rodnikami węglowodorowymi (glicyna, alanina, walina, leucyna i izoleucyna) lub zawierające grupę funkcyjną o znikomej polarności (prolina, fenyloalanina, tryptofan, metionina i cystyna) zalicza się do aminokwasów hydrofobowych.
Ze względu na liczbę grup aminowych i karboksylowych wyróżnia się aminokwasy:
obojętne - gdy jest tyle samo (zwykle po jednej) grup aminowych i karboksylowych (alanina, cysteina, fenyloalanina, glicyna, metionina)
kwasowe - gdy przeważa liczba grup karboksylowych (kwas asparaginowy, kwas glutaminowy)
zasadowe - gdy przeważa liczba grup aminowych (arginina, histydyna, lizyna)
Aminokwasy egzo - i endogenne:
Aminokwasy egzogenne , nazywane też aminokwasami niezbędnymi - jest to grupa aminokwasów, które nie mogą być syntetyzowane w organizmie zwierzęcym i muszą być dostarczane w pożywieniu, w przeciwieństwie do aminokwasów endogennych. Żywienie pokarmami ubogimi w aminokwasy niezbędne może doprowadzić do zaburzeń chorobowych. Do aminokwasów niezbędnych dla człowieka zalicza się 8 aminokwasów egzogennych z dwoma dodatkowymi (histydyna i arginina) u dzieci.
Aminokwasy egzogenne u człowieka
• fenyloalanina (phenylalanine, Phe)
• izoleucyna (isoleucine, Ile)
• leucyna (leucine, Leu)
• lizyna (lysine, Lys)
• metionina (methionine, Met)
• treonina (threonine, Thr)
• tryptofan (tryptophan, Trp)
• walina (valine, Val)
Aminokwasy endogenne to aminokwasy, które organizm zwierzęcy może syntetyzować samodzielnie, w przeciwieństwie do aminokwasów egzogennych, które musi przyjmować systematycznie wraz z pożywieniem. U różnych zwierząt różne aminokwasy można zaliczyć do jednej z tych dwu grup, aczkolwiek u większości kręgowców są to te same aminokwasy, co u człowieka. Dostępne w literaturze zestawienia aminokwasów endogennych różną się między sobą. Jedne uwzględniają tylko aminokwasy wchodzące w skład białek, a inne również takie, które funkcjonują w ustroju jako samodzielne związki chemiczne biorące udział w rozmaitych procesach metabolizmu. Rozbieżności dotyczą też tego czy zaliczać do aminokwasów endogennych te, które mogą syntetyzowane wewnątrz organizmu, ale w wyniku przekształcenia aminokwasów egzogennych.
Aminokwasy endogenne u człowieka
• alanina (alanine, Ala)
• asparagina (asparagine, Asn)
• cysteina (cysteine, Cys)
• cystyna (cystine)
• cytrulina (citruline)
• glicyna (glycine, Gly)
• glutamina (glutamine, Gln)
• homoseryna (homoserine, Hse)
• hydroksylizyna
• hydroksyprolina (hydroksyproline)
• karnityna (carnitine)
• kwas gamma - aminomasłowy (gamma-aminobutyric acid)
• kwas asparaginowy (aspartic acid, Asp)
• kwas glutaminowy (glutamic acid, Glu)
• ornityna (ornithine)
• prolina (proline, Pro)
• seryna (serine, Ser)
• tauryna
Istnieją również aminokwasy warunkowo zbędne w pożywieniu (tzw. względnie egzogenne), które mogą być syntetyzowane wewnątrz ustroju z innych aminokwasów egzogennych, jednak przy nieodpowiedniej diecie lub innych zmianach metabolizmu, ich synteza wewnątrzustrojowa może być niewystarczająca, stąd wymagane może być ich przyjmowanie z zewnątrz. Należą do nich:
• arginina (arginine, Arg),
• histydyna (histidine, His),
• tyrozyna (tyrosine, Tyr),
przy czym arginina i histydyna uważane są za aminokwasy egzogenne u dzieci, a ponadto histydyna jest egzogenna dla osób znacznie zwiększających białkową masę ciała, np. dla kulturystów.
Pochodne aminokwasów biologicznie czynne - dopomina, noradrenalina, adrenalina, histamina, serotonina:
Dopamina (C8H11NO2), katecholaminowy neuroprzekaźnik syntezowany i uwalniany przez dopaminergiczne neurony ośrodkowego układu nerwowego.
Dopamina działa przez swoiste receptory zlokalizowane w błonie pre - jak i postsynaptycznej. Odgrywa odmienną rolę w zależności od miejsca swego działania:
w układzie pozapiramidowym jest odpowiedzialna za napęd ruchowy, koordynację oraz napięcie mięśni. W chorobie Parkinsona występuje niedobór dopaminy
w układzie rąbkowym (limbicznym) jest odpowiedzialna za procesy emocjonalne, wyższe czynności psychiczne oraz w znacznie mniejszym stopniu procesy ruchowe
w podwzgórzu jest związany głównie z regulacją wydzielania hormonów, a szczególnie prolaktyny (stąd inną nazwą dopaminy jest prolaktostatyna - PIH (Prolactin Inhibitory Hormone) i gonadotropin
Dopamina jest syntetyzowana także w tkankach obwodowych (kanaliki nerkowe i nerkowe naczynia krwionośne, pęcherzyki płucne, trzustka oraz naczynia krwionośne płuc i serca) i wykazuje tam aktywność autokrynną.
Dopamina jest także stosowana jako lek, w postaci kroplówek, w zapobieganiu ostrej niewydolności nerek (zwiększa perfuzję nerkową), a w większych dawkach podwyższa ciśnienia tętnicze i działa dodatnio na siłę skurczu mięśnia sercowego i z tego względu jest stosowany we wstrząsie septycznym, kardiogennym, pourazowym, po operacjach kardiochirurgicznych oraz w zaostrzeniu przewlekłej niewydolności krążenia.
Dopamina nazywana jest również "hormonem szczęścia", gdyż pojawienie się jej w przestrzeniach między neuronami w jądrze półleżącym, zewnętrznie objawia się poczuciem euforii. Cechą większości substancji uzależniających jest bezpośrednie lub pośrednie nasilenie dopaminergicznej impulsacji w układzie mezolimbicznym, co przejawia się zwiększonym stężeniem dopaminy w jądrze półleżącym przegrody. Główne działanie kokainy polega na stymulowaniu wydzielania dopaminy w mózgu. Odstawienie substancji narkotycznej wywołuje patologiczne obniżenie stężenie dopaminy w tej strukturze mózgu, co objawia się dysforią oraz objawami głodu narkotykowego.
Z drugiej strony, według niektórych teorii nadmierny poziom dopaminy jest jedną z przyczyn schizofrenii. Jedną z przyczyn zespołu Tourette'a jest zaburzenie dozowania ilości dopaminy.
Dopamina
Noradrenalina - hormon, neuroprzekaźnik wydzielany w części rdzeniowej nadnerczy, zwykle razem z adrenaliną w sytuacjach powodujących stres. Wzór sumaryczny: C8H11NO3
Wyrzut noradrenaliny do krwi powoduje, że szybko dociera ona do mózgu, który na jej obecność reaguje przyspieszeniem rytmu serca, przemianą glikogenu w glukozę, napięciem mięśni oraz poszerzeniem źrenic (co jest skutkiem ubocznym). Noradrenalina wpływa dwojako na układ krążenia: zwęża naczynia obwodowe, natomiast rozszerza naczynia wieńcowe w sercu. Działa trochę słabiej niż adrenalina.
Noradrenalina jest wykorzystywane także jako neuroprzekaźnik przez niektóre neurony pnia mózgu i układu współczulnego. Wewnątrz pnia mózgu noradrenalina produkowania jest w miejscu sinawym, miejsce to reguluje stopień pobudzenia mózgu jak i funkcje automatyczne takie jak termoregulacja. Silny stres zaburza działanie miejsca sinawego.
Noradrenalina
Adrenalina - hormon i neuroprzekaźnik katecholaminowy wytwarzany przez gruczoły dokrewne pochodzące z grzebienia nerwowego (rdzeń nadnerczy, ciałka przyzwojowe, komórki C tarczycy) i wydzielany na zakończeniach włókien współczulnego układu nerwowego.
Adrenalina odgrywa decydującą rolę w mechanizmie stresu, czyli błyskawicznej reakcji organizmu człowieka i zwierząt kręgowych na zagrożenie, objawiających się przyspieszonym biciem serca, wzrostem ciśnienia krwi, rozszerzeniem oskrzeli, rozszerzeniem źrenic itp. Oprócz tego adrenalina reguluje poziom glukozy (cukru) we krwi, gdyż jest koenzymem uruchamiającym przemianę glikogenu w glukozę.
Adrenalina występuje również w roślinach. Jej znaczenie farmakologiczne jest ograniczone z powodu niewielkiej trwałości hormonu.
Adrenalina należy do szeregu fenetylamin. Pod względem chemicznym jest pochodną katecholu, która w organizmach żywych jest otrzymywana w wyniku reakcji dwóch aminokwasów - fenyloalaniny i tyrozyny.
Działanie adrenaliny polega na bezpośrednim pobudzeniu zarówno receptorów α - jak i β - adrenergicznych, przez co wykazuje działanie sympatykomimetyczne. Wyraźny wpływ na receptory α widoczny jest wobec naczyń krwionośnych, ponieważ w wyniku ich skurczu następuje wzrost ciśnienia tętniczego. Adrenalina przyspiesza czynność serca jednocześnie zwiększając jego pojemność minutową, w nieznaczny sposób wpływając na rozszerzenie naczyń wieńcowych; rozszerza też źrenice i oskrzela ułatwiając i przyśpieszając oddychanie. Ponadto hamuje perystaltykę jelit, wydzielanie soków trawiennych i śliny oraz obniża napięcie mięśni gładkich. Adrenalina jako hormon działa antagonistycznie w stosunku do insuliny - przyspiesza glikogenolizę, zwiększając stężenie glukozy w krwi. Wyrzut adrenaliny do krwi jest jednym z mechanizmów uruchamianych przy hipoglikemii. Zwiększa ciśnienie rozkurczowe w aorcie oraz zwiększa przepływ mózgowy i wieńcowy. Poprawia przewodnictwo i automatykę w układzie bodźcowo-przewodzącym. Zwiększa amplitudę migotania komór, przez co wspomaga defibrylację.
Adrenalina
Histamina - organiczny związek chemiczny, heterocykliczna amina pochodna imidazolu.
Związek ten jest naturalnym czynnikiem zwiększającym przepuszczalność naczyń żylnych zawłosowatych, w wyniku czego dochodzi do powstania obrzęków, powoduje również rozszerzenie naczyń krwionośnych, w wyniku czego pojawia się również zaczerwienienie. W sercu histamina działa na receptory H2 powodując przyspieszenie tętna, zwiększenie wydajności serca. Stymuluje wydzielanie soków trawiennych w żołądku.
W wielu artykułach żywnościowych, przede wszystkim wytwarzanych i dojrzewających przy udziale procesów fermentacyjnych, także nieświeżych, lub silnie skażonych mikrobiologicznie występują aminy biogenne, a w tym histamina. Prekursorami tych amin są aminokwasy uwalniane z białek na drodze hydrolizy.
Histamina występuje głównie w surowcach rybnych, a duża jej zawartość wiąże się z zatruciem pokarmowym. Zawartość histaminy w surowcach i przetworach rybnych zależy przede wszystkim od ilości wolnej histydyny w mięśniach, obecności aktywatorów i inhibitorów dekarboksylaz, a także od rodzaju i wielkości populacji bakteryjnej.
Histamina zawarta w żywności nie ulega rozkładowi w procesie obróbki termicznej. spożyta z pokarmem jest w dużym stopniu wiązana i dezaktywowana przez diaminooksydazę w przewodzie pokarmowym, co obniża jej toksyczność. W przypadku niewystarczającej aktywności diaminooksydazy spowodowanej np. predyspozycjami genetycznymi, zażywaniem leków lub spożytym alkoholem - histamina może powodować efekty toksyczne.
Powstaje w wyniku dekarboksylacji (w obecności PLP) histydyny. Jest wydzielana zarówno przez bazofile (granulocyty zasadochłonne) jak i przez mastocyty jako następstwo reakcji zapalnej.
Jest również jednym z neuroprzekaźników, występuje w podwzgórzu.
Zatrucie spowodowane histaminą nosi nazwę scombrotoxism. W dużych ilościach wywołuje gwałtowne rozszerzenie naczyń krwionośnych i spadek ciśnienia krwi. W ilości od 200 do 1000 ppm powoduje: wymioty, bóle głowy, mdłości, wysoką gorączkę, wysypki skórne, nadmierne pocenie się, trudności w oddychaniu. W przypadku obecności histaminy w mięsie w ilości powyżej 1000 ppm wywołane zatrucia pokarmowe mogą zakończyć się śmiercią. Jej toksyczność zależy nie tylko od dawki, ale również od indywidualnych predyspozycji organizmu, tj. funkcjonowania mechanizmu zatrzymywania i detoksykacji oraz od obecności w pokarmie innych biologicznie czynnych amin.
Histamina
Serotonina (C10H12N2O) - biologicznie czynna amina, hormonem, który pełni funkcję m.in. ważnego neuroprzekaźnika w ośrodkowym układzie nerwowym i w układzie pokarmowym. Związek ten występuje też w trombocytach.
Zadowolenie związane z wykonywaniem przyjemnych czynności, jak np. jedzenie czekolady jest prawdopodobnie wywołane wydzielaniem serotoniny w jądrach szwu. Stąd mylne przekonanie, że czekolada działa przeciwdepresyjnie. Serotonina jest również niezbędna do snu - u zwierząt doświadczalnych blokowanie jej syntezy powoduje bezsenność. Poziom tej substancji w mózgu wpływa również na potrzeby seksualne, zachowania impulsywne i apetyt.
Pod względem chemicznym serotonina należy do rodziny tryptamin. Niektóre substancje psychoaktywne, np. LSD, DMT czy psylocybina mają podobną budowę jak serotonina i często wpływają na jej poziom w mózgu.
Leki wpływające na mechanizmy działania serotoniny są stosowane w lecznictwie w postaci takich grup leków jak inhibitory MAO oraz SSRI takie jak na przykład fluoksetyna (Prozac). Są to leki przeciwdepresyjne działające dopiero po dłuższym czasie zażywania (tydzień-dwa). Mechanizm leków czy substancji psychoaktywnych wpływających na poziom serotoniny w mózgu polega zwykle na blokowaniu jej wychwytu zwrotnego. Należy uważać przy ich stosowaniu, by nie doprowadzić do zespołu serotoninowego.
Serotonina
Transaminacja, dezaminacja, dekarboksylacja aminokwasów - przykłady reakcji:
Transaminacja jest to reakcja chemiczna przeniesienia grupy aminowej z aminokwasu na ketokwas, w wyniku czego powstaje nowy aminokwas i nowy ketokwas. Proces ten katalizowany jest przez transaminazy (aminotransferazy).
Dezaminacja - proces odrywania grup aminowych od cząsteczek związków organicznych (np aminokwasów). W wyniku reakcji powstaje ketokwas będący szkieletem węglowym oraz amoniak. Jest to pierwszy proces związany z degradacją aminokwasu umożliwiający późniejsze wykorzystanie aminokwasu jako substratu oddechowego. Dezaminacja nie wymaga obecności tlenu. Warunkiem jest odpowiednia ilość azotanów oraz organizmów denitryfikacyjnych. Przeprowadzana jest przez grupę bakterii jelitowych: E.coli, Enterobacter aerogenos. Mikroorganizmy te wytwarzają enzymy takie jak: ureazy, dezaminazy.
Reakcją dekarboksylacji nazywamy taką reakcję, w której grupa karboksylowa zostaje zastąpiona atomem wodoru. Bywa ona stosowana do usuwania grupy karboksylowej z cząsteczki. Szczególnie łatwo reakcja ta przebiega w przypadku niektórych kwasów dikarboksylowych, na przykład kwasu malonowego. Przykładem takiej reakcji jest na przykład ogrzewanie octanu sodu z wodorotlenkiem wapnia i tlenkiem wapnia co daje metan.
Cykl mocznikowy:
Cykl ornitynowy, zwany też cyklem mocznikowym lub mocznikowym cyklem Krebsa to cykl przemian biochemicznych (reakcji enzymatycznych) trzech aminokwasów: ornityny, cytruliny i argininy prowadzący do powstania mocznika.
Do cyklu wprowadzany jest karbamoilofosforan powstały z amoniaku i dwutlenku węgla. Cykl przebiega w mitochondriach i cytoplazmie komórek wątroby (hepatocytów) i wymaga dostarczenia energii w postaci ATP, a jego produktem końcowym jest mocznik.
Reakcje zużywania aminokwasów rozpoczynają się od odłączenia grupy aminowej w procesie dezaminacji. Produktami tych reakcji są łańcuchy węglowe (tzw. ketokwasy) oraz jon amonowy. W komórkach człowieka łańcuchy węglowe po przemianach mogą być włączone w glikolizę lub do cyklu Krebsa. Jon amonowy jest silnie toksyczny. W organizmie człowieka jest więc szybko przekształcany w substancję mniej toksyczną i dobrze rozpuszczalną w wodzie - mocznik. W ciągu doby człowiek wydala średnio kilkanaście gramów mocznika w postaci stężonego moczu.
W rzeczywistości w komórkach zużycie większości aminokwasów rozpoczyna się od przeniesienia reszty aminowej (-NH2) (reakcja transaminacji) z rozkładanego aminokwasu na jedną z dwóch cząsteczek: glutaminian lub pirogronian. Ten pierwszy przekształca się wówczas w glutaminę, drugi w alaninę. Aminokwasy te są wydzielane do krwi i wędrują do wątroby. W komórkach wątroby glutamina ulega dezaminacji, a powstający jon amonowy natychmiast przetwarzany jest w tak zwany karbamylofosforan. Ten włączony jest do cyklu mocznikowego (ornitynowego). Zachodzi częściowo w cytoplazmie, częściowo w mitochondrium, gdzie sprzężony jest z cyklem Krebsa. Cykl mocznikowy jest silnie endoergiczny - do wytworzenia 1 mola mocznika zużywane są 4 mole wiązań wysokoenergetycznych.
Reakcja enzymatyczna:
W czasie reakcji enzymatycznej cząsteczka substratu jest wiązana w określonym obszarze do cząsteczki enzymu w tzw. centrum aktywnym, przez co tworzy się kompleks enzym - substrat. Dzięki specyficznemu rozkładowi grup chemicznych w centrum, enzym oddziałuje na ugrupowania chemiczne substratu rozluźniając konkretne wiązanie chemiczne. W wyniku rozerwania tych wiązań substrat przekształca się w produkt, który uwalniany jest z kompleksu z enzymem. Enzym po powrocie do formy pierwotnej (w enzymach złożonych po przyłączeniu przenoszonych grup do innego związku) tworzy nowy kompleks z następną cząsteczką substratu itd.
Mechanizm łączenia enzymu z substratem tłumaczy się obecnie indukowanym dopasowaniem, polegającym na dopasowaniu kształtu enzymu do substratu i przekształceniu go w produkt. Przy tym enzym może zniekształcić substrat wymuszając w nim konformację podobną do stanu przejściowego. Przykładem może być wiązanie glukozy z heksokinazą.
Od czego zależy szybkość reakcji enzymatycznej:
Na szybkość reakcji enzymatycznej wpływają:
Stężenie substratu - szybkość reakcji jest proporcjonalna do stężeń substratów (wzrost stężenia przyspiesza reakcję).
Temperatura - wzrost temperatury powoduje wzrost szybkości katalizowanej reakcji (w ściśle ograniczonym zakresie) - podwyższenie powyżej pewnej granicy powoduje zniszczenie struktury III i II - rzędowej czyli denaturację białka enzymatycznego.
pH - każdy enzym ma optymalną wartość pH, przy którym jest największa szybkość reakcji. Dla większości enzymów optimum pH jest w zakresie 5 - 9.
Stężenie i aktywność enzymu - stężenie enzymu wpływa jedynie na szybkość początkową reakcji.
Stężenie produktu - wzrost stężenia produktu hamuje szybkość reakcji enzymatycznej.
Inhibitory - jony lub cząsteczki, które hamują szybkość reakcji enzymatycznej.
Aktywatory - dodatkowo przyspieszają reakcję enzymatyczną.
Izoenzymy:
Izoenzymy są to różne odmiany jednego enzymu, powstające przy udziale różnych genów strukturalnych i mające zasadniczo taką samą budowę i mechanizm katalityczny. Różnią się sposobem ich regulowania. np.: dehydrogenazy jabłczanowe pochodzącej z rożnych źródeł (np. wątroby szczura i Escherichia Coli) - chociaż obie te dehydrogenazy jabłczanowe katalizują taką samą reakcję ich właściwości fizyczne i chemiczne znacznie się różnią.
Koenzymy:
Koenzymy są to małocząsteczkowe, niebiałkowe związki organiczne decydujące o aktywności katalitycznej pewnych enzymów. Biorą udział w reakcjach przez oddawanie lub przyłączanie pewnych reagentów (atomów, grup atomów lub elektronów). Pozostają luźno związane z właściwym enzymem. Jako koenzymy funkcjonują w większości witaminy lub jony połączone odwracalnie z apoenzymem. Koenzymy pod względem chemicznym są nukleotydami czyli związkami, które składają się z cukru (pentoza: ryboza, deoksyryboza), zasady (purynowe: adenina, guanina; pirymidowe: tymina, cytozyna, uracyl) oraz z fosforanu (jednego lub kilku).
Funkcje biologiczne i podział białek - przykłady:
Funkcje białek:
Mechaniczno - strukturalna - funkcja podporowa, białka występujące w substancji pozakomórkowej, tkanka łączna - kolagen, laminina, elastyna, fibrylina.
Katalityczna (enzymatyczna) - biokatalizatory, regulujące szybkość reakcji chemicznych w organizmie oraz określające kierunek przemian w układach biologicznych (pepsyna katalizuje rozkład wiązań peptydowych, anhydraza węglanowa katalizuje syntezę i rozkład kwasu węglowego z dwutlenku węgla i wody).
Warunkują ruch uporządkowany - białka kurczliwe mięśni - aktyna, miozyna, troponina; ruch rzęsek i wici - dyneina; podziały komórkowe - tubulina.
Transportowa i magazynująca - hemoglobina - transport tlenu z płuc do tkanek i dwutlenku węgla oraz protonów z tkanek do płuc; mioglobina - magazynuje tlen w mięśniach; transferyna - transport żelaza; albumina - białko osocza będące nieswoistym transporterem bilirubiny, hormonów, witamin i leków.
Ochronna - immunoglobuliny IgG, IgM, IgE itd. są to białka o dużej swoistości rozpoznające substancje obce (antygeny) i wywołujące odpowiedź immunologiczną organizmu; białka szoku termicznego Hsp70, Hsp90, Hsp20 - białka pełniące funkcję ochronną wybranych struktur komórkowych w warunkach podwyższonej temperatury - przeciwdziałają denaturacji wrażliwych na temperaturę białek.
Regulatorowa - białka biorące udział w przekazywaniu sygnałów ze środowiska pozakomórkowego do wnętrza i odwrotnie: kalmodulina - białko zależne od Ca+2 bierze udział w regulacji aktywności kinaz i innych enzymów syntezy i rozkładu cyklicznych nukleotydów; białka regulatorowe błonowe G - GTP zależne, biorące udział w przekazywaniu sygnału hormonalnego do komórki.
Wytwarzania i przekazywania impulsów nerwowych - białka receptorowe biorące udział w reakcji komórek na specyficzne bodźce nerwowe: rodopsyna - białko fotoreceptorowe w komórkach pręcików siatkówki, receptor acetylocholiny - warunkujący prawidłową pobudliwość nerwowo - mięśniową (pobudzenie płytki motorycznej mięśnia)
Hormonalna - niektóre hormony mają budowę białkową. Biorą udział w utrzymaniu homeostazy ustrojowej i regulacji metabolizmu. Hormony tropowe - przedniego płata przysadki - gonadotropowy, tyreotropowy, somatotropowy (hormon wzrostu). Insulina - hormon trzustki obniżający stężenie glukozy we krwi.
Czynniki wzrostowe - warunkują procesy podziałów komórek macierzystych i procesy dojrzewania różnych komórek organizmu: erytropoetyna - wydzielana przez nerki, warunkuje rozwój erytrocytów, IGF - insulinopodobny czynnik wzrostowy - m.in. rozwój chondrocytów, EGF - naskórkowy czynnik wzrostowy - rozwój wielu komórek naskórkowych i nabłonkowych, TGF - transformujący czynnik wzrostowy - aktywuje i hamuje rozwój wielu komórek organizmu.
Ze względu na budowę i skład, dzielimy białka na proste i złożone. Białka proste zbudowane są wyłącznie z aminokwasów. Dzielimy je na następujące grupy: protaminy, histony, globuliny, albuminy, prolaminy, gluteiny, skleroproteiny. Białka złożone: chromoproteiny, fosfoproteidy, nukleoproteidy, lipidoproteiny, glikoproteiny, metaloproteidy.
Hemoglobina. Efekt Bohra:
Hemoglobina jest to 4 - rzędowa struktura zbudowana z 4 łańcuchów polipeptydowych, 2 łańcuchów α i 2 β, z których każdy zawiera grupę prostetyczna czyli hemową z centralnie umieszczonym atomem żelaza (Fe).
Hemoglobina to białko wiążące tlen, a jego funkcja to przenoszenie tlenu we krwi, z płuc do innych tkanek ciała w celu zaopatrzenia komórek w tlen, który jest niezbędny do przeprowadzenia fosforylacji oksydacyjnej. Występuje w krwinkach czerwonych.
Efekt Bohra - wiązanie tlenu przez hemoglobinę. Jest regulowane przez stężenie kation H+ i CO2 w otaczającej tkance. W tkance o szybkim metabolizmie takiej jak mięsień stężenie tego kationu wodoru i dwutlenku węgla jest duże. Powoduje to przesunięcie krzywej dysocjacji tlenu dla hemoglobiny w prawo co ułatwia jej uwalnianie tego tlenu w tkance. Hemoglobina pobierana z płuc roznosi go do tkanek a z tkanek zabiera dwutlenek węgla i przenosi do płuc. Kiedy krew powraca do płuc z CO2 gdzie stężenie kationu H+ i CO2 jest małe, a tlenu duże proces ulega odwróceniu.
Mioglobina - budowa, funkcja:
Mioglobina jest to białko globularne utworzone przez pojedynczy łańcuch polipeptydowy złożony ze 153 aminokwasów fałdujących się w 8 α - helis. Grupa prostetyczna w postaci hemu jest umiejscowiona w hydrofobowym zagłębieniu pofałdowanego łańcucha.
Mioglobina magazynuje tlen w tkankach w postaci gotowej do użycia przez komórki. Największe jej stężenie występuje w mięśniach szkieletowych i w mięśniu sercowym. Tlen służy do wytworzenia energii potrzebnej do skurczu mięśnia. Mioglobina wykazuje większe powinowactwo do tlenu niż hemoglobina
Skurcz mięśniowy. Udział jonów Ach, Ca++ w skurczu mięśniowym:
Bodziec nerwowy w postaci uwolnionej w płytce motorycznej acetylocholiny powoduje depolaryzację sarkolemy, w tym wszystkich kanalików T. Depolaryzacja kanalików T powoduje otwarcie kanałów wapniowych cystern brzeżnych, prowadząc do tysiąckrotnego wzrostu stężenia jonów wapnia w cytoplazmie. Jony wapnia łączą się z troponiną, która przemieszcza tropomiozyny, odsłaniając miejsca wiążące miozynę w aktynie. Obie główki miozyny „kroczą” (jak nogi) po aktynie. W efekcie miofilamenty cienkie wsuwają się pomiędzy miofilamenty grube, co powoduje skracanie sarkomerów; skracają się też lub zanikają prążek I oraz prążek H. Dzięki silnie rozgałęzionej triadzie zjawisko to przebiega jednocześnie we wszystkich sarkomach wszystkich miofibryli całego włókna, powodując jego skurcz. Po depolaryzacji sarkolemy dochodzi do jej repolaryzacji, w tym także repolaryzacji kanalików T i zamknięcia kanałów wapniowych cystern brzeżnych. Pompa wapniowa wypompowuje jony wapnia z sarkoplazny do wnętrza cystern. Stężenie jonów wapnia w sarkoplazmie spada, tropomiozyna wraca na swoje miejsce, miozyna traci kontakt z aktyną i dzięki charakterystycznemu ułożeniu włókienek desminy dochodzi do powrotu położenia miofilamentów cienkich względem grubych, czyli do rozkurczu sarkomerów i całego włókna,
Białka mięśniowe (aktyna, miozyna, tropomiozyna, troponiny TnI, TnC, TnT):
Aktyna - białko wchodzące w skład kurczliwych filamentów aktynowych, stanowiących obok mikrotubul i filamentów pośrednich cytoszkielet komórki eukariotycznej. Nazwa nawiązuje do jej zdolności do stymulacji hydrolizy ATP. Aktyna występuje w dwóch postaciach: globularnej (G-aktyna o masie 42 kDa) i fibrylarnej (F - aktyna). Cząsteczka G - aktyny zawiera miejsca przyłączania miozyny.
Miozyna - białko wchodzące w skład kurczliwych włókien grubych w komórkach, zwłaszcza w mięśniach. Bierze udział w konstrukcji sarkomeru składającego się z włókien cienkich (zawierających aktynę), grubych i elastyny. Miozyna była jednym z pierwszych białek o poznanej sekwencji aminokwasów, sekwencji mRNA, oraz oznaczonej konformacji przestrzennej łańcucha polipeptydowego. Podobne białkowe włókna biorą też udział w procesie kariokinezy, separując chromosomy przyczepione do telomerów w kierunku centromerów.
Tropomiozyna - białko fibrylarne (włókienkowe) mięśni o masie cząsteczkowej 50 - 150 kDa. Bierze udział w regulacji skurczu mięśni, razem z troponiną wchodzi w skład filamentów aktynowych.
Troponiny nie występują pozakomórkowo, wobec czego pojawienie się ich we krwi jest czułym i swoistym wskaźnikiem uszkodzenia komórek myocardium. Sercowe izoformy TnT (cTnT) i TnI (cTnI) są kodowane przez odrębne geny i różnią się składem aminokwasowym oraz strukturą od izoform występujących w mięśniach szkieletowych. TnC występuje we wszystkich mięśniach w postaci jednej izoformy.
Typy włókien mięśniowych:
Są trzy główne typy włókien mięśniowych różniące się budową i możliwościami. Typ I to włókna tzw. tlenowe: wolnokurczliwe, o małej sile ale dużej odporności na zmęczenie (wytrzymałościowe). Typ II to włókna tzw. beztlenowe: szybkokurczliwe, o dużej sile i małej odporności na zmęczenie (szybkościowe). Typ III to włókna pośrednie (mieszane), tlenowo - beztlenowe: dość duża szybkość skurczu i odporność na zmęczenie, średnia siła skurczu. Z wiekiem występuje tendencja do zmiany włókien szybkich w wolne (wytrzymałościowe).
ATP - nukleotyd wysokoenergetyczny:
Cząsteczka ATP (adenozynotrójfosforan) składa się z tzw. zasady azotowej adeniny, cukru rybozy i trzech połączonych szeregowo reszt kwasu fosforowego. Dla biochemika szczególnie interesujące są owe trzy reszty fosforanowe, a ściślej ostatnia z nich, bowiem jej odszczepieniu przy udziale wody, czyli hydrolizie, towarzyszy wyzwolenie znacznych ilości energii. Jeśli reakcja zachodzi w probówce, energia ta uwalnia się w postaci ciepła. Żywa komórka natomiast potrafi wykorzystać ją jako siłę napędową wszystkich prawie procesów życiowych, takich jak ruch i zmiana kształtu komórki, transport substancji przez błony komórkowe, a więc na przykład pobieranie składników pokarmowych i wydalanie produktów przemiany materii, i wreszcie wszystkie procesy syntez biologicznych potrzebnych m.in. dla wzrostu i rozmnażania się. Również dzięki energii wyzwolonej z ATP kurczą się mięśnie, nerwy przewodzą bodźce, a mózg... myśli.
O tym, jak znaczny jest to nakład energii, niech świadczy fakt, że dorosły człowiek w stanie spoczynku zużywa w ciągu doby około 40 kg ATP, przy czym ilość ta może wzrosnąć nawet kilkakrotnie na skutek wysiłku fizycznego. Tymczasem faktyczna zawartość ATP w naszym ciele wynosi kilkadziesiąt gramów. Wynika z tego, że intensywnemu zużyciu ATP musi towarzyszyć jego równie intensywne odtwarzanie, czyli resynteza.
Skoro hydrolizie ATP towarzyszy wyzwolenie energii, to proces odwrotny może zajść tylko w przypadku dostarczenia, co najmniej takiej samej, a w istocie znacząco większej jej ilości. Od kilkudziesięciu lat wiemy, że zapewniają to przede wszystkim reakcje utleniania biologicznego, czyli oddychania komórkowego. Zachodzą one w wewnątrzkomórkowych organellach, mitochondriach, tak małych, że strukturę ich poznaliśmy dopiero dzięki mikroskopowi elektronowemu. Pozostawało tajemnicą, w jaki sposób przekształcone substancje pokarmowe, ulegając "spaleniu" w komórkach naszego ciała, dostarczają energii umożliwiającej resyntezę ATP z produktów jego rozpadu, czyli adenozynodifosforanu, w skrócie ADP, i kwasu fosforowego w procesie zwanym oksydacyjną fosforylacją.
Drogi resyntezy ATP w mięśniach:
Proces syntezy odbywa się etapowo. Najpierw do odpowiedniego miejsca katalitycznego enzymu przyłącza się cząsteczka ADP i kwasu fosforowego. W następnym etapie zachodzi zmiana kształtu enzymu, tzw. zmiana konformacji, prowadząca do odpowiedniego zbliżenia obu mających ze sobą przereagować cząsteczek, co niejako wymusza ich chemiczne połączenie i utworzenie ATP. Powstała w ten sposób cząsteczka ATP pozostaje jednak dalej związana z białkiem kompleksu enzymatycznego. Aby ją odczepić, konieczna jest dalsza zmiana struktury enzymu, a więc następna zmiana konformacji. Powoduje ona powrót do stanu wyjściowego, to jest takiego, przy którym możliwe staje się przyłączenie następnej cząsteczki ADP i kwasu fosforowego, po czym cykl zaczyna się od nowa. Zgodnie z tą teorią, energia potrzebna do syntezy ATP zużywa się nie tyle w samej reakcji chemicznego wiązania ADP z kwasem fosforanowym, co w procesie zmiany kształtu cząsteczki kompleksu enzymatycznego, a także, co ciekawe w odłączeniu już powstałego ATP od enzymu.
ATP na drodze tlenowej powstaje w mitochondriach. Błona wewnętrzna mitochondrium zawiera kompleksy łańcucha oddechowego. Właśnie ta błona (formująca specjalne wybrzuszenia, zwane grzebieniami) rozdziela wnętrze mitochondrium zwane matrix (macierzą) od przestrzeni międzybłonowej. Przestrzeń międzybłonowa oddzielona jest od cytoplazmy zewnętrzną błoną mitochondrialną, przez którą mogą być transportowane metabolity i jony. Przepuszczalność błony zewnętrznej jest większa niż błony wewnętrznej. Wewnętrzna błona mitochondrialna ma taką budowę, że transport przez nią jest ograniczony do specjalnych miejsc, takich jak kanały jonowe, białka przenośnikowe czy układy enzymów przenoszących metabolity. Taka budowa wewnętrznej błony mitochondrialnej umożliwia działanie łańcucha oddechowego i syntezę ATP. Zniszczenie tej struktury, np. rozpuszczenie błony wewnętrznej za pomocą detergentów, uniemożliwia działanie łańcucha oddechowego i zależną od niego syntezę ATP.
Fosfokreatyna - powstawanie, rola w skurczu mięśnia:
Fosfokreatyna - związek gromadzący energię w wiązaniach wysokoenergetycznych, występujący w tkance mięśniowej. Bierze udział w syntezie ATP, przekształcając się pod wpływem kinazy kreatynowej w kreatynę. Stosowany jest jako lek w chorobach serca. Od dawna uważano, że fosfokreatyna stanowi najważniejsze źródło energii w początkowej fazie wysiłku o maksymalnej intensywności. (Fosfokreatyna - PCr) PCr jest głównym i jedynym substratem energetycznym do resyntezy ATP podczas pierwszych 10 sekund wysiłku o maksymalnej intensywności. Jest go jednak niewiele w organizmie człowieka, wystarcza na kilka sekund wysiłku.
W mięśniu wykonującym pracę kosztem przemian tlenowych fosfokreatyna pełni ważną funkcję przenośnika wysokoenergetycznych grup fosforanowych.
Kinaza kreatynowa (CK) przenosi grupę fosforanową z ATP na kreatynę. Powstałe w tej reakcji ADP natychmiast wraca do mitochondrium po następną grupę fosforanową. Fosfokreatyna wyprodukowana w tej reakcji dyfunduje (lub może być transportowana) w pobliże filamentów, gdzie reaguje z ADP powstałym w wyniku aktywności miozyny (ATP - aza miozynowa). Kosztem ADP i fosfokreatyna powstaje ATP, który jest hydrolizowany w czasie pracy filamentów, a cząsteczka kreatyny dyfunduje w kierunku mitochondriów, aby przyłączyć następną grupę fosforanową.
NAD, FAD - znaczenie w przemianach biochemicznych.
NAD
Cząsteczka NAD jest dinukleotydem składającym się z adenozyno-5'-monofosforanu i nukleotydu nikotynamidowego połączonych ze sobą wiązaniem bezwodnikowym. Cząsteczka NAD+ wiąże jeden proton i dwa elektrony. Miejscem ich działania jest amid kwasu nikotynowego. Drugi proton pozostaje
w środowisku reakcji. Zredukowany NAD+ (NADH) przekazuje proton i elektrony na mitochondrialny łańcuch oddechowy, gdzie poprzez wiele ogniw pośrednich są one przekazywane na tlen, tworząc H2O. Procesowi temu towarzyszy powstawanie energii magazynowanej w postaci ATP.
FAD
Dinukleotyd flawinoadeninowy - koenzym pełniący funkcję przenośnika elektronów i protonów (wodoru).
Złożony z mononukleotydu flawinowego (FMN) (pochodnej ryboflawiny) i kwasu adenozynomonofosforowego (AMP). Jest koenzymem oksydoreduktaz, przenosi dwa protony i dwa elektrony, w efekcie czego utleniona forma FAD przechodzi odwracalnie w formę zredukowaną FADH2.
Udział acetylo - CoA w przemianach:
Energia w mitochondriach wytwarzana jest w wyniku przemian kwasu pirogronowego i utleniania krótkich łańcuchów kwasów tłuszczowych do acetylo - CoA i dalszych jego przemian w cyklu Krebsa i na łańcuchu transportu elektronów. Wytworzone w mitochondriach ATP jest transportowane (przez błony mitochondrialne) do cytoplazmy, w której jest wykorzystywane w metabolizmie komórki.
Cząsteczka acetylo - CoA (aktywny octan) zawiera wiązanie wysokoenergetyczne, którego rozpad dostarcza energii niezbędnej do syntezy cząsteczki cytrynianu.
Szybkość cyklu Krebsa jest zależna od tempa produkcji acetylo - CoA. Przekonuje o ty fakt, że maksymalne tempo przemian tlenowych glikogenu jest ponad dwukrotnie większe niż tempo przemian tłuszczu lub glukozy z osocza. Dowodzi to, że szybkość produkcji acetylo - CoA może być z różnych powodów ograniczona. Przyczyn opisywanego stanu rzeczy jest kilka:
Glikogen jest obecny we włóknie mięśniowym i może być bardzo szybko rozkładany. Fosforoliza glikogenu mięśniowego jest aktywowana przez jony Ca++, te same, które wydzielane są do sarkoplazmy w czasie skurczu
Glukoza przenoszona przez krew nie może być metabolizowana przez mięśnie ze zbyt dużą prędkością. Glukoza musi być najpierw wydzielona z wątroby kosztem rozkładu glikogenu.
Rozkład tłuszczu w tkance tłuszczowej i późniejszy jego metabolizm jest zależny od wzrostu poziomu hormonów, który jest znacznie wolniejszy niż wzrost szybkości przemian glikogenu.
Cykl Krebsa - lokalizacja, przebieg, regulacja, energetyka.
Cykl Krebsa, zwany także cyklem kwasu cytrynowego lub cyklem kwasów trójkarboksylowych, jest jedną z najważniejszych przemian katabolicznych w organizmie. Głównym zadaniem cyklu Krebsa jest przeniesienie atomów wodoru (elektronów) z grup acetylowych (acetylo - CoA) i H2O na koenzymy NAD+ i FAD. Powstałe w ten sposób zredukowane równoważniki - NADH i FADH2 - są substratami dla łańcucha oddechowego. Poszczególne reakcje cyklu Krebsa mogą być ponadto źródłem metabolitów dla innych przemian. Często zdarza się, że inne przemiany, np. reakcje aminokwasów, dostarczają kwasów będących metabolitami cyklu Krebsa.
Możliwości pracy tlenowej poszczególnych mięśni zależą od tego, z jaką maksymalną prędkością może zachodzić cykl Krebsa we włóknach mięśniowych.
Przebieg cyklu Krebsa:
Synteza cytrynianu
Izomeryzacja cytrynian - izocytrynian
Odwodorowanie i dekarboksylacja izocytrynianu
Oksydacyjna dekarboksylacja α - ketoglutaranu
Zamiana bursztynylo - CoA w bursztynian
Utlenianie bursztynianu
Uwodniene fumaranu
Utlenienie jabłczanu, powstawanie szczawiooctanu.
Regulacja cyklu Krebsa
Maksymalna szybkość przemian cyklu Krebsa w tkance zależy od ilości enzymów katalizujących je, a więc od ilości i wielkości mitochondriów w tkance, a co za tym idzie, ilość enzymów cyklu Krebsa jest bardzo duża , to szybkość tych przemian może być regulowana od bardzo małej do bardzo dużej. Tkanka mięśniowa, bo to ona stanowi główny przedmiot naszego zainteresowania, w spoczynku wymaga bardzo niewiele energii (oczywiście w postaci ATP) i to zapotrzebowanie jest pokrywane w ogromnej większości przez przemiany tlenowe. W czasie pracy szybkość przemian tlenowych może, u ludzi odpowiednio zaadoptowanych, czyli wytrenowanych, wielokrotnie wzrosnąć ( u niewytrenowanych szybkość tych przemian może wzrosnąć w znacznie mniejszym zakresie)
Z opisu poszczególnych przemian wynika, że regulacja cyklu Krebsa odbywa się za pomocą dwóch głównych czynników:
Stężenia ATP i ADP, czyli [ATP]/[ADP].
Stężenia NADH i NAD+, czyli [NADH]/[NAD+].
Czynnik pierwszy warunkujący tzw. ładunek energetyczny, jest bardzo silnym regulatorem cyklu Krebsa. Gdy stężenie ATP jest wysokie, a ADP niskie, to cykl Krebsa, mimo dostępności substratów, przebiega powoli. Gdy stężenie ATP się obniża, a ADP podwyższa, np. po rozpoczęciu pracy przez mięsień szybkość cyklu Krebsa wzrasta. Wzrost ten jest jednak możliwy, gdy łańcuch oddechowy z dostateczną szybkością utlenia atomy wodoru produkowane przez cykl w postaci NADH i FADH2. W przypadku braku dostatecznej ilości tlenu w mięśniu stężenie NADH jest wysokie, a NAD+ niskie i cykl Krebsa działa powoli pomimo obniżonego stężenia ATP i zwiększonego ADP oraz dobrej dostępności substratów. Z taką sytuacją można się spotkać wyłącznie w czasie wysiłku statycznego.
Bardzo ważnym czynnikiem wpływającym na szybkość cyklu Krebsa jest właściwa dostępność obu głównych substratów, tzn. szczawiooctanu i acetylo - CoA.
Efekt energetyczny cyklu Krebsa
Cykl Krebsa znany jest przede wszystkim jako przemiana kataboliczna dostarczająca energii. Na 8 reakcji cyklu 4 to reakcji katalizowane przez dehydrogenazy, których koenzymami są: NAD+(3) I FAD (1). W wyniku przemian powstają 3 NADH i 1 FADH2, a atomy wodoru przenoszone są na łańcuch oddechowy. W samym przebiegu cyklu dochodzi do tzw. fosforylacji substratowej, w której w wyniku powstaje 1 cząsteczka GTP. Sumaryczną ilość ATP powstającą podczas jednego obrotu cyklu przedstawiono niżej, uwzględniając różną wydajność łańcucha oddechowego:
wydajność maksymalna wydajność średnia
3 NADH → 3 x 3ATP= 9 ATP -2,5 ATP= -7,5 ATP 1 FADH2 → 1 x 2ATP= 2 ATP -1,5 ATP= -1,5 ATP
1 GTP → 1 x 1ATP= 1 ATP 1 ATP= 1 ATP
w sumie na jeden obrót 12 ATP -10 ATP
Łańcuch oddechowy - lokalizacja, przebieg, energetyka:
Składniki łańcucha oddechowego są uporządkowane w kolejności wzrastających potencjałów redoks. Wodory lub elektrony przepływają stopniowo przez łańcuch oddechowy, od składników bardziej elektroujemnych do bardziej elektrododatnich tlenu. Różnica potencjałów redoks od NAD+/NADH do O2/2H2O wynosi 1,1 V.
Mitochondrialny łańcuch oddechowy zawiera liczne nośniki redoks, poczynając od dehydrogenaz współdziałających z NAD, przez flawoproteiny o cytochromy, do tlenu cząsteczkowego. Nie wszystkie substraty są związane z łańcuchem oddechowym przez dehydrogenazy współdziałające z NAD; niektóre ze względu na ich bardziej dodatnie potencjały redoks wiążą się bezpośrednio z dehydrogenazami będącymi flawoproteinami, które z kolei są związane z cytochromami łańcucha oddechowego.
Poza wspomnianymi przenośnikami w łańcuchu oddechowym znajduje się dodatkowy przenośnik łączący flawoproteiny z cytochromem b, białkiem o najniższym potencjale oksydoredukcyjnym w łańcuchu cytochromowym. Ten dodatkowy przenośnik, który nazwano ubichinonem lub CoQ (koenzym Q) występuje w mitochondriach w formie chinowej (utlenionej) w warunkach tlenowych, a w formie chinolowej (zredukowanej) w warunkach beztlenowych. Ubichinon jest składnikiem lipidów mitochondrialnych; pozostałe lipidy to przede wszystkim fosfolipidy, tworzące część błony mitochondrialnej. Struktura koenzymu Q jest bardzo podobna do witaminy K i E. Podobna jest również do plastochinonu występującego w chloroplastach. Wszystkie te związki charakteryzują się posiadaniem w swojej cząsteczce polizoprenoidowego łańcucha bocznego. W mitochondriach CoQ występuje w znacznym stechiometrycznym nadmiarze względem pozostałych elementów łańcucha oddechowego. Jest to zgodne z funkcja koenzymu Q, który działa jako ruchomy element łańcucha oddechowego zbierający równoważniki redukujące z bardziej nieruchomych kompleksów flawoproteinowych i przenoszący je na cytochromy.
Innym dodatkowym składnikiem, występującym również w preparatach łańcucha oddechowego, jest białko żelazo-siarkowe. Jest ono połączone z flawoproteinami (metaloflawoproteinami) i z cytochromem b. Siarka i żelazo uczestniczą w jednoelektronowym mechanizmie oksydoredukcyjnym pomiędzy flawiną a CoQ; atom żelaza podlega oksydoredukcji, występując naprzemiennie, jako Fe2+ lub Fe3+. Skład łańcucha oddechowego - na jego elektroujemnym końcu dehydrogenazy katalizują przeniesienie elektronów z substratów na NAD łańcucha. Sposoby tego przenoszenia mogą być dosyć różne. Alfa - ketokwasy - pirogronian i Alfa - ketoglutaran - mają własne kompleksy, dehydrogenaz, które zawierają liponian i FAD pośredniczące w przenoszeniu elektronów na NAD łańcucha oddechowego. Inne dehydrogenazy, np. dehydrogenaza L(+) - 3 - hydroksycylo - CoA, prolinowa, gluminianowa, jabłaczanowa i izocytrynianowa przenoszą elektrony bezpośrednio na NAD łańcucha oddechowego.
Zredukowany NAD (tj. NADH) łańcucha oddechowego jest z kolei utleniany przez dehydrogenazę NADH, która jest metaloflawoproteiną. Enzym ten zawiera Fe:S i FMN i jest ściśle związany z łańcuchem oddechowym. Przenosi on równoważniki redukujące na CoQ. Koenzym Q stanowi w łańcuchu oddechowym również punkt zbiorczy dla równoważników redukujących pochodzących z substratów, które przez flawoproteinowe dehydrogenazy kontaktują się bezpośrednio z łańcuchem oddechowym. Takimi substratami są bursztynian, cholina, sarkozyna. W dehydrogenazach tych substratów część flawinową stanowi FAD.
Elektrony z CoQ przepływają następnie przez łańcuch cytochromowy na tlen cząsteczkowy. Cytochromy są ułożone zgodnie ze wzrastającym potencjałem oksydoredukcyjnym. Znajdujący się na końcu łańcucha cytochrom aa3 (oksydaza cytochromowa) odpowiada za ostateczną reakcję równoważników redukujących z tlenem cząsteczkowym. Oksydaza cytochromowa ma bardzo duże powinowactwo do tlenu, co pozwala na funkcjonowanie łańcucha oddechowego z maksymalną szybkością, aż do momentu całkowitego wyczerpania tlenu w tkance. Ponieważ jest to reakcja nieodwracalna, nadaje ona kierunek dla przemieszczania się równoważników redukujących w łańcuchu oddechowym i do sprzężonego z nim wytwarzania ATP.
Istotnym odkryciem było stwierdzenie niemal stałych stosunków molowych między składnikami łańcucha oddechowego. Składniki łańcucha oddechowego są zgrupowane funkcjonalnie i strukturalnie, w wewnętrznej błonie mitochondrialnej, w cztery lipidowo - białkowe kompleksy łańcucha oddechowego, oddechowego, których każdy zajmuje całą grubość błony. Cytochrom c jest jednym rozpuszczalnym sytochromem i tak jak CoQ wydaje się bardzo ruchomym elementem łańcucha oddechowego, łączącym nieruchome kompleksy.
Uwzględniając reakcje odwodorowania w szlaku katabolicznym glukozy zarówno glikolizie, jak i w cyklu kwasu cytrynowego oraz fosforyzacje substratowi, można obliczyć, że 68% energii swobodnej, pochodzącej ze spalania glukozy, zostaje związane w postaci bogatoenergetycznych wiązań fosforanowych. Jest oczywiste, że to łańcuch oddechowy odpowiada za znaczną część puli tworzonego ATP.
Mitchell w swojej teorii chemiosmotycznej postulował, że energia z procesów utleniania przenośników łańcuchu oddechowym prowadzi do gromadzenia jonów wodorowych, które są wyrzucane na zewnątrz sprzęgającej błony mitochondrialnej, tzn. błony wewnętrznej. Różnica potencjałów elektrochemicznych jest zużywana następnie do napędzania mechanizmu odpowiedzialnego za tworzenie ATP.
STRESZCZENIE
Praktycznie cała energia uwalniana podczas utleniania węglowodanów, tłuszczów białek jest gromadzona w mitochondriach w postaci równoważników redukujących. Są one kierowane do łańcucha oddechowego, którym wędrują zgodnie z malejącym gradientem redoks przenośników do końcowego akceptora, tj. tlenu. W reakcji z tlenem powstaje woda.; Przenośniki redoks są zgrupowane w wewnętrznej błonie mitochondrialnej w kompleksy łańcucha oddechowego. Kompleksy te, zużywając energię uwalnianą podczas transportu elektronów, przepompowują protony na zewnątrz błony. W wyniku działania pomp protonowych powstaje przezbłonowy potencjał elektrochemiczny.; Błonowy kompleks syntezy ATP zużywa energię gradientu protonowego do syntezy ATP z ADP i Pi. w ten sposób utlenianie jest ściśle sprzężone z fosforyzacją, tak aby sprostać potrzebom energetycznym komórki.; Wewnętrzna błona mitochondrialna jest nieprzepuszczalna dla protonów innych jonów. W błonie znajdują się swoiste przenośniki - wymieniacze, które umożliwiają przejście jonom, takim jak OH - , P - i, ATP4- i metabolitom bez rozładowania przezbłonowego gradientu elektrochemicznego.
Cukry - podział, przykłady. Glukoza - wzór:
Duża grupa związków zaliczanych do węglowodanów, zwana jest również sacharydami lub cukrami. Termin „węglowodany” obejmuje monosacharydy (cukry proste), oligosacharydy, polisacharydy oraz związki pokrewne (aminocukry, kwasy uronowe, itp.). Natomiast do innych klas związków chemicznych zalicza się glikozydy aglikonowe (sacharyd połączony wiązaniem glikozydowym z aglikonem - związkiem niecukrowym), np. nukleozydy, glikozydy roślinne, itp. W tabeli wymieniono sacharydy najczęściej spotykane w przyrodzie.
W skład węglowodanów wchodzą: węgiel, wodór i tlen. Z chemicznego punktu widzenia są to alkohole wielowodorotlenowe, zawierające w cząsteczce grupę aldehydową (aldozy) lub grupę ketonową (ketozy).
Węglowodany spełniają w organizmach następujące funkcje:
zapasowe - podczas wieloetapowego spalania 1 g glukozy w komórkach wyzwala się 17,2 kJ energii. U roślin magazynem energii jest głównie skrobia i inulina, a u zwierząt oraz ludzi glikogen
transportowa - u roślin transportową formą cukru jest sacharoza, a u zwierząt oraz ludzi glukoza
budulcowa (celuloza, hemiceluloza)
wchodzą w skład DNA i RNA, stanowią modyfikację niektórych białek.
hamują krzepnięcie krwi - heparyna
są materiałem energetycznym (fruktoza) i odżywczym (maltoza, laktoza, rafinoza)
Monosacharydy:
Triozy - dihydroksyaceton, aldehyd L-glicerynowy, aldehyd D-glicerynowy.
Tetrozy - D-erytroza, D-treoza, L-erytroza.
Pentozy - D-ryboza, D-dezoksyryboza, D-rybuloza, L-arabinoza, D-ksyloza, D-ksyluloza, L-ramnoza.
Heksozy - D-mannoza, D-glukoza, D-fruktoza, D-galaktoza, L-sorboza, kwas galakturonowy.
Disacharydy - sacharoza, maltoza, celobioza, laktoza, rafinoza
Polisacharydy - skrobia, amyloza, amylopektyna, glikogen, dekstran, inulina, pulullan, celuloza, hemicelulozy, ksylan, pektyny, aminocukry.
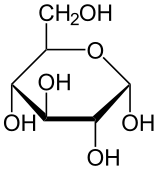
Glukoza (inaczej: glukopiranoza, glikoza, dekstroza, cukier gronowy, cukier skrobiowy, C6H12O6) - węglowodan - aldoheksoza, należący do cukrów prostych. Glukoza jest podstawowym związkiem energetycznym dla większości organizmów, jest rozkładana w procesie glikolizy na kwas pirogronowy. Jest ona składowana w formie polimerów - skrobi i glikogenu. Jest ona również wykorzystywana jako substrat wielu procesów zachodzących w komórce - m.in. do produkcji celulozy. Glukoza
Rola hormonów w regulacji stężenia we krwi i metabolizmu glukozy:
W organizmie człowieka istnieje wiele hormonów regulujących stężenia różnych pierwiastków we krwi. W wyspach Langerhansa.w trzustce występują komórki alfa i beta. Komórki alfa syntetyzują hormon - glukagon podwyższający poziom cukru we krwi (poprzez rozkład glikogenu w wątrobie), natomiast insulina produkowana przez komórki beta obniża jego poziom. Oba te hormony współdziałają ze sobą zapewniając prawidłowe stężenie cukru we krwi. Wahania tego stężenia są bodźcem do syntezy glukagonu i insuliny. Ten system regulacji jest bardzo sprawny, z tego względu , że zmiany w poziomie cukru we krwi występują dość często, np. po obfitym posiłku czy w czasie intensywnego wysiłku fizycznego. Kortyzol, obok innych hormonów glukostatycznych (insulina, glukagon, adrenalina, HGH), bierze udział w utrzymaniu stężenia glukozy we krwi na drodze glukoneogenezy, tj. przemiany aminokwasów w glukozę, a jednocześnie nasila rozpad białek kurczliwych w mięśniach szkieletowych (katabolizm). Ponadto hormon ten, wspólnie z adrenaliną i HGH, zwiększa uwalnianie do krwi wolnych kwasów tłuszczowych powstałych z rozpadu trójglicerydów w tkance tłuszczowe.
Oznaczenie wapnia we krwi służy do wykrywania, rozpoznawania i monitorowania chorób kości, serca, układu nerwowego, nerek oraz zębów. Stężenie wapnia we krwi podlega regulacji na zasadzie sprzężenia zwrotnego i jest związany z poziomem parahormonu (PTH), witaminy D, fosforu i magnezu.
Głównym przedstawicielem mineralokortykosteroidów jest aldosteron, którego nadmiar prowadzi do nadmiernego zatrzymywania w organizmie wody i jonów sodu, czego następstwem jest nadciśnienie i obrzęki. Natomiast niedobór aldosteronu zwiększa stężenie we krwi jonów potasu oraz powoduje odwodnienie organizmu.
Polisacharydy - glikogen, skrobia - budowa, występowanie
Polisacharydy zbudowane są z setek a nawet tysięcy połączonych ze sobą cząsteczek monosacharydów, tworząc jedną olbrzymią cząsteczkę. Ich skład z reguły przedstawia się wzorem sumarycznym: (C6H10O5)n. Są szeroko rozpowszechnione w przyrodzie. Niektóre, jak skrobia i celuloza, spotykane są powszechnie u roślin. Do związków pokrewnych polisacharydom zalicza się także hemicelulozy, aminocukry i pektyny.
Glikogen (C6H10O5) - biopolimer - polisacharyd (wielocukier) zbudowany z glukozy i gromadzony w wątrobie i (w mniejszym stopniu) w tkance mięśniowej.
Jest głównym wielocukrem stanowiącym materiał zapasowy w komórkach zwierzęcych. Ma strukturę podobną do amylopektyny, tylko, że jego cząsteczki są bardziej rozgałęzione i jego łańcuchy są krótsze. Rozgałęzienie następuje co 8 - 12 reszt glukozy. Glikogen w miarę potrzeby może być szybko rozkładany do glukozy. Do najbogatszych w ten materiał zapasowy tkanek należą granulocyty, mięśnie szkieletowe wątroby, mięśnie gładkie, mięsień sercowy i mózg.
Rozkład glikogenu przebiega dwoma torami: fosforolitycznym i hydrolitycznym. Rozkład ten jest indukowany działaniem glukagonu (hormon produkowany przez komórki α trzustki), a jego skutkiem jest podniesienie poziomu cukru we krwi. Rozkład glikogenu w wątrobie spowodowany jest zapotrzebowaniem organizmu w cukier. Odwrotny proces zachodzi w momencie oddziaływania insuliny (antagonistyczny hormon glukagonu), kiedy to zachodzi wiązanie glukozy z krwi w glikogen w wątrobie.
Skrobia (C6H10O5) - węglowodan, polisacharyd roślinny, składający się wyłącznie z merów glukozy, pełniący w roślinach rolę magazynu energii. Czysta skrobia jest białą, bezpostaciową (nie jest krystaliczna), amorficzną substancją bez smaku i zapachu, nierozpuszczalną w zimnej wodzie. Skrobia hydrolizuje wyłącznie na alfa-D-glukozę, lecz nie jest jednorodnym chemicznie związkiem - składa się w rzeczywistości z dwóch różnych polisacharydów:
nierozgałęzionej amylozy łatwiej rozpuszczalnej w wodzie (ok. 20% naturalnej skrobi)Jest ona wielocukrem - jej cząsteczki składają się z wielu reszt glukozowych połączonych ze sobą atomami tlenu.
rozgałęzionej amylopektyny, z reguły w stosunku ilościowym (ok. 80% naturalnej skrobi); rozgałęzienia powstają dzięki wiązaniom α-1,6-glikozydowym.
Skrobia jest najważniejszym polisacharydem zapasowym u roślin, które magazynują go w owocach, nasionach, korzeniach w formie ziaren w liściach, bulwach, rdzeniu łodygi i kłączach. Szczególnie bogate w skrobię są ziarna zbóż i bulwy ziemniaka.
Trawienie cukrowców:
W trawieniu węglowodanów biorą udział enzymy amylolityczne. Odpowiadają one za hydrolizę wiązań glikozydowych w cukrach, w środowisku obojętnym (jama gębowa) oraz lekko zasadowym (dwunastnica, jelito cienkie).
W jamie gębowej, pod wpływem amylazy ślinowej skrobia i glikogen rozkładane są na dekstryny i maltozę. W dwunastnicy pod wpływem amylazy trzustkowej, która wchodzi w skład soku trzustkowego. Amylaza trzustkowa kontynuują rozkład skrobi, glikogenu, jak również dekstryn. Pod wpływem amylazy jelitowej (składnik soku jelitowego) dochodzi do ostatecznego rozkładu polisacharydów. W trawieniu dwucukrów biorą udział tzw. disacharydazy, jak np. maltaza, która obecna jest już w jamie gębowej. Maltaza i sacharaza są składnikiem soku trzustkowego. W soku jelitowym obecna jest również laktaza. Pod wpływem disacharydaz powstają cukry proste (glukoza, galaktoza, fruktoza) i etap trawienia węglowodanów kończy się. Pod wpływem maltazy maltoza rozkłada się na glukozę (dwie cząsteczki), sacharaza uczestniczy w rozkładzie sacharozy na glukozę oraz fruktozę, natomiast laktaza - w rozkładzie laktozy, w wyniku którego powstaje glukoza i galaktoza. Cukry proste ulegają wchłonięciu w dwunastnicy oraz jelicie czczym za pośrednictwem kosmków jelitowych i trafiają do światła naczyń krwionośnych.
Przebieg glikolizy - regulacja. Energetyka glikolizy. Powiązanie glikolizy z cyklem Krebsa:
Glikoliza jest szlakiem reakcji biochemicznych prowadzących do rozpadu cząsteczki glukozy na dwie cząsteczki kwasu pirogronowego. W wyniku glikolizy komórka uzyskuje dwie cząsteczki ATP i dwie cząsteczki NADH2. Glikoliza przebiega w cytoplazmie komórki i należy do procesów katabolicznych.
Podczas glikolizy komórka zużywa dwie cząsteczki ATP, ale wytwarza cztery nowe cząsteczki ATP w procesie fosforylacji substratowej. W obecności tlenu wodór z dwóch cząsteczek NADH2 jest przenoszony do mitochondrium na enzymy łańcucha oddechowego, a to wiąże się z wytworzeniem sześciu dodatkowych cząsteczek ATP w procesie fosforylacji oksydacyjnej. Obie cząsteczki kwasu pirogronowego są transportowane do mitochondrium i po przekształceniu do acetylo - CoA w procesie oksydacyjnej dekarboksylacji są dalej utleniane w cyklu kwasu cytrynowego.
W warunkach beztlenowych wodór z NADH2 jest przenoszony na kwas pirogronowy. Wtedy z kwasu pirogronowego powstaje kwas mlekowy, natomiast nie są wytwarzane następne wiązania wysokoenergetyczne w ATP. Cząsteczki NAD, które powstają w wyniku odłączenia wodoru od NADH2, są wykorzystywane podczas następnej rundy glikolizy. Zysk energetyczny z glikolizy przeprowadzanej bez dostępu tlenu wynosi tylko 2 cząsteczki ATP.
Kwas mlekowy powstający podczas glikolizy beztlenowej nie jest energetycznie bezużyteczny dla organizmu. Cząsteczki tego kwasu, które powstają na przykład w intensywnie pracujących mięśniach szkieletowych, są transportowane do wątroby. Tam są z powrotem metabolizowane do kwasu pirogronowego, który może być utleniany w cyklu Krebsa albo zużywany do wytwarzania cząsteczek glukozy.
Kwas pirogronowy - produkt glikolizy. Zawiera trzy atomy węgla w cząsteczce. Podczas glikolizy beztlenowej jest przekształcany do kwasu mlekowego. Podczas spalania glukozy w warunkach tlenowych jest przekształcany do acetylo - CoA i w tej postaci wchodzi do cyklu kwasu cytrynowego.
Glikoliza jest szlakiem metabolicznym zachodzącym w cytozolu wszystkich komórek ssaków. W tym procesie glukoza (również glukoza pochodząca z degradacji glikogenu) zostaje przekształcona w pirogronian lub mleczan. Glikoliza może przebiegać w warunkach beztlenowych dzięki sprzężeniu dwóch reakcji, z których jedna redukując pirogronian do mleczanu odtwarza utlenioną formę NAD koniecznego w reakcji katalizowanej przez dehydrogenazę gliceraldehydo-3-fosforanową.
Mleczan jest końcowym produktem glikolizy zachodzącej w warunkach beztlenowych (np. w pracującym mięśniu) lub zachodzącej w komórkach niezdolnych do utleniania pirogronianu (np. w erytrocytach). Glikoliza jest regulowana przez trzy enzymy katalizujące reakcje nieodwracalne: heksokinazę (lub glukokinazę), fosfofruktokinazę i kinezę pirogronianową. Pirogronian jest utleniany do acetylo - CoA przez kompleks wieloenzymowy zwanym kompleksem dehydrogenazy pirogronianowej. Reakcja wymaga udziału difosfotiaminy, która jest pochodną witaminy B1. Brak możliwości metabolizowania (utleniania) pirogronianu prowadzi często do kwasicy mleczanowej.
Powiązanie glikolizy z cyklem Krebsa
Aby pirogronian mógł wejść do cyklu kwasu cytrynowego, musi najpierw zostać przetransportowany do wnętrza mitochondrium przez przenośnik pirogronianowy, który umożliwia przejście pirogronianu przez wewnętrzną błonę mitochondrialną. W tym procesie transportowi cząsteczki pirogronianu towarzyszy transport 1 protonu (kotransport). Tego typu mechanizm transportu określa się mianem symportu. Wewnątrz mitochondrium pirogronian ulega dekarboksylacji oksydacyjnej do acetylo-CoA. Reakcja ta jest katalizowana przez kilka różnych enzymów, działających kolejno w kompleksie wieloenzymowym „przylegającym” do wewnętrznej błony mitochondrialnej. Enzymy te określa się mianem kompleksu dehydrogenazy pirogronianowej, który jest analogiczny do kompleksu dehydrogenazy Alfa-ketoglutaranowej w cyklu kwasu cytrynowego. Pirogronian, przy udziale dehydrogenazy pirogronianowej znajdującej się w kompleksie wieloenzymowym, ulega dekarboksylacji do dehydroksyetylowej pochodnej pierścienia tiazolowego difosfotiaminy związanej z enzymem, która reaguje z kolei z utlenionym lipoamidem, grupą prostetyczną acetylotransferazy dihydrolipoamidowej, tworząc acetylolipoamid. Acetylolipoamid reaguje z koenzymem A, tworząc acetylo-CoA i zredukowany lipoamid. Gdy ten ostatni zostanie ponownie utleniony przez flawoproteinę (zawierającą FAD), w obecności dehydrogenazy dihydrolipoamidowej, cykl reakcji jest zakończony. Ostatecznie zredukowana flawoproteina jest utleniona przez NAD, który z kolei przenosi równoważniki redukujące do łańcucha oddechowego.
Przemiany pirogronianu w warunkach tlenowych i beztlenowych:
Kwas pirogronowy powstaje jako produkt metabolizmu węglowodanów, w trakcie procesu nazywanego glikolizą. W środowisku komórki występuje w formie zdysocjowanej jako jon pirogronianowy (pirogronian). Cząsteczka glukozy pęka przechodząc w dwa jony pirogronianowe. Następnie pirogronian jest wykorzystywany przez organizm jako źródło energii na dwa sposoby:
przy wystarczającej ilości tlenu zachodzi cykl Krebsa, w wyniku którego zostaje on rozłożony do wody i dwutlenku węgla
przy niewystarczającej ilości tlenu jest rozkładany do kwasu mlekowego w przypadku zwierząt i etanolu w przypadku roślin i bakterii.
Cykl Corich (cykl mięśniowo - wątrobowy mleczanu):
Większość tych węglowodanów diety, które są trawione, tworzy ostatecznie glukozę. Węglowodany zawarte w pokarmach, które są aktywnie trawione, zawierają reszty glukozy, galaktozy i fruktozy, które są uwalniane w jelicie.
Glukoza powstaje ze związków glikogennych drogą glukoneogenezy. Istnieją dwie kategorie tych związków:
Takie, które podlegają przetworzeniu w glukozę bez znaczącej recyklizacji, jak niektóre aminokwasy propionian
Takie, które są produktami częściowego przetworzenia glukozy w niektórych tkankach i są transportowane do wątroby i nerek, aby ulec resyntezie do glukozy. I tak mleczan, wytwarzany przez utlenianie glukozy w mięśniach szkieletowych w erytrocytach, jest transportowany do wątroby i nerek, gdzie jest odtwarzana z niego glukoza, która staje się drogą krążenia znów dostępną dla utleniania w tkankach. Ten proces jest znany jako Cykl Corich albo cykl kwasu mlekowego.
Glikogen - budowa, występowanie, znaczenie w wysiłku fizycznym:
Glikogen jest wielocukrem - polimerem glukozy. Składa się z setek cząsteczek glukozy połączonych ze sobą wiązaniami glikozydowymi α 1 - 4. Co około 10 cząsteczek glukozy łańcuch rozgałęzia się za pomocą wiązania glikozydowego α 1-6.
Glikogen jest syntetyzowany przez niektóre komórki z glukozy krążącej we krwi. Głównym magazynem glikogenu w organizmie człowieka są mięśnie szkieletowe i wątroba. Glikogen wątrobowy jest w naszym organizmie używany do utrzymywania niezbędnego stężenia glukozy we krwi. Glikogen mięśniowy służy do energetycznego zasilania pracy tych włókien mięśniowych, w których jest zmagazynowany.
Glikogen mięśniowy jest tym substratem, który umożliwia najszybszą pracę tlenową. Stanowi on także praktycznie jedyny substrat dla beztlenowej (kończącej się mleczanem) glikolizy, będącej głównym sposobem energetycznego zasilania dla kilkudziesięciosekundowych wysiłków o najwyższej intensywności. To zachowane zapasy glikogenu pozwalają zawodnikowi na finisz - przyspieszenie przed metą i zwycięstwo. Glikogen jest więc ważny dla pracy zarówno beztlenowej, jak i tlenowej.
Rozkład glikogenu mięśniowego i wątrobowego:
Rozkład glikogenu mięśniowego dokonuje się na drodze fosforolizy i jest katalizowany przez enzym fosforylazę glikogenową A. Enzym ten jest aktywną formą fosforylazy glikogenowej B, powstałą przez dołączenie do niej grupy fosforanowej. Rozkład glikogenu mięśniowego jest stymulowany przez:
Wzrost stężenia jonów Ca++ w cytoplazmie włókien mięśniowych (skurcz mięśnia),
Wzrost stężenia adrenaliny we krwi,
Wzrost stężenia AMP w cytoplazmie włókien mięśniowych (powstaje z reakcji miokinazowej)
W przypadku aktywacji fosforolizy glikogenu przez AMP jest aktywna fosforylaza B i ta właśnie forma enzymu dokonuje rozkładu glikogenu.
Rozkład glikogenu mięśniowego jest hamowany przez przyspieszenie metabolizmu kwasów tłuszczowych, a także przez wzrost stężenia insuliny. Glikogen mięśniowy nie jest źródłem wolnej glukozy dla organizmu.
Glukoneogenezy:
Glukoneogeneza to enzymatyczny proces tworzenia przez organizm glukozy z metabolitów niebędących węglowodanami, np. aminokwasów, glicerolu czy mleczanu. Głównym substratem jest pirogronian. Glukoneogeneza ma miejsce głównie w komórkach wątroby, częściowo również w nerkach. Jej przeciętna wydajność to ok. 100 g na dzień. Szybkość zachodzenia procesu jest zwiększana podczas wysiłku fizycznego i głodu. W wyniku glukoneogenezy wydzielają się duże ilości energii.
Glukoneogeneza nie może być traktowana jako proces odwrotny do glikolizy, gdyż trzy występujące w niej reakcje nieodwracalne są zastąpione przez inne. Dzięki temu synteza i rozkład glukozy muszą podlegać oddzielnym systemom regulacji i nie mogą zachodzić jednocześnie w jednej komórce. Szybkość procesu zależy w głównej mierze od 1,6 - bisfosfatazy fruktozy. Większość czynników wpływających na aktywność szlaku glukoneogenezy to substancje powodujące zmniejszenie czynności wykorzystywanych w nim enzymów, jednak zarówno acetylo - CoA jak i cytrynian działają na nie aktywująco (pierwszy na karboksylazę pirogronianu, drugi na bisfosfatazę fruktozy).
Glukoneogeneza rozpoczyna się od wytworzenia α - ketoglutaranu przez karboksylację pirogronianu kosztem jednej cząsteczki ATP. Reakcja ta jest katalizowana przez odpowiednią karboksylazę. α - ketoglutaran jest następnie dekarboksylowany i równocześnie fosforylowany do fosfoenolopirogronianu przez odpowiednią karboksykinazę. W czasie tej reakcji jedna cząsteczka GTP jest hydrolizowana do GDP. Obie reakcje zachodzą w mitochondriach.
Ostatnim krokiem glukoneogenezy jest z reguły wytworzenie 6 - fosforyloglukozy z 6 - fosforylofruktozy przez odpowiednią izomerazę. Wolna glukoza nie jest tworzona od razu, gdyż wydyfundowałaby z komórki. Fosforyloglukoza jest hydrolizowana do glukozy przez enzym znajdujący się w membranie retikulum endoplazmatycznego. Stamtąd glukoza jest wysyłana do cytozolu.
Znaczenie cyklu pentozofosforanowego:
Cykl pentozofosforanowy- NADPH jest wykorzystywany jako dawca elektronów i protonów niezbędnych w biosyntezie kwasów tłuszczowych. W organizmie człowieka szlak pentozofosforanowy szczególnie intensywnie zachodzi w tkance tłuszczowej. Substratem w tym cyklu jest glukoza. Glukoza po ufosforylowaniu do glukozo - 6 - fosforanu ulega dehydrogenacji do kwasu 6 - fosfoglukonowego. Enzymem katalizującym jest tu dehydrogenaza glukozo - 6 fosforanu Jednocześnie ma miejsce redukcja NADP do NADPH.
Produkt, czyli kwas glukonowy ulega następnie dekarboksylacji do rybulozo - fosforanu, który jest już pentozą. Enzymem jest tutaj dehydrogenaza kwasu fosfoglukonowego wymagającego obecności NADP. Powstała pentoza jest ketozą, można ją jednak łatwo izomeryzować do rybozo - 5 - fosforanu.
Jak już wspomniano szlak pentozofosforanowy jest szczególnie intensywny w tkance tłuszczowej. Tam więc zużycie NADPH będzie duże. W tych komórkach rybozo - 5 - fosforan przekształcany jest we fruktozo - 6 - fosforan i aldehyd 3 fosfoglicerynowy 3cz. Rybozo - 5 - fosforanu + ATP <--->2cz. Fruktozo - 6 - fosforanu + aldehyd 3 - fosfoglicerynowy
Jeden z enzymów katalizujących te reakcje zawiera pirofosforan tiaminy (witaminę B .. )Z fruktozofosforanu i aldehydu fosfoglicerynowego można łatwo uzyskać glukozo - 6 - fosforan. Ten zaś można ponownie wprowadzić w szlak pentozofosforanowy. W mięśniach szkieletowych tego typu przemiany są mało intensywne, gdyż lepiej szybko utlenić glukozę do CO2 i H2O.
Tłuszcze właściwe (glicerydy) - budowa, występowanie, znaczenie.
Tłuszcze właściwe - estry kwasów tłuszczowych z glicerolem. Tłuszcze właściwe, zwane w skrócie tłuszczami, stanowią substancje zapasowe żywych organizmów. Są szeroko rozpowszechnione w świecie roślinnym, jak i zwierzęcym. Pod względem budowy chemicznej stanowią mieszaninę estrów glicerolu z kwasami tłuszczowymi
gdzie: R - CO - reszta acylowa wyższego kwasu tłuszczowego
ogólny wzór tłuszczów właściwych
W przyrodzie tłuszcze występują przeważnie jako glicerydy mieszane, o różnym składzie kwasowym, głównie zawierające trzy różne kwasy tłuszczowe.
Przykłady wyższych kwasów tłuszczowych:
C15H31COOH - kwas palmitynowy,
C17H35COOH - kwas stearynowy,
C17H33COOH - kwas olejowy (kwas nienasycony),
Kwasy wielonienasycone występują szczególnie obficie w olejach roślinnych. Niektóre ssaki nie posiadają zdolności syntetyzowania tych związków i w takim przypadku stanowią one nieodzowny składnik ich pożywienia (tzw. związki egzogenne) i stąd noszą nazwę witaminy F.
Lipoliza - przebieg i regulacja. Produkty liolizy i losy produktów lipolizy:
Lipoliza jest to proces rozkładu hydrolitycznego triacyloglicerolu (trójglicerydu) w tkance tłuszczowej prowadzący do powstania kwasów tłuszczowych i glicerolu, które są uwalniane do krwiobiegu jako wolne kwasy tłuszczowe. Są one wychwytywane przez większość tkanek (ale nie przez mózg i erytrocyty) i estryfikowane do acylogliceroli lub utleniane, jako główne źródło energetyczne do CO2 i H2O. W wątrobie zachodzą 2 szlaki o dodatkowym znaczeniu:
nadwyżka triacyloglicerolu, będąca zarówno wynikiem litogenezy, jak i podaży wolnych kwasów tłuszczowych, jest wydzielana do krwiobiegu w postaci lipoprotein o bardzo małej gęstości; ten triacyloglicerol ulega przemianom podobnym do tych z chylomikronów.
częściowe utlenianie wolnych kwasów tłuszczowych pozwala wytwarzać ciała ketonowe (patogeneza); ciała ketonowe są transportowane do tkanek pozawątrobowych, gdzie są wykorzystywane jako inne ważne źródło energii.
β - oksydacja - przebieg, znaczenie
β - oksydacja jest cyklem metabolicznym składającym się z czterech reakcji. Substratem tej przemiany są cząsteczki acylo - CoA i H2O, produktami - acetylo - CoA i atomy wodoru w postaci zredukowanych nukleotydów FADH2 i NADH. Acetylo - CoA jest wykorzystywany jako substrat przez cykl Krebsa, a FADH2 i NADH są utleniane przez łańcuch oddechowy, co powoduje powstawanie maksymalnie 5, a przeciętnie około 4 cząsteczek ATP na jeden obrót cyklu
Pierwszą reakcja β - oksydacji jest reakcja utlenienia, czyli dehydrogenacji:
acylo - CoA + FAD → anoilo - CoA + FADH2 (ok. 1,5 ATP)
Enzym - dehydrogenaza acylo - CoA
Drugą reakcją jest reakcja uwodnienia:
enoilo - CoA + H2O ↔3 - hydroksyacylo - CoA
Enzym - hydrataza enoilo - CoA
Trzecią reakcją jest reakcja utlenienie, czyli dehydrogenacji:
3 - hydroksyacylo - CoA + NAD+ → 3 ketoacylo - Coa + NADH (ok. 2,5 ATP)
Enzym - dehydrogenaza 3 - hydroksyacylo - CoA
Czwartą reakcją jest reakcja liolizy, czyli rozkładu 3 - ketoacylo - CoA na dwuwęglowy acetylo - CoA i skrócony o 2 atomy węgla acylo - CoA przy udziale wolnego CoA:
3 - ketoacylo - ScoA + HSCoA → acylo - CoA + acetylo - CoA
Enzym - 3 - ketoacylotiolaza (β - ketoacylotiolaza, tiolaza)
Acylo - CoA powstały po liolizie ulega ponownie reakcji nr 1 i cykl biegnie od początku, Cykl przebiega dopóty, dopóki cały kwas tłuszczowy nie zostanie podzielony na dwuwęglowy reszty acetylo - CoA.
W przypadku, gdy kwas tłuszczowy ma nieparzystą liczbę atomów węgla, na końcu cyklu pozostaje trójwęglowy propionylo - CoA. Propionylo - CoA może zostać użyty do syntezy glukozy lub zużyty w cyklu Krebsa. Kwasy tłuszczowe o nieparzystej liczbie atomów węgla są jednak rzadkością w diecie człowieka.
Hormony - podział ze względu na budowę chemiczną (pochodne aminokwasów, o budowie peptydowej, białkowe i sterydowej):
Podział hormonów ze względu na ich budowę chemiczną-
Peptydowe (białkowe) - łańcuchy polipeptydów, które zbudowane są z reszt aminokwasowych. Produkowane w podwzgórzu i wydzielane przez tylny płat przysadki mózgowej, np. insulina , oksytocyna i wazopresyna są krótkimi łańcuchami polipeptydowymi, zbudowanymi z 9 reszt aminokwasowych różniące się jedynie dwoma aminokwasami; glukagon, sekratyna, ACTH oraz kalcytonina są peptydami długo łańcuchowymi zawierającymi do 30 reszt aminokwasowych w łańcuchu
Pochodne aminokwasów - określane aminami. Mają najprostszą budowę chemiczną. Wytwarzana są w rdzeniu nadnerczy , np. adrenalina i noradrenalina
Sterydowe - syntezyzowane są z cholesterolu. Są niewielkimi, rozpuszczalnymi w tłuszczu cząsteczkami, które swobodnie przekraczają barierę błony komórkowej. Wydzielane przez gruczoły dokrewne i transportowane do komórki docelowej, np. cholesterol, testosteron, estradiol, progesteron.
Mechanizm działania hormonów na poziomie komórki (lokalizacja receptorów w błonie komórkowej i wewnątrzkomórkowej):
Mechanizm działania hormonów steroidowych:
Są to hormony działające na receptory cytolpazmatyczne. Do cytoplazmy przez błonę wnikają hormony sterydowe, gdzie łączą się ze swoimi receptorami . Reakcja ta poprzedzona jest wiązaniem się sterydów z białkiem . które odgrywają znaczną rolę w transporcie tych hormonów. Hormony sterydowe w kompleksie z receptorami zmieniają właściwości receptorów czyniąc je aktywnymi. W tej formie aktywny kompleks H - R wnika na teren jądra komórkowego gdzie oddziałując na chromatynę jądrową powoduje określona odpowiedź komórki.
Mechanizm działania hormonów niesteroidowych np. białkowych lub amin biogennych:
Są to hormony działające na receptory błonowe komórek. Po dotarciu do receptora łączą się z nimi i tworzą kompleks hormon receptor (H - R). Kompleks H -R pobudza cyklazę adenylową, która przekształca ATP do cyklicznegoAMP (cAMP). Cyklaza adenylową, której aktywność również ulega zwiększeniu jest również związana z błona plazmatyczną. Powstały cAMP aktywuje kinazy białkowe czyli enzymy katalizujące fosforylacje różnych białek.
Mechanizm działania insuliny:
Insulina produkowana jest w komórkach B wysepek Langerhansa (w trzustce) . Jeżeli stężenie cukru we krwi jest w normie, wydzielanie insuliny jest minimalne, ale gdy ilość cukru zwiększy się dwa trzy razy, następuje wyrzut tego hormonu do krwi. Pierwszym skutkiem jest przyspieszenie transportu glukozy do mięśni szkieletowych tkanek tłuszczu, co powoduje zmniejszenie poziomu glukozy we krwi. W wątrobie, mózgu i mięśniach następuje zahamowanie mobilizacji rezerw tłuszczowych i wzmożenie procesu glukoneogenezy w wątrobie. Ostateczny efektem działania insuliny jest obniżenie poziomu glukozy we krwi.
Podział hormonów ze względu na mechanizm ich działania-
parakrynne - są to hormony, które działają na sąsiednie komórki, np. gastryna - wytwarzana przez komórki błony śluzowej żołądka, która pobudza wydzielanie soku żołądkowego, aktywność wydzielniczą pęcherzyka żółciowego, trzustki i śluzówki jelita cienkiego
anakrynne (auto) - są to hormony, które działają w tych komórkach, w których są produkowane, np. testosteron , który działa na komórki śródmiąższowe jądra
endokrynne - są to hormony transportowane na odległość.
Działanie hormonów: bodziec wykryty przez system regulacyjny, następuje zwiększenie sekrecji hormonów, który dostaje się do krwi i działa na komórki wychwytujące bodziec - powoduje likwidację bodźców
Hormony podwzgórza i przysadki mózgowej (tylnego i przedniego płata):
Podwzgórze jest częścią międzymózgowia. Znajdują się tak dwa zespoły jąder komórek nerwowych wydzielających hormony. Przede wszystkim jest to pole hipofizjotropowe składające się z zespołu jąder drobnokomórkowych, które wydzielają hormony pobudzające (liberyny) i hamujące (statyny). Regulują one wydzielanie hormonów przedniego płata przysadki mózgowej. W podwzgórzu występują też jądra wielkokomorowe (nadwzrokowe i przykomorowe), które wydzielają neurosekret składający się z białka nośnikowego (neurofizyny) i neurohormonów.
Hormony podwzgórza biorące udział w regulacji wydzielania przedniego płata przysadki:
kortykoliberyna
tyreoliberyna
gonadoliberyna
somatoliberyna
somatostatyna
prolaktoliberyna
prolaktostatyna - dopamina
melanoliberyna
melanostatyna
wazopresyna
oksytocyna
Przysadka mózgowa jest gruczołem dokrewnym o masie 0,7 g, którego funkcją jest wytwarzanie i wydzielanie hormonów. Jest ona zlokalizowana wewnątrz czaszki w okolicy kostnego zagłębienia nazywanego siodłem tureckim. Przysadka jest ściśle funkcjonalnie związana z częścią mózgu - podwzgórzem.
Część przednia(gruczołowa) wydziela:
hormon wzrostu (somatotropinę)(STH) odpowiedzialną za rozrost organizmu, transport aminokwasów i syntezę białek, wzrost poziomu glukozy we krwi, rozkład tłuszczów zapasowych oraz zatrzymanie jonów wapniowych i fosforanowych potrzebnych do rozrostu kości.
prolaktynę (PRL) u kobiet zapoczątkowuje i podtrzymuje wydzielanie mleka(laktacja), a u kobiet karmiących hamuje wydzielanie estrogenu blokując menstruację i owulację
hormon adrenokortykotropowy ACTH wzmaga wydzielanie hormonów przez korę nadnerczy
hormon tyreotropowy TSH
hormon folikulotropowy FSH - u kobiet pobudza wzrost i dojrzewanie pęcherzyka jajnikowego oraz wydzielanie estrogenu, u mężczyzn pobudza spermatogenezę
hormon luteinizujący LH - u kobiet podtrzymuje jajeczkowanie i produkcję progesteronu, a u mężczyzn pobudza produkcję testosteronu
endorfiny PEA
Część środkowa wydziela:
hormon melanoforowy MSH - pobudza komórki barwnikowe skóry do syntezy melaniny
Część tylna(nerwowa) magazynuje:
oksytocynę Wspomaga zapłodnienie oraz powoduje skurcze mięśni macicy, co ma znaczenie podczas akcji porodowej.
wazopresynę ADH (hormon antydiuretyczny)
Hormony części tylnej przysadki są syntetyzowane w podwzgórzu.
Regulacja wydzielania hormonów układ: podzgórze - przysadka - gruczoł wydzielania wewnętrznego
Oś podwzgórze - przysadka - nadnercza stanowi przykład układu podwzgórze, przysadka mózgowa i gruczoły obwodowe. Tworzą one układ trójkątny, w którym dokonuje się stała wymiana informacji zgodnie z zasadą ujemnego sprzężenia zwrotnego. Bez dodatkowych wpływów zewnętrznych poziom hormonów produkowanych w obrębie danego trójkąta utrzymywałby się na stałym poziomie (homeostaza). Podwzgórze stanowi wierzchołek trójkąta, łączący bezpośrednio biochemiczny kanał łączności z kanałami nerwowymi. Tą drogą wszelkiego rodzaju procesy psychiczne mogą wpływać na zmianę funkcji biochemicznych organizmu żywego. Szczególną pozycję w łączności mózgu z narządami wewnętrznymi zajmują aminy katecholowe: adrenalina i noradrenalina. Noradrenalina wytwarzana jest w synapsach układu współczulnego. Tak więc układ współczulny wywiera swój wpływ na narząd wewnętrzny lub na sploty czy zwoje narządowe za pośrednictwem substancji chemicznej, pod warunkiem, że jest ona produkowana bezpośrednio w samym narządzie. Adrenalina wytwarzana jest wraz z noradrenaliną przez komórki rdzenia nadnerczy. W reakcji na pobudzenie układu współczulnego komórki te wydzielają obydwie aminy bezpośrednio do krwiobiegu.
Nadmiernej aktywacja osi podwzgórze - przysadka - nadnercza może być przyczyną depresji psychogennej. Za takim przekonaniem przemawia wiele spostrzeżeń: stwierdzana stosunkowo często hiperkortyzolemia, powiększenie nadnerczy, a także fakt, że leki przeciwdepresyjne normalizują zaburzenia osi w ciężkich depresjach. Pewne przesłanki mogą wskazywać, że depresja psychotyczna jest kliniczną manifestacją zaburzeń funkcjonowania osi podwzgórzowo - przysadkowo - nadnerczowej. Może to potwierdzać fakt, że u osób otrzymujących egzogenne glikokortykoidy rozwijają się podobne objawy, obejmujące obniżony nastrój, objawy psychotyczne, typowe zaburzenia snu oraz upośledzenie funkcji poznawczych. Według niektórych koncepcji nadmierne i długotrwałe uwalnianie hormonów steroidowych (np. w reakcji na stres) może powodować trwałe uszkodzenie komórek hipokampa, odpowiedzialnych za działanie mechanizmu zwrotnego kontrolującego funkcjonowanie osi podwzgórze - przysadka - nadnercza.
27
COO-
|
+H3N - Cα - H
|
R
CH2 - O - CO - R1
|
CH - O - CO - R2
|
CH2 - O - CO - R3
Wyszukiwarka