POLITECHNIKA WARSZAWSKA Wydział Inżynierii Lądowej
|
S P R A W O Z D A N I E Z ĆWICZEŃ LABORATORYJNYCH Z PRZEDMIOTU: CHEMIA BUDOWLANA
|
Imię i Nazwisko |
Data wykonania ćwiczenia: |
15.10.2004 |
|
........................
|
Nr ćwiczenia: |
8.2 |
|
|
|
Temat ćwiczenia: |
|
Rok studiów: |
........ |
|
|
Semestr: |
.......... |
Oznaczenie zawartości nierozłożonego |
|
Grupa: |
........ |
węglanu wapniowego (CaCO3) w wapnie |
|
Zespół: |
........ |
palonym. |
|
|
|
||
Data: |
Ocena: |
||
|
|
||
Uwagi prowadzącego ćwiczenie:
|
SPRAWOZDANIE Z PRZEPROWADZENIA ĆWICZENIA NR 8.2
TEMAT ĆWICZENIA
Oznaczenie zawartości nierozłożonego węglanu wapniowego (CaCO3) w wapnie palonym
CEL ĆWICZENIA
Celem ćwiczenia jest określenie zawartości w wapnie palonym części niedopalonych przez oznaczenie zawartości w spoiwie nierozłożonego węglanu wapniowego (CaCO3). Doświadczenie przeprowadzono za pomocą metody gazometrycznej. Metoda ta polega na pomiarze ilości CO2 wydzielanego podczas działania kwasu solnego na węglany (głównie CaCO3) zawarte w wapnie
PODSTAWY TEORETYCZNE ĆWICZENIA
Wapno palone należy do powietrznych spoiw mineralnych, tzn. twardniejących po zarobieniu wodą na powietrzu. Surowcem do produkcji spoiw wapiennych są skały wapienne.
Wapno palone (CaO) otrzymuje się przez prażenie (wypalanie) wapieni. Jest to reakcja termicznego rozkładu węglanu wapiennego:
|
gdzie ΔH - entalpia reakcji
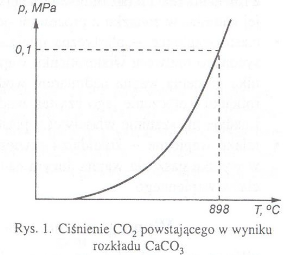
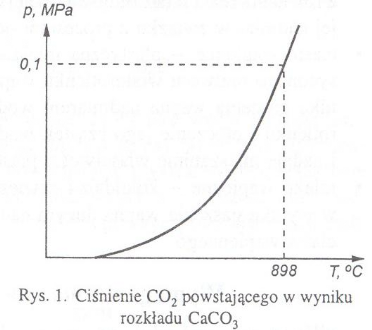
Jest to odwracalna reakcja endotermiczna, tzn. aby zaszła i ustalił się stan równowagi między produktami, a substratami wymagane jest dostarczenie do układu energii. Zgodnie z regułą przekory Le Chateliera i Brauna wzrost temperatury powoduje przesunięcie równowagi reakcji endotermicznej w kierunku produktów. Ze wzrostem temperatury w tym przypadku rośnie ciśnienie wydzielanego CO2. W temperaturze 898 oC ciśnienie to osiąga wartość ciśnienia atmosferycznego (rys. 1).W praktyce jest to minimalna temperatura prowadzenia procesu.
W warunkach takiej równowagi w układzie otwartym (wymieniającym masę i energię z otoczeniem) możliwe jest usuwanie ze środowiska reakcji jednego z produktów, w tym przypadku CO2. Układ dąży do przywrócenia stanu równowagi i jest to przyczyna, że reakcja staje się nieodwracalna, a rozkład węglanu jest całkowity.
W procesie przemysłowej produkcji wapna palonego w celu przyspieszenia reakcji stosuje się wyższe temperatury do 1100-1200 oC.
Wyróżnia się wapno:
słabopalone, T = 1000 oC, wielkość kryształów CaO ok. 1-2 μm,
średniopalone T = 1150 oC, wielkość kryształów CaO ok. 3-6 μm,
wysokopalone, T = 1300 oC, wielkość kryształów CaO > 10 μm.
W zależności od składu chemicznego rozróżnia się wapno:
powietrzne;
hydrauliczne;
wysokohydrauliczne.
W budownictwie wapno stosuje się przede wszystkim do otrzymywania zaprawy wapiennej, w tym celu wapno palone poddaje się procesowi hydratyzacji - „gaszeniu” wodą:
|
W czasie tej reakcji egzotermicznej temperatura układu znacznie wzrasta (nawet do 100 oC) a część wody ulega odparowaniu. Towarzyszy temu prawie dwukrotny wzrost objętość fazy stałej.
W zależności od ilości dodanej wody otrzymujemy
wapno hydratyzowane (suchogaszone), Ca(OH)2 w postaci proszku - minimalna ilość dodanej wody
ciasto wapienne, mieszanina Ca(OH)2 i jego nasyconego roztworu (konsystencja ciasta)
mleko wapienne, Ca(OH)2 zawiesina w wodzie.
Zaprawa wapienna składa się z wymieszanego wapna gaszonego piasku i wody. Zaprawa wapienna wiąże w ciągu kilku godzin w wyniku odparowania wody i krystalizacji wodorotlenku wapniowego (Ca(OH)2), następnie nawet przez kilka lat przebiega powolny proces twardnienia (reakcja karbonatyzacji):
Ca(OH)2 + CO2 = CaCO3 + H2O |
Zawarty w zaprawie piasek ułatwia wnikanie dwutlenku węgla (CO2) i przyspiesza proces karbonatyzacji.
OPIS STANOWISKA
Ćwiczenie przeprowadza się na stole laboratoryjnym.
Sprzęt potrzebny do wykonania ćwiczenia:
aparat do analizy gazometrycznej (rys. 2);
pipeta 25 cm3;
tygiel porcelanowy lub szklany;
elektroniczna waga jednoszalkowa (bezodważnikowa);
termometr;
barometr.
Ćwiczenie przeprowadza się z zachowaniem ostrożności i przepisów BHP (użycie kwasu HCl) po wcześniejszym założeniu fartucha.
PRZEBIEG WYKONYWANYCH CZYNNOŚCI
Ćwiczenie przeprowadza się za pomocą metody gazometrycznej, która polega na pomiarze ilości CO2 wydzielanego podczas działania kwasu solnego (HCl) na węglan wapnia CaCO3 zawarty w wapnie:
|
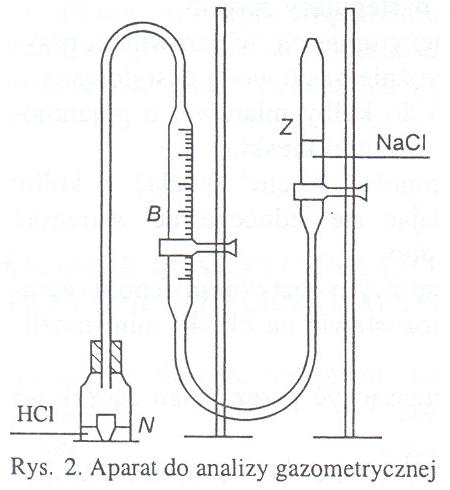
Oznaczenie ilości wydzielonego Co2 przeprowadza się w aparacie do analizy gazometrycznej (rys. 2)
B - skalibrowana biureta, napełniona
nasyconym roztworem NaCl, połączona
za pomocą węża gumowego ze
zbiornikiem wyrównawczym,
Z - zbiornik wyrównawczy napełniony
nasyconym roztworem NaCl,
N - naczynie zamknięte korkiem połączone z
biuretą za pomocą węża gumowego.
Do tygielka wsypano próbkę wapna palonego i odważono, na uprzednio wyzerowanej wadze 0,5 g wapna palonego.
Za pomocą pipety odmierzono (pobrano) 25 cm3 1m roztworu HCl
Za pomocą pokręteł przy biurecie (B) ustawiono położenie menisku w zbiorniku wyrównawczym (Z) na poziomie 0 (zero).
Do naczynia (N) wstawiono tygielek z wapnem palonym, a następnie wlano do naczynia 1 m roztwór HCl, tak, aby kwas otoczył na dnie tygielek z wapnem.
Naczynie (N) zamknięto korkiem, a następnie przechylono je w taki sposób, aby tygielek przewrócił się, a kwas przedostał się do próbki wapna palonego.
Odczytano temperaturę i ciśnienie panujące w pomieszczeniu
t = 22 oC, p = 995 hPa
Bezpośrednio po przechyleniu naczynia (N) dokonano odczytu położenia menisku roztworu NaCl w biurecie. Odczyt = 3,0 cm3. jest to ilość wydzielonego dwutlenku węgla.
Po 15 minutach dokonano ponownego odczytu poziomu menisku roztworu NaCl. Odczyt = 0,3 cm3(CO2).
Z tablicy 8.2 (str.67 „Ćwiczenia laboratoryjne...”) odczytano wartość prężności pary wodnej nad nasyconym roztworem NaCl, Wartość prężności pary wodnej w temperaturze 22 oC - f = 26,4 hPa
Zakończono czynności doświadczalne opróżniono naczynie, umyto tygielek, naczynie, pipetę i stół laboratoryjny. Przystąpiono do wykonywania obliczeń.
WYNIKI POMIARÓW
W trakcie doświadczenia dokonano następujących pomiarów:
Temperatura otoczenia ...................................................... t = 22,0 [oC]
Ciśnienie otoczenia ............................................................ p = 995,0 [hPa]
Prężność pary wodnej nad nasyconym roztworem NaCl.... f = 26,4 [hPa]
Maksymalny odczyt w biurecie (ilość wydzielonego CO2). .. V = 3,0 [cm3]
OBLICZENIA
Redukujemy objętość (V) wydzielonego CO2 w temperaturze t przy ciśnieniu p oraz prężności pary wodnej f nad nasyconym roztworem NaCl do objętości w warunkach normalnych V0 (273 K, 0,1 Mpa) korzystając ze wzoru:
Obliczamy zawartość CO2 w badanej próbce wapna palonego w procentach według wzoru:
Obliczamy zawartość procentową CaCO3 w badanej próbce wapna palonego z zależności:
KOŃCOWE WYNIKI ĆWICZENIA
Zawartość procentowa nierozłożonego (niedopalonego) CaCO3 w badanej próbce wapna palonego wynosi= 2,39%
Objętość wydzielonego podczas doświadczenia CO2 zredukowana do objętości w warunkach normalnych wynosi = 2,65 cm3
Procentowa zawartość CO2 w badanej próbce wapna palonego = 1,05 %
WNIOSKI
LITERATURA
Praca zbiorowa pod redakcją Lecha Czarneckiego „ Ćwiczenia laboratoryjne z chemii budowlanej” Oficyna Wydawnicza PW. Warszawa 2001
L. Czarnecki, T.Broniewski, O.Henning. „Chemia w Budownictwie”.Wydawnictwo ARKADY. Warszawa 1996, s. 236-237
notatki z przeprowadzenia doświadczenia w laboratorium
V0 = |
V . 273 . ( p - f ) |
|
cm3 . |
|
|
( 273 + t ) . 1013,25 |
|
|
|
Do powyższego wzoru wstawiamy dane z punkty 6. :
V0 = |
3,0 . 273 . ( 995,0 - 26,4 ) |
= |
793283,40 |
= |
2,65393168 |
= 2,65 cm3 |
|
( 273 + 22 ) . 1013,25 |
|
298908,75 |
|
|
|
Objętość wydzielonego CO2 zredukowana do objętości w warunkach normalnych wynosi = 2,65 cm3
% CO2 = |
d . V0 |
. 100 % |
|
|
|
|
m |
|
|
|
|
gdzie:
d = 0,0019768 g/cm3
m (masa badanej próbki) = 0,5 g
V0 = 2,65 cm3
% CO2 = |
0,0019768 . 2,65 |
. 100 % = 1,05 % |
|
0,5 |
|
Procentowa zawartość CO2 w badanej próbce wapna palonego = 1,05 %
masa cząsteczkowa CO2 |
= |
% CO2 |
masa cząsteczkowa CaCO3 |
|
% CaCO3 |
gdzie:
masa cząsteczkowa CO2 = (C) 12,0115 + (2O) 2. 15,994 = 44,0103
masa cząsteczkowa CaCO3 = (Ca) 40,08 + (C) 12,0115 + (3O) 3. 15,994 = 100,0894
zawartość procentowa CO2 w badanej próbce wapna palonego = 1,05 %
zawartość procentowa CaCO3 w badanej próbce wapna palonego = x
z powyższej zależności obliczamy zawartość CaCO3 w badanej próbce wapna palonego:
% CaCO3= |
masa cząsteczkowa CaCO3 . % CO2 |
= |
100,0894 . 1,05 |
= 2.3879 = 2, 39% |
|
masa cząsteczkowa CO2 |
|
44,0103 |
|
Zawartość procentowa CaCO3 w badanej próbce wapna palonego wynosi= 2,39%
Celem ćwiczenia było określenie zawartości w wapnie palonym części niedopalonych przez oznaczenie zawartości w spoiwie nierozłożonego węglanu wapniowego (CaCO3).
Po wykonaniu doświadczenia i dokonaniu pomiarów i obliczeń stwierdzono, że:
Ponadto:
Ponieważ w czasie doświadczenia badana była tylko jedna próbka wapna palonego, nie można przeprowadzić podstawowej analizy statystycznej.
Po zakończeniu doświadczenia i obliczeń stwierdzono, że w badanej próbce wapna palonego zawarte jest 2,39% nierozłożonego (niedopalonego) węglanu wapniowego (CaCO3). Po zapoznaniu się z przykładem nr 2 (Dodatek A „Ćwiczenia laboratoryjne... „s. 124-125) można przekonać się, że w każdej próbce wapna palonego znajdują się nierozłożone cząsteczki węglanu wapniowego. Zawartość nierozłożonego węglanu wapniowego w wapnie palonym może być różna dla poszczególnych partii wapna palonego, w zależności od składników i warunków procesu produkcji (w cytowanym przykładzie waha się od 1,124-1,263% w partii A i 1,723-2,432 w partii B).
Załącznik:
7
Wyszukiwarka