Struktura cząsteczki
Na całokształt współczesnego pojęcia struktury cząsteczki związku organicznego składają się następujące elementy:
1. Skład jakościowo-ilościowy cząsteczki
2. Konstytucja, czyli kolejność powiązania atomów w cząsteczce
3. Stereochemia, czyli przestrzenne rozmieszczenie atomów w cząsteczce
4. Stan elektryczny i magnetyczny cząsteczki
Ad. 1. Skład jakościowo-ilościowy cząsteczki związku organicznego
- Określa jakie pierwiastki i ile atomów poszczególnych pierwiastków składa się na cząsteczkę związku organicznego
- Skład jakościowo-ilościowy wyrażany jest za pomocą wzoru sumarycznego
- Wzór sumaryczny ustala się na podstawie wyników analizy elementarnej i wyników pomiaru masy cząsteczkowej
- W wyniku analizy elementarnej ustala się procentową zawartość poszczególnych pierwiastków w badanym związku organicznym
np. C- 54,55%, H-9,09%, O-36,36%
- Aby ustalić wzór empiryczny oblicza się iloraz zawartości procentowej każdego z pierwiastków i jego liczby atomowej:
C: 54,55/12=4,55; H:9,09/1=9,09; 0: 36,36/16=2,27
- Aby określić stosunek ilościowy , w jakim atomy poszczególnych pierwiastków występują w cząsteczce uzyskane liczby dzieli się przez najmniejszą z nich , zaokrąglając uzyskane wartości do liczb całkowitych
C: 4,55/2,27=2, H: 9,09/2,27=4, O: 2,27/2,27=1
wzór empiryczny C2H40
ale wzór sumaryczny może być (C2H40)n
- Aby wyznaczyć n należy:
oznaczyć masę cząsteczkową badanego związku (spektrometria mas)
podzielić uzyskaną wartość przez masę cząsteczkową o wzorze sumarycznym równym wzorowi empirycznemu (n=1)
np. dla (C2H40)n m.cz.= 88 zatem n= 88/44=2 czyli
wzór sumaryczny (C2H40)2 lub C4H802
Ad. 2. Konstytucja, czyli kolejność powiązania atomów w cząsteczce
- Zawiera informacje o tym, w jakiej kolejności powiązane są ze sobą atomy, czyli w jakich podstawnikach lub inaczej grupach funkcyjnych występują one w cząsteczce
- Konstytucję cząsteczki wyraża wzór strukturalny, w którym kreski symbolizują wiązania chemiczne pomiędzy poszczególnymi atomami (pary elektronowe tworzące wiązanie chemiczne)
- W takim ujęciu pojęcie konstytucji nie obejmuje żadnych elementów geometrii cząsteczek
Wzór sumaryczny C2H6O
Uwzględniając wartościowość atomów węgla (4), wodoru (1) i tlenu(2)
wzór strukturalny I wzór strukturalny II
Ad. 3. Stereochemia
- Określa przestrzenne rozmieszczenie atomów w cząsteczce związku organicznego
- Cząsteczki związków organicznych są układami trójwymiarowymi, przy czym poszczególne atomy wchodzące w ich skład zajmują określone położenia w przestrzeni
- W celu ustalenia architektury cząsteczki konieczna jest znajomość
odległości międzyatomowych
kątów między kierunkami wiązań
Ad. 4. Stan elektryczny i magnetyczny cząsteczek związków organicznych
- Uwarunkowany jest rozmieszczeniem elektronów oraz jąder atomowych
- Rozkład i wielkość ładunków elektrycznych w cząsteczce z znacznym stopniu warunkują kierunek i możliwość zachodzenia odpowiednich przemian chemicznych
Jeżeli cząsteczka zbudowana jest z atomów o różnym powinowactwie do elektronów to wskutek przesunięcia się chmur elektronowych wewnątrz cząsteczki „środek ciężkości” ładunków ujemnych nie pokrywa się ze „środkiem ciężkości” ładunków dodatnich → cząsteczka staje się trwałym dipolem
Moment dipolowy [D] µ= e*l
gdzie: e wartość ładunku jednego z biegunów dipola
l odległość między biegunami dipola
Izomeria związków organicznych
Związki, które mają ten sam cząsteczkowy wzór sumaryczny (są zbudowane z jednakowej liczby i rodzaju atomów) ale różnią się sposobem, w jaki poszczególne atomy są rozmieszczone w cząsteczkach nazywamy izomerami
Rodzaje izomerii
konstytucyjna (strukturalna)
stereoizomeria (izomeria przestrzenna)
konformacyjna
konfiguracyjna
Przyczyną izomerii mogą być:
różnice struktury cząsteczek (różne wiązania, różne uszeregowanie atomów lub podstawników) lub
różnice w przestrzennej konfiguracji atomów lub podstawników
Izomeria konstytucyjna (strukturalna) spowodowana różną kolejnością łączenia się atomów lub podstawników albo występowaniem różnych wiązań między nimi:
izomeria łańcuchowa, spowodowana występowaniem cząsteczek w formie łańcuchów prostych i rozgałęzionych
izomeria położeniowa wynika z odmiennej pozycji wyróżnionego wiązania w cząsteczkach izomerów
izomeria podstawienia spowodowana różnym rozmieszczeniem podstawników w stosunku do łańcucha lub pierścienia cząsteczkowego
izomeria budowy (funkcyjna) - izomerami są związki posiadające różne grupy funkcyjne, np: etanol i eter dimetylowy;
Jednym z rodzajów izomerii jest izomeria łańcuchowa, izomeria strukturalna węglowodorów alifatycznych, powodowana różnym uszeregowaniem atomów węgla w cząsteczce.
Jeśli węglowodór zawiera nie więcej niż trzy atomy węgla w cząsteczce (propan), wówczas ich uszeregowanie jest jednoznaczne.
Już w przypadku butanu możliwe są dwa różne uszeregowania atomów węgla w cząsteczce
Izobutan (2-metylopropan) n-butan
Istnieją więc dwa rodzaje cząsteczek o wzorze sumarycznym C4H10. Nazywamy je izomerami łańcuchowymi, bo różnica w ich strukturze polega na różnej budowie łańcucha węglowego.
Izomeria położenia dotyczy położenia podstawnika lub wiązania wielokrotnego w cząsteczce
Izomeria podstawienia spowodowana różnym rozmieszczeniem podstawników w stosunku do łańcucha lub pierścienia cząsteczkowego
Izomeria budowy (funkcyjna) - izomerami są związki posiadające różne grupy funkcyjne, np: etanol i eter dimetylowy;
Cechy izomerów strukturalnych:
Izomery strukturalne wykazują różnice w zakresie
właściwości fizycznych
właściwości chemicznych
właściwości spektroskopowych
Stereoizomeria (izomeria przestrzenna)
Izomeria przestrzenna
konformacyjna (uwzględnia obrót wokół pojedynczego wiązania)
konfiguracyjna (nie uwzględnia obrotu wokół pojedynczego wiązania)
geometryczna (nie uwzględnia tetraedrycznej hybrydyzacji atomu węgla)
optyczna (uwzględnia tetraedryczną hybrydyzacji atomu węgla)
diastereoizomery (związki nie mające odbić lustrzanych)
enancjomery (związki mające lustrzane odbicia)
Izomeria konformacyjna
Konformacja - układ przestrzenny całej cząsteczki mogący ulegać zmianom, bez zrywania wiązań chemicznych
Cząsteczki, które posiadają ten sam układ wiązań i atomów ale różniące się kształtem nazywamy izomerami konformacyjnymi lub konformerami lub izomerami rotacyjnymi
Cząsteczki zmieniają swój kształt na skutek rotacji wokół wiązań chemicznych tworzących je grup atomów względem innych grup atomów.
Rotacja ta jest możliwa tylko wokół wiązań pojedynczych i jest zablokowana w przypadku wiązań wielokrotnych.
Projekcja Newmana
Projekcja Newmana rodzaj projekcji cząsteczek chemicznych służący głównie do analizowania ich konformacji. Jest ona wygodnym sposobem przedstawiania rotacji podstawników wokół wiązań pojedynczych.
W projekcji Newmana cząsteczkę przedstawia się w następujący sposób:
Wybrane sąsiadujące atomy, połączone jednym wiązaniem pojedynczym przedstawia w postaci jednego koła, które symbolizuje też oś tego wiązania.
Na cząsteczkę patrzy się wzdłuż osi wybranego wiązania od strony jednego z dwóch wybranych atomów.
Od środka koła rysuje się kreski symbolizujące wiązania atomu widzianego od strony obserwatora z jego pozostałymi podstawnikami.
Od granicy koła rysuje się kreski symbolizujące wiązania z podstawnikami tylnego atomu. Kreski te przesuwa się nieco w prawo, aby nie nakładały się one z kreskami dla pierwszego atomu.
Na końcach kresek symbolizujących wiązania pisze się symbole atomów lub grup.
Konformacja
naprzeciwległa naprzemianległa
Konformacja naprzeciwległa
Kąty między kierunkami wiązań C-H rzutowanymi na płaszczyznę prostopadła do osi wiązania C-C wynoszą 00
Konformacja naprzemianległa
Kąty między kierunkami wiązań C-H rzutowanymi na płaszczyznę prostopadła do osi wiązania C-C wynoszą 600
Wzory stereostrukturalne konformerów butanu (kolejno: 180°, 120°, 60°, 0°)
Projekcje Newmana konformerów butanu (kolejno: 180°, 120°, 60°, 0°)
Izomery konfiguracyjne
Związki o takim samym wzorze cząsteczkowym, takich samych wiązaniach chemicznych w cząsteczce
Różnią się przestrzennym ułożeniem atomów względem siebie
Izomerów konfiguracyjnych nie można wzajemnie przekształcić bez zerwania wiązań kowalencyjnych
Dwa typy izomerów konfiguracyjnych: izomery geometryczne i optyczne
Izomeria geometryczna
Izomeria przestrzenna nie uwzględniająca tetraedrycznej hybrydyzacji atomu węgla
Konfigurację izomerów geometrycznych rozróżnia się za pomocą nazw, które zawierają przedrostek cis- lub trans-, co wskazuje na usytuowanie grup po tej samej lub po przeciwnej stronie płaszczyzny
Izomeria geometryczna jest następstwem występowania wiązania podwójnego którego sztywność wyklucza obrót wokół niego. Izomery geometryczne charakteryzują się identyczną strukturą, różnią się konfiguracją (rozmieszczeniem przestrzennym atomów), co jest przyczyną różnych właściwości fizykochemicznych
W przypadku trój - i cztero podstawionych izomerów geometrycznych (wodór nie jest uważany za odrębny podstawnik), nie wystarcza nazewnictwo cis i trans stosuje się oznaczenia E i Z.
Każdemu podstawnikowi przypisuje się ważność (pierwszeństwo) zależną od jego liczby atomowej
Symbol Z (odpowiednik określenia cis) przypisuje się temu izomerowi, w którym dwa najważniejsze podstawniki znajdują się po tej samej stronie cząsteczki
Z (z niem. Zusammen - razem)
Symbol E (odpowiednik określenia trans) przypisuje się izomerowi, w którym dwa najważniejsze podstawniki znajdują się po przeciwnych stronach czasteczki
E (z niem. Entgegen- naprzeciw)
O ważność (pierwszeństwie) podstawników decyduje liczba atomowa. Podstawniki o dużej liczbie atomowej są ważniejsze (mają pierwszeństwo)
Izomeria syn-anti jest odpowiednikiem izomerii geometrycznej cis-trans, dla wiązań C=N i N=N.
Przykłady: dwuazany
Izomeria optyczna
Geometria
Każda z hybryd sp3 ma kształt zdeformowanej hantli, w którym jedna z pętli jest znacznie większa od drugiej.
Hybrydy rozmieszczają się w przestrzeni tak, aby jak najbardziej oddalić się od siebie
W rezultacie większe pętle każdego z orbitali skierowane są ku narożom czworościanu foremnego
Mechanizm hybrydyzacji sp3 wyjaśnia występowanie tetraedrycznie zorientowanych wiązań węgla w łańcuchach węglowodorów nasyconych
Związki o asymetrycznej budowie cząsteczki nie mające płaszczyzny i punktu symetrii są optycznie czynne . Cząsteczki asymetryczne swą asymetryczność zawdzięczają obecności asymetrycznego atomu węgla.
Przyczyną asymetryczności atomu węgla jest podstawienie czterech różnych podstawników do jednego atomu węgla.
Izomeria optyczna - rodzaj stereoizomerii występującej w cząsteczkach
chiralnych, które zawierają atom węgla, do którego przyłączone są cztery
różne grupy. Taki atom nosi nazwę centrum chiralności.
Oznacza to, że dla każdej cząsteczki posiadającej centrum chiralności
możemy znaleźć drugą cząsteczkę będącą jej lustrzanym odbiciem
Kwas (+)mlekowy skręca płaszczyznę polaryzacji światła zgodnie z kierunkiem ruchu wskazówek zegara zatem oznacza się go jako enancjomer (+) lub (d)
Dextro z grec. Prawy
Kwas (-)mlekowy skręca płaszczyznę polaryzacji światła przeciwnie do kierunku ruchu wskazówek zegara zatem oznacza się go jako enancjomer (-) lub (l)
Levo z grec. Lewy
Izomeria optyczna wiąże się ze zdolnością skręcania płaszczyzny światła spolaryzowanego. Substancje takie nazywa się optycznie czynnymi; skręcające płaszczyznę światła spolaryzowanego w prawo - nazywa się prawoskretnymi /+/, a skrecajace w lewo -lewoskretnymi /-/
* Centrum chiralności (centrum stereogeniczne, asymetryczny atom węgla)
Bezwzględnym warunkiem występowania izomerii optycznej jest istnienie dwóch, przestrzennych struktur o tej samej konstytucji, stanowiących wzajemne lustrzane odbicie, ale tak, że jednej nie da się, przez żaden dowolny obrót, nałożyć na drugą
Enancjomery - para związków, z których każdy ma jedno lub więcej centrum stereogeniczne i które pozostają względem siebie jak odbicia lustrzane; inaczej: dwa izomery przestrzenne, z których jeden zbudowany jest z cząsteczek stanowiących nienakładalne, lustrzane odbicie cząsteczek drugiego
Zjawisko występowania związków w postaci enancjomerów nazywane jest enancjomerią.
Każdy z enancjomerów zbudowany jest z cząsteczek chiralnych i każdy jest substancją optycznie czynną
Właściwości enancjomerów:
Niemal wszystkie właściwości fizyczne enancjomerów, tej samej substancji, są jednakowe, ale zawsze enancjomery różnią się kierunkiem skręcania płaszczyzny światła spolaryzowanego: jeden w prawo(+), drugi w lewo (-), o ten sam kąt, charakterystyczny dla danej substancji.
Enancjomery mogą także różnić się barwą, zapachem lub smakiem.
Umowne przedstawianie wzorów przestrzennych
WZORY RZUTOWE FISCHERA (PROJEKCJA FISCHERA)
atom centralny (centrum chiralności) leży w płaszczyźnie papieru,
wiązania leżące przed (nad) płaszczyzną rysunku, tj. skierowane ku obserwatorowi, zaznaczone są na rysunku poziomo,
wiązania schowane za (pod) płaszczyznę, tj. skierowane od obserwatora, zaznaczone są pionowo
Bromochlorojodometan
Stosuje się przy tym następujące, umowne oznaczenia:
- linia o normalnej grubości oznacza wiązanie w płaszczyźnie rysunku.
- linia pogrubiona lub klin (poszerzony w kierunku obserwatora) oznaczają wiązanie wysunięte przed płaszczyznę rysunku,
- linia przerywana oznacza wiązanie schowane za płaszczyzną rysunku
atom centralny (centrum chiralności) umieszcza się w płaszczyźnie rysunku, zamiast centrum rysuje się kółko,
wiązania wysunięte przed płaszczyznę rysunku zaznacza się ukośnymi kreskami wchodzącymi do wnętrza kółka,
wiązania schowane za płaszczyzną rysunku zaznacza się ukośnymi kreskami dotykającymi jedynie zewnętrznej krawędzi kółka
KONFIGURACJA WZGLĘDNA D-L
System ten, zaproponowany przez Fischera ok. roku 1885, stosowany jest także współcześnie, ale tylko w ograniczonym zakresie. Przede wszystkim do określania konfiguracji hydroksykwasów, aminokwasów i cukrów
Za wzorzec do określania konfiguracji centrum chiralności przyjmuje się: aldehyd glicerynowy
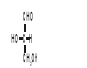
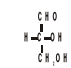
aldehyd L-glicerynowy aldehyd D-glicerynowy
Cechą szczególną jest położenie grupy -OH przy centrum chiralności (cząsteczki ustawione muszą być zgodnie z regułami pisania wzorów wg.Fischera):
Izomer o konfiguracji: L (od „loevus”) - po lewej stronie ; D (od „dexter”) - po prawej stronie.
Izomery o konfiguracji D i L, tej samej substancji, stanowią wzajemnie nienakładalne lustrzane odbicie, czyli są enancjomerami
W celu określenia konfiguracji w cząsteczkach danego izomeru optycznego badanej substancji, należy:
- zapisać wzór rzutowy wg. Fischera (zgodnie z regułami),
- grupę funkcyjną będącą chemicznym odpowiednikiem grupy aldehydowej (tj. taką grupę, którą można otrzymać z grupy aldehydowej, na drodze przemian chemicznych) umieścić nad centrum chiralności,
- odczytać położenie grupy -OH (lub jej chemicznego odpowiednika), porównując do wzorca
Konfiguracja zgodna z konfiguracją aldehydu D-glicerynowego oznacza przynależność badanego izomeru do szeregu konfiguracyjnego D.
Konfiguracja zgodna z konfiguracją aldehydu L-glicerynowego oznacza przynależność badanego izomeru do szeregu konfiguracyjnego L
KONFIGURACJA ABSOLUTNA R-S
System jednoznacznie identyfikujący konfigurację wokół centrum stereogenicznego (atomu chiralnego)
Wiedząc czy mamy do czynienia z izomerem R czy S można narysować trójwymiarowy kształt cząsteczki
Izomer R jest enancjomerem izomeru S
Oznaczenia R i S przypisuje się enancjomerom zgodnie z regułami Cahna-Ingolda-Preloga:
1. O kolejności decyduje przede wszystkim liczba atomowa (l.a) atomu podstawnika, który jest bezpośrednio przyłączony do centrum chiralności.
Oznacza to np: że w sytuacji, gdy podstawniki są czterema różnymi pojedynczymi atomami
(np: jod (I, l.a = 57), brom (Br, l.a = 35), chlor (Cl, l.a= 17), wodór (H, l.a = 1) ich kolejność jest następująca: I > Br > Cl > H
2. Jeśli podstawniki łączą się z centrum chiralności tymi samymi atomami, to należy wziąć pod uwagę kolejne atomy przyłączone bezpośrednio do atomu, którym cały podstawnik łączy się z centrum chiralności. Jeśli i te mają tę samą liczbę atomową, należy wziąć pod uwagę kolejne, dalsze atomy, aż w końcu dojdzie się do takiej pary atomów, z których jeden ma większą liczbę atomową od drugiego
3. Gdy dalsze atomy są połączone wiązaniami wielokrotnymi, liczy się się je jakby były połączone wiązaniami pojedynczymi, tyle że wiele razy. Oznacza to np. że gdy mamy dwa podstawniki -A=B i -A-B, podstawnik -A=B będzie pierwszy gdyż A łączy się z atomem B "dwa razy" podczas gdy podstawnik -A-B tylko "raz".
4. Gdy w podstawniku występują ugrupowania cykliczne, a wcześniejsze reguły nie pozwoliły ustalić kolejności, przed "dotarciem" do układu cyklicznego, stosuje się zasadę, że o kolejności decyduje "dotarcie" do pary dwóch różnych atomów po jak najkrótszej drodze (przechodząc przez jak najmniejszą liczbę wiązań chemicznych).
Cząsteczka 4-bromo-3-chloro-1-jodopentanu zawiera cztery podstawniki wokół centrum chiralności (czerwony atom węgla):
Zgodnie z regułą 1. pierwszy w kolejności jest podstawnik chlorkowy, (Cl), bo atom chloru ma większą liczbę atomową od węgla i wodoru. Ostatni w kolejności jest atom wodoru. Ustalenie kolejności podstawnika 2-jodoetylowego w stosunku do 1-bromoetylowego wymaga zastosowania reguły 3., gdyż jod ma co prawda większą liczbę atomową od chloru, ale jest dalej odsunięty od centrum chiralności. Zgodnie z regułą 3. podstawnik 1-bromoetylowy ma pierwszeństwo, gdyż atomowi bromu podstawionemu do atomu węgla, który jest bezpośrednio przyłączony do centrum chiralności odpowiada w podstawniku 2-jodoetylowym atom wodoru. Ostateczna kolejność podstawników wygląda zatem tak: chlorkowy > 1-bromoetylowy > 2-jodoetylowy > wodorkowy
Cztery grupy związane z centrum chiralności układa się w kolejności
pierwszeństwa, ustalonego w sposób opisany poniżej B → C → D → A.
Na atom chiralny patrzy się od strony przeciwnej w stosunku do grupy A.
Jeżeli pozostałe grupy w kolejności pierwszeństwa (B → C → D)
układają się zgodnie z kierunkiem ruchu wskazówek zegara konfigurację
określa się literą R (od łac. rectus - prawy). Jeżeli układają się przeciwnie,
konfigurację określa się literą S (od łac. sinister - lewy).
Diastereoizomeria
Związek optycznie czynny zawierający w cząsteczce kilka centrów chiralności, występować może w postaci większej liczby izomerów optycznych. Jeżeli w cząsteczce występuje „n” centrów chiralności, a każde z nich może mieć dwie różne konfiguracje, to maksymalnie może istnieć 2n izomerów
Maksymalna liczba stereoizomerów wynosi 2n, gdzie n jest to liczba asymetrycznych atomów węgla. Jeżeli w cząsteczce są 2 asymetryczne atomy węgla mogą istnieć 4 izomery
para enancjomerów para enancjomerów
Cząsteczka może mieć tylko jeden obraz lustrzany, zatem wśród czterech izomerów istnieją dwie pary enancjomeryczne (I i II oraz III i IV), natomiast pary I - III, I - IV, II - III nie stanowią odbić lustrzanych (nie są enancjomerami) i różnią się właściwościami chemicznymi i fizycznymi podobnie jak izomery konstytucyjne. Stereoizomery nie będące enancjomerami noszą nazwę diastereoizomerów.
8
Typ wiązania |
Długość wiązania (Å) |
Csp3- Csp3 |
1,54 |
Csp2-Csp2 |
1,340 |
Csp-Csp |
1,202 |
2-jodoetylowy: ICH2CH2-
1-bromoetylowy: CH3CHBr-
chlorkowy: Cl-
wodorkowy: H-
Wyszukiwarka