Biochemia
laboratorium
Ćwiczenie 3:
Sacharydy
Sprawozdanie poprawione: 5.05.2011
grupa:
Katarzyna Kędzierska 144530
Dominika Kępska
Justyna Dabrowska
kierunek Biotechnologia
grupa dziekańska: III
semestr: IV
data wykonania ćwiczenia: 24.03.201
data oddania sprawozdania 31.03.2011
Wstęp teoretyczny:
Sacharydy (węglowodany, cukrowce) - są to organiczne związki chemiczne, zbudowane z węgla, wodoru i tlenu. Sacharydy zawierają w swojej cząsteczce jednocześnie różną ilość grup hydroksylowych (-OH), grupę karbonylową (aldehydową bądź ketonową), a także czasem mostki półacetalowe.
Podział sacharydów:
Sacharydy można podzielić pod względem:
a) liczby jednostek cukrowych w cząsteczce
cukry proste
monosacharydy
cukry złożone
disacharydy (dwucukry)
tri-, tetra-, penta-, heksa-, hepta- itd. sacharydy (oligosacharydy - od 2 do 10 monomerów)
polisacharydy (ponad 10 monomerów)
b) rodzaju grupy karbonylowej w cząsteczce
aldozy z grupą aldehydową
ketozy z grupą ketonową.
Monosacharydy - cukry proste:
W roztworach wodnych w pH zasadowym sacharydy występują w formie łańcuchowej. W środowisku obojętnym i kwaśnym otwarte formy łańcuchowe cukrów ulegają cyklizacji i przyjmują strukturę pierścieniową (aldozy przechodzą w pochodne piranu, ketozy w pochodne furanu), w której grupa karbonylowa jest zablokowana wskutek utworzenia wewnątrzcząsteczkowego wiązania hemiacetalowego (półacetalowego) w aldozach lub hemiketalowego (półketalowego) w ketozach. W rezultacie mogą powstać dwie formy anomeryczne, oznaczane jako i . Ze względu na podobieństwo pierścienia do piranu (sześcioczłonowy) lub furanu (pięcioczłonowy), powstający cukier nazywany jest piranozą lub furanozą.
Cukier prosty można opisać różnymi wzorami takimi jak: wzór łańcuchowy według Fischera, wzór pierścieniowy według Fischera Tollensa, wzór taflowy pełny i skrócony według Hawortha, wzór perspektywiczny łóżeczkowy i krzesełkowy.
Disacharydy:
Obecność wielu grup hydroksylowych w monosacharydach umożliwia łączenie się dwóch lub więcej cząsteczek za pomocą wiązań O-glikozydowych i tworzenie połączeń typu acetali lub ketali. Produkty przyłączania alkoholi do anomerycznego atomu węgla monosacharydów nazywa się ogólnie glikozydami.
Disacharydy (dwucukry) powstają w wyniku utworzenia wiązania glikozydowego pomiędzy anomeryczną grupą hydroksylową jednego monosacharydu z jedną z grup hydroksylowych innego monosacharydu.
Polisacharydy:
Polisacharydy są polimerami monosacharydów połączonych wiązaniami glikozydowymi. Mogą być zbudowane z jednego rodzaju monosacharydów (homoglikany) lub z różnych cukrów prostych (heteroglikany). Polisacharydy występują w postaci liniowych łańcuchów lub są rozgałęzione.
Część doświadczalna:
2.1. Działanie kwasów na sacharydy:
2.1.1. Odczyn Molischa z α - naftolem:
Odczynnik: 20% etanolowy roztwór α - naftolu, stężony H2SO4
Wykonanie:
Do 1 cm3 roztworu glukozy (fruktozy, arabinozy) dodaliśmy 2 krople roztworu α - naftolu i wymieszaliśmy. Następnie po ściance przechylonej probówki wlaliśmy ostrożnie 1 cm3 stężonego kwasu siarkowego (nie mieszając).
Obserwacje:
Tabela nr 1: Obserwacje z doświadczenia z α - naftolem
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji α - naftolu i stężonego kwasu siarkowego |
2% roztwór glukozy |
pojawiła się ciemnofioletowa obrączka |
2% roztwór fruktozy |
pojawiła się ciemnofioletowa obrączka |
2% roztwór arabinozy |
pojawiła się ciemnofioletowa obrączka |
Wnioski:
We wszystkich badanych roztworach stwierdzamy obecność sacharydów, wnioskując to z obserwacji barwnej obrączki, która jest rezultatem odwodnienia sacharydów do cyklicznych aldehydów (heksozy odwadniają się do 5-hydroksymetylenofurfuralu, pentozy do furfuralu) pod wpływem działania stężonego kwasu siarkowego. Następnie formy cykliczne aldehydów
(5-hydroksymetylenofurfural, furfural) kondensują z pochodną fenolową (α - naftolem) tworząc barwny związek.
Reakcja:
I etap reakcji: odwodnienie sacharydów pod wpływem stężonego kwasu siarkowego do cyklicznych aldehydów (5-hydroksymetylenofurfuralu, furfuralu)
pentoza (arabinoza) heksoza (glukoza, fruktoza)II etap reakcji: kondensacja cyklicznego aldehydu (5-hydroksymetylenofurfuralu, furfuralu) z dwoma cząsteczkami α - naftolu i utworzenie barwnego połączenia
Zasada działania:
Jest to ogólna reakcja wykrywania sacharydów, polegająca na odwodnieniu każdego sacharydu pod wpływem stężonego kwasu (w tym przypadku kwasu siarkowego). Odłączenie cząsteczki wody od sacharydu prowadzi do przekształcenia łańcucha węglowego w formę cykliczną - cykliczny aldehyd (dla pentozy w furfural, dla heksozy w 5-hydroksymetylenofurfural). Następnie forma cykliczna aldehydu reaguje (kondensuje) z rożnymi pochodnymi fenolu (w tym przypadku z α - naftolem), dając barwne związki.
2.1.2. Próba z tymolem:
Odczynnik: 3% etanolowy roztwór tymolu, stężony HCl
Wykonanie:
Do 1 cm3 roztworu glukozy (fruktozy, arabinozy) dodaliśmy 4 krople roztworu tymolu i 2 cm3 stężonego HCl. Wstawiliśmy na 5 minut do wrzącej łaźni wodnej.
Obserwacje:
Tabela nr 2: Obserwacje z doświadczenia z tymolem
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji tymolu i stężonego kwasu solnego, a następnie ogrzewaniu we wrzącej łaźni wodnej mieszaniny przez ok. 4 minuty |
2% roztwór glukozy |
roztwór przybiera kolor brudnoróżowy |
2% roztwór fruktozy |
roztwór przybiera kolor ciemnobrunatny |
2% roztwór arabinozy |
roztwór przybiera kolor grafitoworóżowy |
Wnioski:
W badanych roztworach stwierdzamy obecność sacharydów, wnioskując to z obserwacji zabarwienia się wcześniej bezbarwnych roztworów. Barwne produkty reakcji są wynikiem odwodnienia sacharydów do cyklicznych aldehydów (heksozy odwadniają się do
5-hydroksymetylenofurfuralu, pentozy do furfuralu) pod wpływem działania stężonego kwasu solnego. Następnie formy cykliczne aldehydów (5-hydroksymetylenofurfural, furfural) kondensują z pochodną fenolową (tymolem) tworząc barwny związek.
Reakcja:
I etap reakcji: odwodnienie sacharydów pod wpływem stężonego kwasu solnego do cyklicznych aldehydów (5-hydroksymetylenofurfuralu, furfuralu)
pentoza (arabinoza) heksoza (glukoza, fruktoza)
II etap reakcji: kondensacja cyklicznego aldehydu (5-hydroksymetylenofurfuralu, furfuralu) z dwoma cząsteczkami tymolu i utworzenie barwnego związku
Zasada działania:
Jest to ogólna reakcja wykrywania sacharydów, polegająca na odwodnieniu każdego sacharydu pod wpływem stężonego kwasu (w tym przypadku kwasu solnego). Odłączenie cząsteczki wody od sacharydu prowadzi do przekształcenia łańcucha węglowego w formę cykliczną, cykliczny aldehyd (dla pentozy w furfural, dla heksozy w 5-hydroksymetylenofurfural). Następnie forma cykliczna aldehydu reaguje (kondensuje) z rożnymi pochodnymi fenolu (w tym przypadku z tymolem), dając barwne połączenia.
2.1.3. Wykrywanie ketoz. Próba Seliwanowa:
Odczynnik: HCl (rozc. 1:1), 2% etanolowy roztwór rezorcyny
Wykonanie:
Do czterech probówek wlaliśmy po 1 cm3 roztworów: glukozy, fruktozy, maltozy i sacharozy. Następnie dodaliśmy do każdej probówki po 2 cm3 roztworu HCl (rozc. 1:1) i 1 kroplę roztworu rezorcyny. Wstawiliśmy na kilka minut do wrzącej łaźni wodnej.
Obserwacje:
Tabela nr 3: Obserwacje z próby Seliwanowa
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji kwasu solnego (rozc. 1:1), rezorcyny, a następnie ogrzaniu we wrzącej łaźni wodnej |
2% roztwór glukozy |
po ok. 5 minutach roztwór przybiera kolor pomarańczowołososiowy |
2% roztwór fruktozy |
po ok. 30 sekundach roztwór przybiera kolor buraczkowy |
2% roztwór maltozy |
po ok. 5 minutach roztwór przybiera kolor jasnopomarańczowy |
2% roztwór koloidalny skrobi |
po ok. 1 minucie roztwór przybiera kolor czerwony |
Wnioski:
Z obserwacji czasu po jakim wystąpiło zabarwienie stwierdzamy, że fruktoza jest ketozą, a sacharoza zawiera grupę ketonową, gdyż w ich przypadku znacznie szybciej (30 sekund - 1 minuta) pojawiły się barwne produkty reakcji w porównaniu z pojawieniem się zabarwienia dla glukozy i maltozy (5 minut). Stwierdzamy, że glukoza i maltoza nie są ketozami (lub też nie zawierają grup ketonowych), gdyż ich czas reakcji był zbyt długi. Ponieważ jednak zabarwienie wystąpiło, wnioskujemy, że glukoza i maltoza są sacharydami, a skoro nie zawierają grup ketonowych, to muszą zawierać grupy aldehydowe. Zabarwienie to jest wynikiem odwodnienia sacharydów pod wpływem rozcieńczonego (1:1) kwasu solnego i przekształcenia się w cykliczne aldehydy (pentozy - furfural, heksozy - 5-hydroksymetylenofurfural), które to kondensują z pochodnymi fenolu (w tym przypadku rezorcyną).
Reakcja:
I etap reakcji: odwodnienie sacharydów pod wpływem rozcieńczonego (1:1) kwasu solnego do cyklicznych aldehydów (5-hydroksymetylenofurfuralu, furfuralu)
pentoza heksoza (glukoza, fruktoza)II etap reakcji: kondensacja cyklicznego aldehydu (5-hydroksymetylenofurfuralu, furfuralu) z dwoma cząsteczkami rezorcyny i utworzenie barwnego połączenia
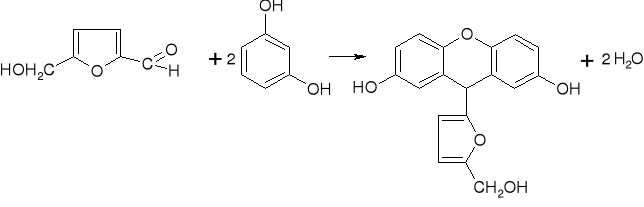
Zasada działania:
Jest to reakcja wykrywania sacharydów (a także odróżniania ketoz od aldoz), polegająca na odwodnieniu sacharydu pod wpływem rozcieńczonego kwasu (w tym przypadku kwasu solnego rozc. 1:1), czyli przejścia sacharydu w cykliczny aldehyd (pentozy - furfural, heksozy - 5-hydroksymetylenofurfural), a następnie kondensacji tegoż cyklicznego aldehydu z pochodną fenolową (w tym przypadku rezorcyną). Korzystamy z tego, że ketozy pod wpływem rozcieńczonego kwasu odwadniają się o wiele szybciej niż aldozy, dzięki czemu możemy odróżnić jedne od drugich.
2.1.4. Wykrywanie pentoz. Reakcja Biala:
Odczynnik: 0,2% roztwór orcyny w 20% HCl, 1% roztwór FeCl3
Wykonanie:
Do trzech probówek wlaliśmy po 0,5 cm3 roztworów: arabinozy, glukozy i fruktozy. Następnie dodaliśmy do każdej probówki po 2 cm3 roztworu orcyny i kroplę roztworu FeCl3. Wstawiliśmy na kilka minut do wrzącej łaźni wodnej.
Obserwacje:
Tabela nr 4: Obserwacje z reakcji Biala
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji roztworu orcyny (w HCl), roztworu FeCl3, a następnie ogrzaniu we wrzącej łaźni wodnej przez około 2-3 minuty |
2% roztwór arabinozy |
przybrał kolor ciemnomorski |
2% roztwór glukozy |
przybrał kolor żółty |
2% roztwór fruktozy |
przybrał kolor brunatny |
Wnioski:
Tylko dla arabinozy wynik reakcji jest dodatni (zabarwienie morskie), co oznacza, że jedynie arabinoza jest pentozą, gdyż tylko ona dała morskie zabarwienie z orcyną w obecności FeCl3 jako katalizatora (a w warunkach reakcji - 2-3 minutowego ogrzewania we wrzącej łaźni wodnej - tylko odwodnione pentozy w postaci cyklicznych form aldehydów dają morskie zabarwienie z tym odczynnikiem). Ponieważ w innych probówkach, ogrzewanych we wrzącej łaźni wodnej jedynie przez 2-3 minuty, powstały innej barwy produkty stwierdzamy, że nie ma w nich pentoz (glukoza i fruktoza nie są pentozami).
Reakcja:
I etap reakcji: odwodnienie sacharydów pod wpływem 20% kwasu solnego (zawartego w roztworze orcyny) do cyklicznych aldehydów (5-hydroksymetylenofurfuralu, furfuralu)
pentoza (arabinoza) heksoza (glukoza, fruktoza)II etap reakcji: kondensacja cyklicznego aldehydu (5-hydroksymetylenofurfuralu, furfuralu) z dwoma cząsteczkami orcyny i utworzenie barwnego połączenia
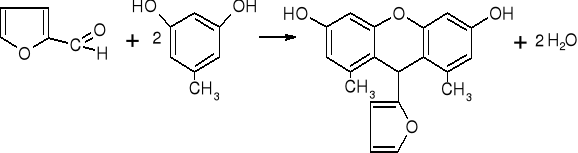
furfural orcyna barwny związek
5-hydroksy- orcyna barwny związek
metylenofurfural
Zasada działania:
Jest to reakcja pozwalająca na odróżnienie pentoz od heksoz, polegająca na odwodnieniu sacharydów pod wpływem 20% kwasu solnego (pochodzącego z roztworu orcyny), a następnie na powstaniu barwnego połączenia formy cyklicznego aldehydu (furfuralu dla pentoz,
5-hydroksymetylenofurfuralu dla heksoz) z orcyną w obecności katalizatora FeCl3. Z odczynnikiem tym w takim czasie ogrzewania (2-3 minuty) pentozy reagują dając morskie zabarwienie. Po dłuższym ogrzewaniu heksozy mogą również ulec tej reakcji.
2.2. Właściwości redukujące sacharydów:
2.2.1. Próba Fehlinga:
Odczynnik: odczynnik Fehlinga I i II
Wykonanie:
Do pięciu probówek wlaliśmy po 1 cm3 roztworów Fehlinga I i Fehlinga II. Następnie dodaliśmy po 1 cm3 roztworów: glukozy, fruktozy, maltozy, sacharozy i wody. Wstawiliśmy na kilka minut do wrzącej łaźni wodnej.
Obserwacje:
Tabela nr 5: Obserwacje z próby Fehlinga
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji roztworów Fehlinga I i II, a następnie ogrzaniu we wrzącej łaźni wodnej przez około 2 minuty |
2% roztwór glukozy |
wytrącił się czerwony osad |
2% roztwór fruktozy |
wytrącił się czerwony osad |
2% roztwór maltozy |
wytrącił się czerwony osad |
2% roztwór sacharozy |
brak efektu (osadu) |
woda |
brak efektu (osadu) |
Wnioski:
Cukier wykazuje właściwości redukujące, kiedy posiada wolną grupę aldehydową lub ketonową, czyli w sytuacji kiedy występuje w formie łańcuchowej. Tam gdzie znajdował się roztwór glukozy, fruktozy i maltozy wytrącił się czerwony osad tlenku miedzi (I). Znaczy to, że cukry te (monosacharydy) wykazują właściwości redukujące. Natomiast disacharyd - sacharoza o zablokowanych grupach aldehydowej i ketonowej poprzez wiązanie glikozydowe oraz woda właściwości takich nie posiadają.
Reakcja:
Zasada działania:
Jest to reakcja oparta na tym, że cukier posiadający wolna grupę ketonową, bądź aldehydową wykazuje właściwości redukujące (jedynie w środowisku zasadowym, kiedy jest w formie łańcuchowej). W tym przypadku jeśli mamy do czynienia z cukrem redukującym to zawarte w odczynniku Fehlinga I jony Cu2+ redukują się (za sprawą grupy aldehydowej lub ketonowej pochodzącej z cukru redukującego) i wytracają w postaci czerwonego osadu tlenku miedzi (I). Odczynnik Fehlinga II ma za zadanie zapewnić środowisko zasadowe. Cukier natomiast utlenia się do kwasu onowego, uronowego lub cukrowego.
2.3. Wpływ zasad na sacharydy:
2.3.1. Próba Moore'a:
Odczynnik: 20% NaOH
Wykonanie:
Do pięciu probówek wlaliśmy po 1 cm3 stężonego 20% NaOH. Następnie dodaliśmy po 1 cm3 roztworów glukozy, sacharozy, maltozy, skrobi i wody. Wstawiliśmy na kilka minut do wrzącej łaźni wodnej i obserwowaliśmy zmiany zabarwienia.
Obserwacje:
Tabela nr 6: Obserwacje z próby Moore'a
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu 20% NaOH, a następnie ogrzaniu we wrzącej łaźni wodnej przez około 3 minuty |
2% roztwór glukozy |
przybiera barwę jasnokarmelową |
2% roztwór sacharozy |
brak efektu (pozostaje bezbarwny) |
2% roztwór maltozy |
przybiera barwę karmelową |
2% roztwór koloidalny skrobi |
przybiera barwę żółtawą |
woda |
brak efektu (pozostaje bezbarwny) |
Wnioski:
Roztwory glukozy i maltozy zabarwiły się na karmelowo, a więc pod wpływem stężonej zasady (20% NaOH) ich łańcuchy zostały rozerwane na krótsze fragmenty (di-, tri-, tetra węglowe), które to mogły ulegać polimeryzacji (kondensacji) dając brunatne, karmelowe zabarwienie. Sacharoza reakcji tej nie uległa, gdyż jest disacharydem nieredukującym o zablokowanej grupie aldehydowej i ketonowej poprzez wiązanie glikozydowe i nie działa na nią stężona zasada. Skrobia, polisacharyd ma również w znacznej większości zablokowane grupy aldehydowe poprzez wiązania glikozydowe, więc nie wykazuje właściwości redukujących i nie działa na nią stężona zasada (20% NaOH).
Zasada działania:
Polega ona na tym, że w obecności stężonych zasad forma łańcuchowa sacharydu redukującego ulega rozerwaniu w wyniku enolizacji pod wpływem zasady, a następnie ruchu elektronów w łańcuchu i przemieszczeniu się wiązania podwójnego. Dzięki temu powstają krótsze łańcuchy di-, tri-, tetrawęglowe - mieszanina zupełnie innych związków - które to ogrzewane ulegają kondensacji (polimeryzacji) - roztwór zabarwia się na karmelowo (brunatno).
2.4 Disacharydy. Rozróżnianie monosacharydów od disacharydów redukujących:
2.4.1 Próba Barfoeda:
Odczynnik: odczynnik Barfoeda
Wykonanie:
Do dwóch probówek wlaliśmy po 2,5 cm3 odczynnika Barfoeda, następnie dodaliśmy po 0,5 cm3 roztworów: glukozy, maltozy i sacharozy. Wstawiliśmy do wrzącej łaźni wodnej i obserwowaliśmy w ciągu 15 minut w jakim czasie pojawi się czerwony osad tlenku miedzi (II).
Obserwacje:
Tabela nr 7: Obserwacje z próby Barfoeda
Badana substancja: |
Zaobserwowany efekt reakcji po dodaniu do roztworu badanej substancji odczynnika Barfoeda, a następnie ogrzewaniu we wrzącej łaźni wodnej |
2% roztwór glukozy |
po około 0,5 minucie wytrącił się czerwony osad |
2% roztwór maltozy |
po około 10 minutach wytrąca się czerwony osad |
2% roztwór sacharozy |
po około 15 minutach brak efektu reakcji (osadu) |
Wnioski:
Glukoza jest redukującym monosacharydem, a maltoza redukującym disacharydem ponieważ z roztworu glukozy osad tlenku miedzi (I) wytrącił się o wiele szybciej. Sacharoza nie jest cukrem redukującym, bo ma zablokowane grupy aldehydową i ketonową poprzez wiązanie glikozydowe, co potwierdza brak osadu.
Reakcja:
Zasada działania:
W odczynie Barfoeda redukcję kationów Cu+2 do Cu+ przeprowadza się w środowisku słabo kwaśnym. W tych warunkach reakcja redukcji przebiega wolniej niż w środowisku zasadowym. Szybkość reakcji z udziałem monosacharydów różni się od szybkości reakcji z udziałem disacharydów redukujących. Monosacharydy dają dodatni wynik odczynu wkrótce po ogrzaniu mieszaniny reakcyjnej, natomiast disacharydy redukujące dopiero po dłuższym ogrzewaniu.
2.5 Polisacharydy:
2.5.1 Reakcja skrobi z jodem:
Odczynnik: J2 w KJ, 1M NaOH
Wykonanie:
Do 2 cm3 roztworu koloidalnego skrobi dodaliśmy kroplę J2 w KJ. Zaobserwowaliśmy barwę roztworu, następnie próbę ogrzaliśmy, po raz kolejny zaobserwowaliśmy barwę roztworu. Na koniec ochłodziliśmy próbę i również zaobserwowaliśmy barwę roztworu.
Do 2 cm3 roztworu koloidalnego skrobi dodaliśmy kilka kropli 1M NaOH i kroplę J2 w KJ. Zaobserwowaliśmy barwę roztworu, a następnie zakwasiliśmy roztwór rozcieńczonym kwasem solnym.
Obserwacje:
po dodaniu I2/KI do roztworu skrobi pojawia się niebieskie zabarwienie, po ogrzaniu roztworu zabarwienie znika, roztwór staje się bezbarwny, natomiast po jego ochłodzeniu niebieskie zabarwienie powraca
po dodaniu I2/KI do roztworu skrobi i kilku kropel NaOH nie pojawia się niebieskie zabarwienie, roztwór jest bezbarwny po zakwaszeniu roztworu kwasem solnym niebieskie zabarwienie pojawia się
Wnioski:
Podczas ogrzewania skrobi jej helisa pochodząca z amylozy rozkręca się i jod cząsteczkowy nie ma gdzie się zagnieździć, niebieskie zabarwienie zanika. Po ochłodzeniu roztworu helisa skrobi z powrotem skręca się i zabarwienie powraca.
Jeśli dodajemy I2/KI do roztworu skrobi z zasadą, zasada reaguje z jodem według reakcji:
I2 + 2NaOH →NaIO + NaI + H2O
Brak jest cząsteczkowego jodu w roztworze, natomiast jod w postaci jonowej ma zbyt małą cząsteczkę, która przelatuje prze helisę skrobi nie zagnieżdżając się w niej, a skoro nie ma co osiąść na helisie - zabarwienie nie pojawia się. Po dodaniu kwasu solnego wodorotlenek sodu zostaje usunięty (bierze udział w reakcji zobojętniania, powstaje chlorek sodu), a więc jod wraca do formy cząsteczkowej i niebieskie zabarwienie powraca.
Zasada działania:
Amyloza tworzy kompleks z jodem o barwie niebieskiej, którą zawdzięcza temu, że ma strukturę uporządkowanej helisy, z pustym wnętrzem wypełnionym jodem. Zabarwienie nie jest wynikiem reakcji chemicznej, lecz skutkiem uwięzienia (wiązaniami koordynacyjnymi) cząsteczek jodu wewnątrz helisy. Jod wewnątrz helisy znajduje się w odmiennym otoczeniu niż w roztworze i ma inną barwę. Barwa wynika z ruchu elektronów wzdłuż łańcucha cząsteczek jodu, wypełniającego wnętrze helisy amylozy oraz z pochłaniania światła przez cały kompleks. Natomiast podczas ogrzewania helisa amylozy rozwija się, skutkiem zerwania wiązań wodorowych, uwalniając uwięziony jod i barwa zanika. Amylopektyna z jodem daje barwę fioletowo-czerwoną. Natomiast skrobia z jodem daje zabarwienie fioletowo-niebieskie.
2.5.3 Odróżnianie bibuły od papieru gazetowego:
Odczynnik: 2% etanolowy roztwór floroglucyny, stężony HCl
Wykonanie:
Kawałki papieru gazetowego i bibuły zwilżyliśmy kroplą 2% roztworu floroglucyny i kroplą stężonego HCl. Porównaliśmy uzyskane barwne plamy.
Obserwacje:
bibuła zwilżona floroglucyną i stężonym HCl pozostaje bezbarwna
papier zwilżony floroglucyną i stężonym HCl barwi się na kolor buraczkowo - czerwony
Wnioski:
Bibuła zawiera samą celulozę: polisacharyd o bardzo zwięzłej przestrzennej budowie (zbudowana z cząsteczek glukozy połączonych wiązaniami β-glikozydowymi), która uniemożliwia zadziałanie kwasu na poszczególne zawarte w niej cząsteczki glukozy, natomiast papier gazetowy oprócz celulozy musi zawierać jeszcze inne sacharydy, które ulegają odwodnieniu do cyklicznych aldehydów (furfuralu, 5-hydroksymetylenofurfuralu) i tworzą barwne połączenie z pochodną fenolową (floroglucyną).
Zasada działania:
Reakcja ta umożliwia poznanie składu papieru gazetowego i bibuły poprzez wykrycie sacharydów, o nie zablokowanych wiązaniami glikozydowymi grupach aldehydowych lub ketonowych. Sacharydy te odwodnione przez stężony kwas solny przechodzą w cykliczne aldehydy (furfural dla pentoz, 5-hydroksymetylenofurfural dla heksoz), które to tworzą barwne połączenia z floroglucyną (pochodną fenolową).
Bibuła zawiera samą celulozę, a papier gazetowy zawiera domieszki innych sacharydów.
Indywidualne zadania kontrolne:
3.1 Kasi Kędzierskiej nr 5:
Odczyn Molisha z α-naftolem: przeprowadzam ogólną reakcję wstępną na wykrycie sacharydów
Do 1 cm3 badanego roztworu dodałam 2 krople roztworu α - naftolu i wymieszałam. Następnie po ściance przechylonej probówki wlałam ostrożnie 1 cm3 stężonego kwasu siarkowego (nie mieszając).
pojawiła się ciemno fioletowa obrączka
stwierdzam, że w otrzymanym roztworze są sacharydy
Próba Seliwanowa: przeprowadzam reakcję na wykrycie ketoz
Do probówki wlałam 1 cm3 badanego roztworu. Następnie dodałam 2 cm3 roztworu HCl (rozc. 1:1) i 1 kroplę roztworu rezorcyny. Wstawiłam na kilka minut do wrzącej łaźni wodnej.
roztwór nie zabarwił się, pozostał bezbarwny, brak efektu reakcji
stwierdzam, że w roztworze nie ma ketoz (to nie fruktoza ani sacharoza), czyli są aldozy
Reakcja Biala: przeprowadzam reakcję na wykrycie pentoz
Do probówki wlałam 0,5 cm3 badanego roztworu. Następnie dodałam 2 cm3 roztworu orcyny i kroplę roztworu FeCl3. Wstawiłam na kilka minut do wrzącej łaźni wodnej.
roztwór nie zabarwił się, pozostał bezbarwny, brak efektu reakcji
stwierdzam, że nie mam w roztworze pentoz (to nie arabinoza), ale mogą być heksozy
Próba Barfoeda: przeprowadzam reakcję na odróżnienie monosacharydów od disacharydów redukujących
Do probówki wlałam 2,5 cm3 odczynnika Barfoeda, następnie dodałam 0,5 cm3 badanego roztworu. Wstawiłam do wrzącej łaźni wodnej i obserwowałam w ciągu 15 minut w jakim czasie pojawi się czerwony osad tlenku miedzi (II).
osad nie wytrącił się po 10 minutach
stwierdzam, że nie mam w roztworze monosacharydów (czyli to nie glukoza) zatem mam maltozę (disacharyd).
Wyszukiwarka