TEST: Budowa atomu (wersja I)
Każde zadanie ma tylko jedną poprawną odpowiedź. Należy ją wybrać.
1. Niżej podano kilka cech, które można przypisać cząstce elementarnej:
A. występuje w jądrze atomowym,
B. występuje w powłoce elektronowej,
C. ma dodatni ładunek elektryczny,
D. ma ujemny ładunek elektryczny,
E. nie ma ładunku elektrycznego,
F. ma masę około 1 u,
G. ma masę około u.
Protonowi można przypisać cechy:
a) A, C, F c) A, D, G
b) B, D, G d) A, E, F
2. Z zapisu 17 Cl wynika, że atom chloru zawiera:
a) 17 protonów, 17 elektronów, 35 neutronów;
b) 17 protonów, 35 elektronów, 17 neutronów;
c) 35 protonów, 17 elektronów, 17 neutronów;
d) 17 protonów, 17 elektronów, 18 neutronów.
3. Hipoteza de Broglie'a mówi, że:
a) atom w stanie podstawowym ma jak największą liczbę elektronów niesparowanych;
b) elektron ma dwoistą naturę korpuskularno-falową;
c) atomy o jednakowej liczbie protonów są atomami tego samego pierwiastka;
d) nie można równocześnie określić położenia i pędu elektronu.
4. Orbital atomowy jest to:
a) matematyczna funkcja falowa ψ (psi) opisująca stan elektronu w atomie,
b) magnetyczna liczba kwantowa,
c) tor, po jakim porusza się elektron,
d) główna liczba kwantowa.
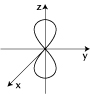
5. Rysunek obok przedstawia kształt orbitalu:
a) s
b) px
c) pz
d) py
6. Zapis: 1s22s22p2 przedstawia konfigurację elektronową atomu:
a) węgla,
b) azotu,
c) berylu,
d) chloru.
7. Masa cząsteczkowa kwasu siarkowego(VI) wynosi:
a) 98 g
b) 100 u
c) 98 u
d) 7 g
8. Izotopy są to:
a) zbiory atomów o takiej samej liczbie nukleonów;
b) zbiory atomów o takiej samej liczbie atomowej, lecz różniące się liczbą masową;
c) zbiory atomów o takiej samej liczbie protonów w jądrze, lecz różniące się liczbą neutronów;
d) dwie odpowiedzi są poprawne.
9. Poprawny graficzny zapis konfiguracji elektronowej atomu magnezu ma postać:
a) 1s 2s 2p 3s
b) 1s 2s 2p 3s
c) 1s 2s 2p 3s
d) 1s 2s 2p 3s
10. Promieniowanie α posiada następujące właściwości:
a) są to jądra helu poruszające się z prędkością około 20 000 ,
b) są to cząstki o masie u,
c) są to cząstki nieposiadające ładunku elektrycznego,
d) jest to promieniowanie elektromagnetyczne o bardzo dużej przenikliwości energii.
11. Która para nuklidów stanowi izotopy tego samego pierwiastka?
a) E i E
b) E i E
c) E i E
d) E i E
12. Izotop radu Ra ulega przemianie α. Powstaje wówczas izotop:
a) Ra
b) Pb
c) Rn
d) Pb
13. Liczba stanów kwantowych w podpowłoce p trzeciej powłoki wynosi:
a) 18 c) 2
b) 10 d) 6
14. Atom siarki ma następującą konfigurację elektronową: 1s22s22p63s23p4.
Elektrony walencyjne atomu siarki znajdują się na orbitalach:
a) tylko 3p
b) 2p, 3s i 3p
c) 3s i 3p
d) tylko 3s
15. „Krążący po orbicie elektron nie pobiera ani nie wysyła energii, natomiast emisja lub absorpcja promieniowania zachodzi dopiero podczas przejścia elektronu na inną orbitę”. Zdanie to stanowi jedno z podstawowych założeń:
a) teorii budowy atomu E. Rutherforda,
b) teorii budowy atomu N.H. Bohra,
c) zasady nieoznaczoności Heisenberga,
d) zakazu Pauliego.
16. Okres połowicznego rozpadu pewnego promieniotwórczego pierwiastka wynosi 5 dni, a jego masa początkowa wynosi 16 g. Po 15 dniach pozostanie:
a) 2 g pierwiastka,
b) 14 g pierwiastka,
c) 8 g pierwiastka,
d) 4 g pierwiastka.
17. Który zbiór atomów i jonów ma jednakową konfigurację elektronową?
a) Mg2+, S2-, Li
b) K+, Br-, Na
c) Cl-, As3+, Kr
d) Mg2+, Na+, Ne
18. Który z poniższych zapisów prawidłowo przedstawia konfigurację elektronową atomu skandu 21Sc?
a) 1s22s22p63s23p63d14s1
b) 1s22p63s23p64s23d1
c) 1s22s22p63s23p64s23d1
d) 1s22s22p63s23p63d24s1
19. Bor jest mieszaniną 81% izotopu 11B i 19% 10B. Średnia masa atomowa boru wynosi:
a) 11,81 u c) 16 u
b) 10,81 u d) 20 u
20. Pierwiastek promieniotwórczy AZ E wyemitował dwie cząstki α i cząstkę β-. Końcowym produktem tej przemiany promieniotwórczej jest pierwiastek:
a) E c) E
b) E d) E
1
1840
35
km
s
1
1840
A-4
Z-1
A-8
Z-3
A-8
Z-2
A-4
Z-4
12
6
14
7
109
47
107
47
50
24
24
12
24
12
23
11
223
88
219
88
223
82
219
86
219
82
Wyszukiwarka