Równowagi kompleksowania w roztworach
Rozważamy reakcje tworzenia związków kompleksowych w roztworach.
Kompleksem (związkiem koordynacyjnym) nazywamy taki związek, w którym występuje wiązanie koordynacyjne, a więc związane z uwspólnieniem pary elektronowej pochodzącej w całości od donora (liganda).
Akceptorami par elektronowych są metale i ich jony (zwłaszcza metale grup przejściowych) zwane dalej atomami (jonami) centralnymi; donorami (ligandami) są jony lub cząsteczki, często organiczne, np. H2O, NH3, aminy, kwasy karboksylowe.
Tak więc tworzenie się związku kompleksowego związane jest z przeniesieniem (przyłączeniem) całych związków chemicznych lub jonów wieloatomowych. Są to reakcje równowagowe polegające na przeniesieniu cząsteczek lub grup atomów.
Tworzenie związków kompleksowych
Liczba par elektronowych jaką przyjmuje jon (atom) centralny nazywa się liczbą koordynacji. Np. jony Cu+2 z amoniakiem jako ligandem mają liczby koordynacji 1, 2, 3 i 4. Oznacza to, że w roztworze wodnym tworzenie kolejnych kompleksów stanowi serię reakcji następczych:
Cu+2 + NH3 [Cu(NH3)]+2
[Cu(NH3)]+2 + NH3 [Cu(NH3)2]+2
[Cu(NH3)2]+2 + NH3 [Cu(NH3)3]+2
[Cu(NH3)3]+2 + NH3 [Cu(NH3)4]+2
które opisywane są kolejnymi stałymi tworzenia:
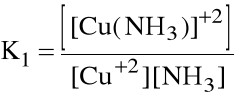
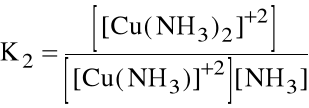
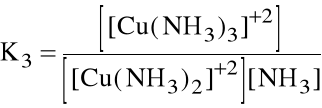
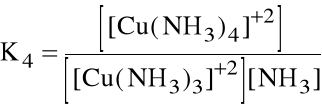
Niekiedy wygodniej jest operować sumaryczną stałą tworzenia danego kompleksu, zwaną stałą trwałości kompleksu:
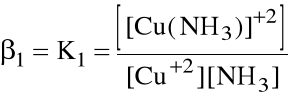
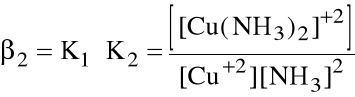
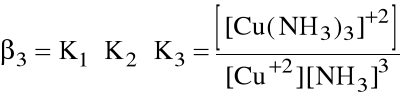
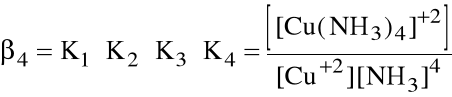
ogólnie:
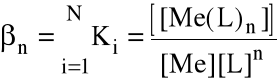
Stałe trwałości są stablicowane, zwykle w postaci ich logarytmów dziesiętnych (logi).
|
Niektóre związki kompleksowe tworzą się bezpośrednio (bez kompleksów pośrednich), np.:
kompleks cyjankowy żelaza(II), [Fe(CN)6]-4 (log6=24)
kompleks cyjankowy żelaza(III), [Fe(CN)6]-3 (log6=36)
kompleks cyjankowy niklu(II), [Ni(CN)4]-2 (log4=31.3)
kompleks cyjankowy cynku(II), [Zn(CN)4]-2 (log4=16.7)
Przykład:
Obliczyć stężenie wolnych (niezwiązanych w kompleks) jonów żelaza w 0.01 M roztworze K3[Fe(CN)6].
Jest to sól, a więc dysocjuje całkowicie. Aniony [Fe(CN)6]-3 ulegają częściowej dysocjacji:
[Fe(CN)6]-3 Fe+3 + 6CN-
zaś stała równowagi tej reakcji jest równa
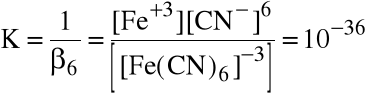
Mała wartość tej stałej oznacza, że reakcja zachodzi w małym stopniu. Można więc przyjąć, że [Fe(CN)6]-30.01 M. Oczywiście [Fe+3]=6.[CN-]. Tak więc rozwiązujemy równanie
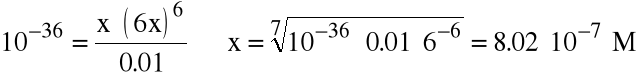
|
Szczególnie przydatne bywają wzory na ułamki molowe form metalu (wyprowadzone wprost z wyrażeń na stałe tworzenia).
Jeżeli metal w roztworze może istnieć w postaciach z 0, 1, 2, ..., n przyłączonymi ligandami, to ułamek i mówi, jaka jego część (molowo) związana jest w kompleks z i ligandami. Oczywiście 0 + 1 + ... + n = 1.
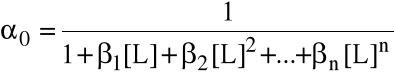
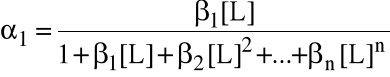
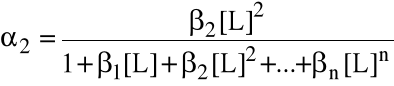
...............................
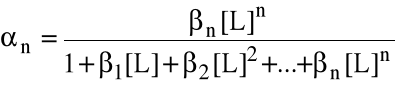
Wzory te są przydatne wtedy, gdy równowagowe stężenie liganda jest znane.
Przykład:
Oblicz równowagowe stężenie wolnego metalu, jeśli w 1 dm3 roztworu Cd(NO3)2 o stężeniu 0.001 M rozpuścimy 0.1 mola KCN. (log1=5.5, log2=10.6, log3=15.3, log4=18.9).
Nadmiar jonów cyjankowych w stosunku do metalu jest tak duży, że możemy przyjąć, że [CN-]=0.1 M. Wówczas
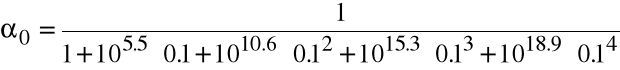
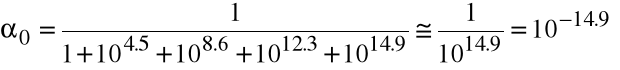
Całkowite stężenie metalu wynosi 0.001 M, więc [Cd+2] = 0.c0 = 10-17.9 1.26.10-18 M.
Zauważmy, że we wzorach na ułamki molowe form mianownik jest zawsze taki sam, zaś licznikiem są kolejne składniki sumy stanowiącej mianownik, odpowiadające poszczególnym formom metalu. Ich obliczenie pozwala więc, bez dalszych obliczeń, oszacować rozkład form metalu (np. stwierdzić, która przeważa).
Wpływ pH na tworzenie się związków kompleksowych
Wiele ligandów to słabe zasady: NH3, CN-, reszty kwasów karboksylowych. Oznacza to, że w roztworze wodnym ulegają one reakcji hydrolizy, która przesuwa równowagę tworzenia kompleksów (bowiem z układu ubywa formy będącej ligandem).
Jeżeli znamy równowagowe stężenie jonów H+ w układzie, można zastosować wzór
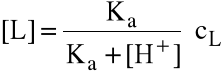
gdzie cL - całkowite stężenie ligandu, Ka - stała dysocjacji kwasowej kwasu sprzężonego z ligandem-zasadą.
Łatwo zauważyć, że w takich wypadkach obniżanie pH powoduje osłabienie kompleksujących własności ligandów.
Diagramy
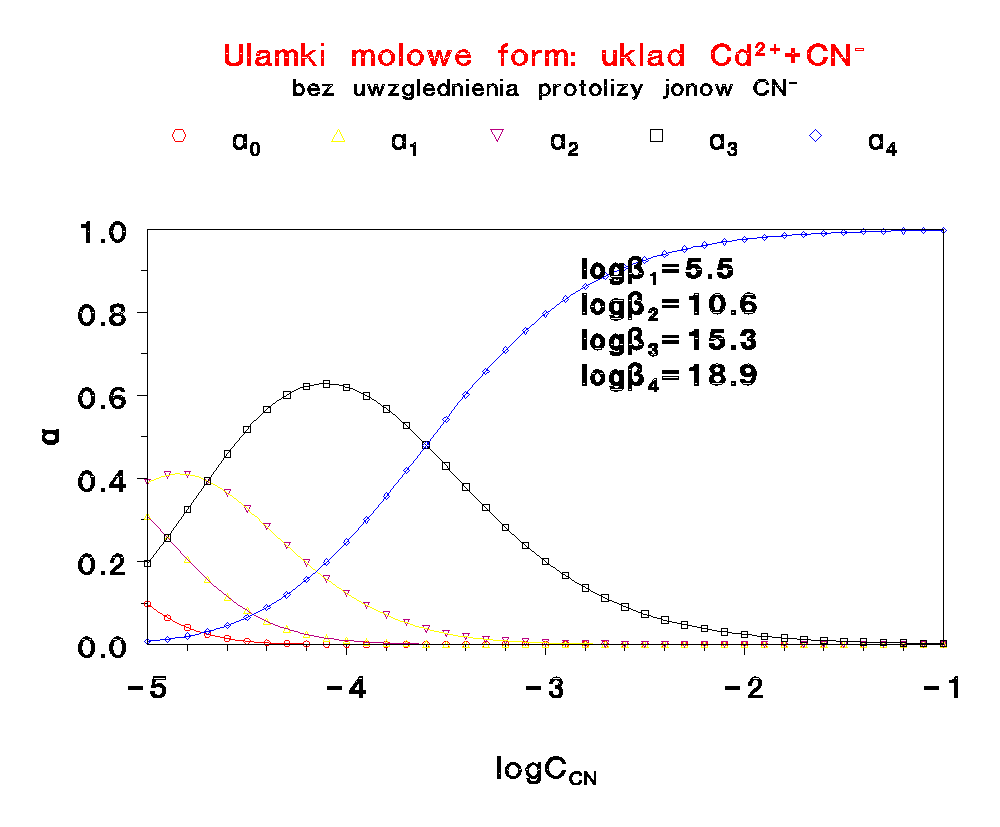
Jest to typowy diagram, pozwalający określić niezbędny nadmiar liganda, potrzebny do tego, żeby w roztworze znajdował się przede wszystkim właściwy kompleks. Jak widać nie dla każdego kompleksu jest to mozliwe.
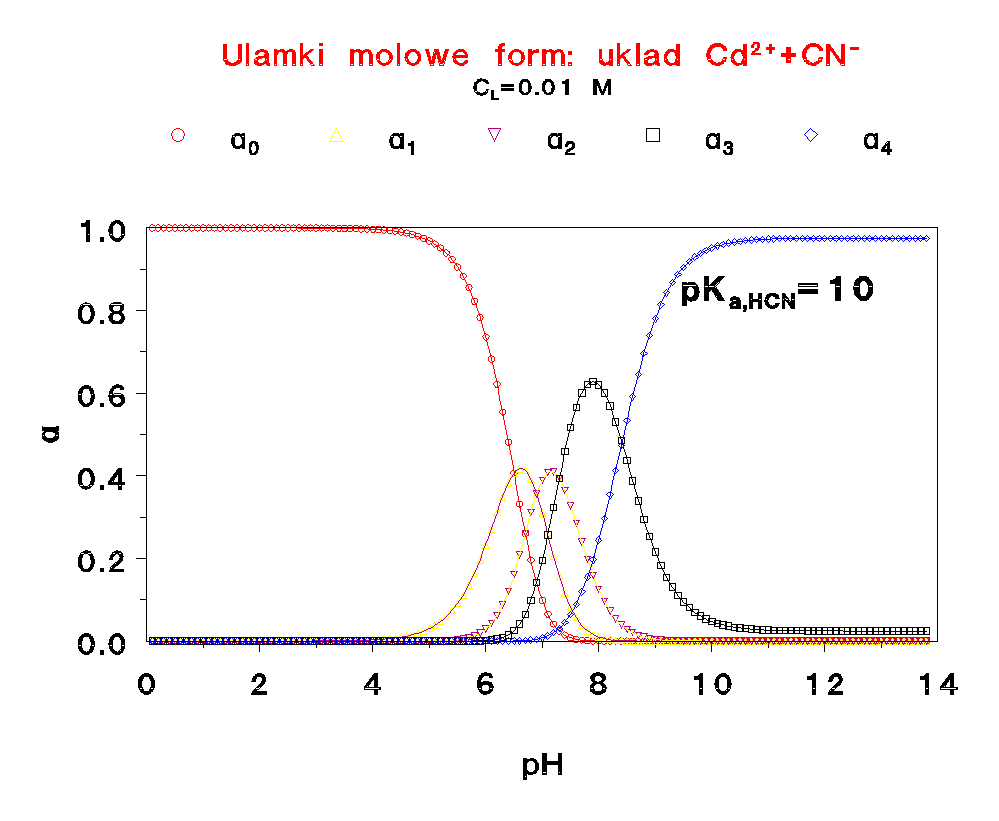
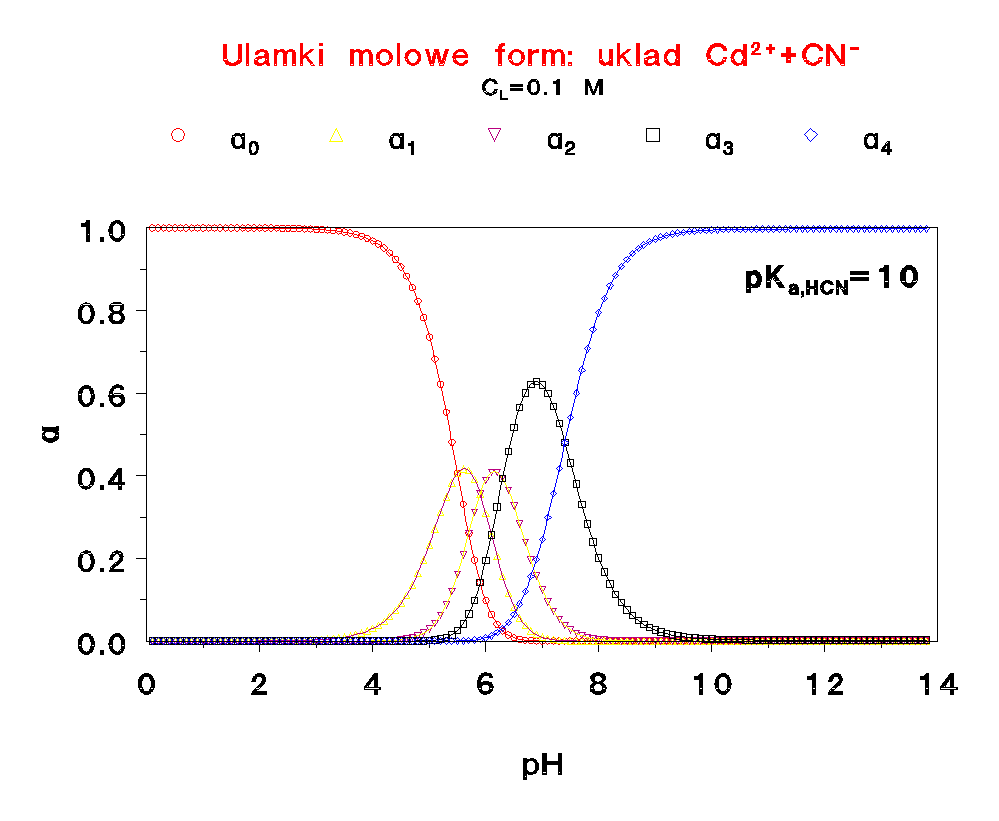
Jak widać, zmiana stężenia liganda niewiele wpływa na rozkład form w funkcji pH.
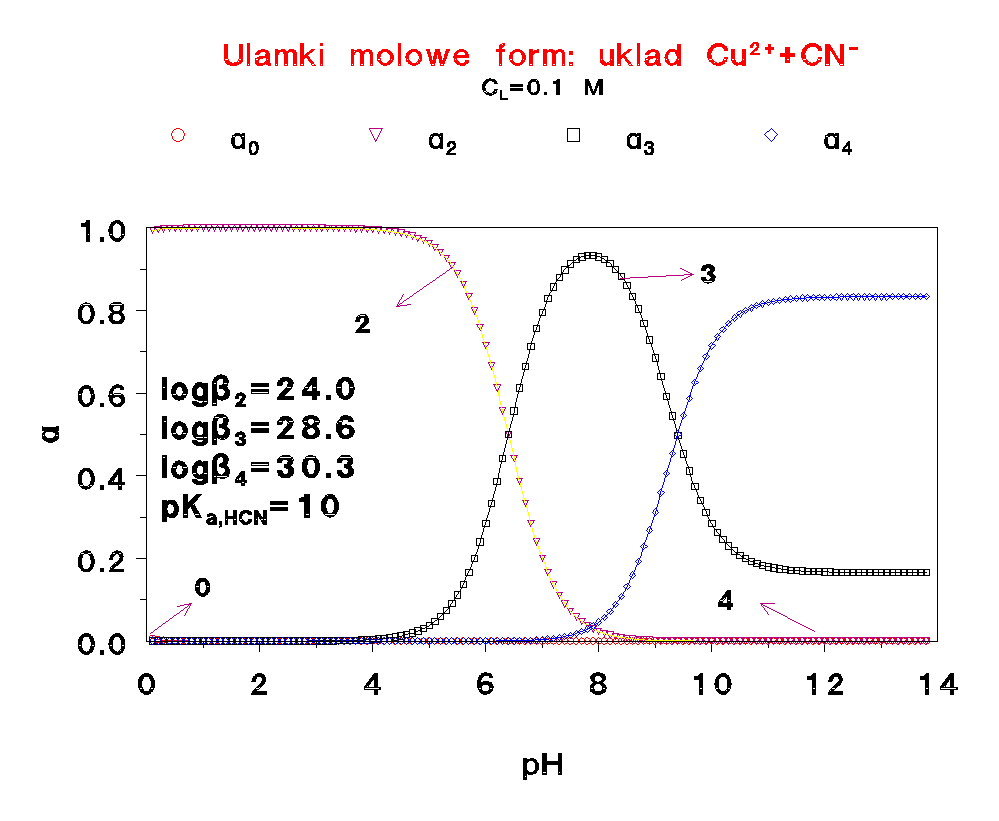
Proszę porównać te rozkłady z odpowiednim wykresem dla kadmu. Są zupełnie różne.
J.Gliński, wykład 18, p. 4
Wyszukiwarka