1. We wzorze na współczynnik lotności Φi wyprowadzonym z równania stanu SRK objętość fazy dla której liczymy te współczynnik jest liczona:
a) z równania Rackett'a
b) z równania Clapeyrona
c) z równania SRK
d) jako odwrotność gęstości wyliczanej z równania bibliotecznego Chemcada
Aby policzyć ![]()
należy:
- obliczyć a i b z równań (C), (D) i (E)
- obliczyć objętość z równania stanu
- zastosować wzór (F)
2. Jeżeli wybierzemy równanie stanu SRK jako model obliczania globalnej stałej równowagi fazowej K to:
a) KC jest liczone ze wzoru
b) KC jest liczone ze wzoru
c) KC jest liczone ze wzoru
(PSi = prężność pary nasyconej składników)
d) KC jest liczone ze wzoru
Obecnie do opisu lotności fazy gazowej i ciekłej przy ciśnieniach podwyższonych stosuje się równania stanu. To samo równanie dla obu faz.
![]()
![]()
![]()
![]()
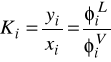
W roku 1972 Włoch Georgio Soave zmodyfikował powyższe równanie i w ten sposób powstało równanie Soave-Redlich-Kwong w skrócie SRK, które dzisiaj jest standardem.
ChemCad zgłasza się z tym równaniem jako domyślną opcją termodynamiczną jeżeli ciśnienie jest podwyższone, lub co najmniej jeden składnik jest w stanie nadkrytycznym.
3. Do obliczania stałej równowagi fazowej K używamy równań stanu w miejsce metod Φ - γ
gdy:
a) ciśnienie jest bliskie atmosferycznemu
b) ciśnienie jest podwyższone
c) w rozpatrywanej mieszaninie występują substancje w stanie nadkrytycznym
d) w rozpatrywanej mieszaninie występują tylko substancje w stanie podkrytycznym
Metody ![]()
(inna nazwa oparte na nadmiarowym potencjale) są dokładne i powszechnie stosowane dla przypadków, gdy ![]()
.
4. Schemat technologiczny zawiera separator do rozdziału mieszaniny węglowodorów C7- C8 (?) w temperaturze 10 ºC pod ciśnieniem 30 barów. Jakiego modelu użyjesz do obliczenia entalpii
a) opartego na równaniu stanu SRK
b) AMINE nie-do absorpcji gazów kwaśnych w aminach
c) opartego na prawie Henry'ego
d) LATENT HEAT (ciepła utajonego) nie-pomija wpływ ciśnienia na entalpię
ChemCad ma 12 opcji do obliczania entalpii. Należą one generalnie do dwóch grup modeli:
- latent heat (ciepło utajone) pomija wpływ ciśnienia na entalpię
- modele oparte na równaniach stanu - uwzględniają wpływ ciśnienia na entalpię.
Entalpia
ChemCad oblicza entalpię jednym z dwóch poniższych sposobów:
1) Wykorzystując równanie stanu (metoda EOS)
2) Wykorzystując metodę ciepła utajonego (LATENT HEAT)
Metoda EOS bierze pod uwagę odchylenia entalpii od zachowania gazu doskonałego ze wzrostem ciśnienia. Metoda LATENT HEAT pomija to zjawisko.
Wyjątki od dwóch powyższych metod:
- do obliczania entalpii H2O stosuje się tabele pary wodnej
- do absorpcji gazów kwaśnych (H2S, CO2) w aminach przygotowana jest specjalna procedura (AMINE), której szczegóły są ukryte.
- użytkownik może wprowadzić własne wartości entalpii w postaci tabel lub wielomianów
- istnieje możliwość wczytania i wykorzystania ciepeł rozpuszczania
- jeżeli oblicza się tylko bilanse masowe - obliczenia entalpii mogą być pominięte
Ponieważ nie istnieją bezwzględne wartości entalpii, a obliczamy jedynie różnice - to stanem odniesienia jest entalpia tworzenia w temperaturze 298,15 K. Dla metody EOS fazy gazowej, dla metody LATENT HEAT przeważnie cieczy.
Wyznaczanie entalpii z równań stanu
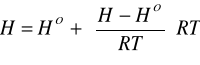
H- entalpia strumienia w temperaturze T
![]()
- entalpia gazu doskonałego w temperaturze T
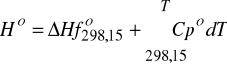
![]()
a - f - współczynniki do obliczania zależności standardowego ciepła molowego od temperatury. Znajdują się w banku danych
![]()
- standardowa entalpia tworzenia w 298,15 K (stan gazu doskonałego). (Też znajduje się w banku danych).
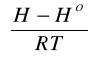
- funkcja ujmująca odchylenie entalpii od zachowania gazu doskonałego liczona z równania stanu.
Przykładowo dla równania SRK:
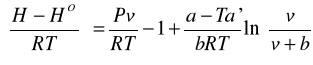
gdzie:
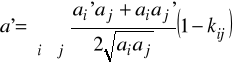
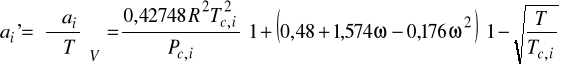
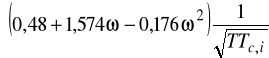
5. Parametr rozpuszczalności:
a) jest obliczany poprzez regresję danych eksperymentalnych równowagi ciecz - ciecz
b) jest obliczany poprzez regresję danych eksperymentalnych równowagi ciecz - ciało stałe
c) jest używany jako model roztworu regularnego
d) może być policzony gdy znamy standardową entalpię parowania składnika i jego gęstość
Model roztworu regularnego - pseudoskladniki
W roztworze regularnym niedoskonałość jest spowodowana wyłącznie czynnikiem energetycznym.
![]()
![]()
![]()
Teorię roztworu regularnego opracowali Hildebrand i Scatchard. Aby wyprowadzić wzór na ![]()
założyli:
1 ) Mieszające się ciecze mogą być opisane równaniem van-der-Waalsa o współczynnikach ![]()
i ![]()
.
2 ) Dla mieszaniny ![]()
Bazując na tych założeniach wyprowadzili wzór na energię kohezji - to znaczy część molowej energii wewnętrznej odpowiadającą energii oddziaływań międzycząsteczkowych.
Wprowadzono definicję parametru rozpuszczalności ![]()
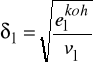
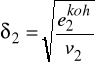
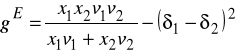
Zróżniczkowanie ![]()
względem ![]()
oraz rozszerzenie na układy wieloskładnikowe prowadzi do wzorów:
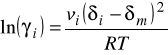
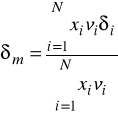
![]()
- parametr rozpuszczalności czystego składnika i
Model Graysona - Streeda
Stosuje się go do niepolarnych węglowodorów, a zwłaszcza do frakcji naftowych reprezentowanych przez „pseudoskładniki”.
Ciekłe roztwory węglowodorów są tutaj traktowane jako roztwory regularne
Współczynniki aktywności ![]()
w roztworze ciekłym oblicza się przy wykorzystaniu „parametrów rozpuszczalności” ![]()
- tak jak to było realizowane w modelu roztworu regularnego.
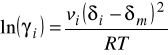
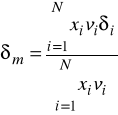
Każdy pseudoskładnik musi mieć obliczony parametr rozpuszczalności oraz zdefiniowane współczynniki pozwalające obliczać objętość molową ![]()
w funkcji temperatury.
6. Reaktor Gibbsa:
a) oblicza skład produktu na podstawie stałych równowagi chemicznej zdefiniowanych reakcji
b) oblicza skład produktu na podstawie minimalizacji potencjału termodynamicznego całego układu
c) oblicza równowagę ciecz - para w oparciu o sześcienne równania stanu
d) oblicza równowagę ciecz - para w oparciu o równanie Uniquac
Reaktor Gibbsa
Jest to reaktor , który oblicza skład mieszaniny poreakcyjnej zakładając, że w układzie jest osiągana równowaga chemiczna.
Obliczenia równowagi chemicznej mogą opierać się na wyszczególnieniu niezależnych reakcji chemicznych i uwzględnieniu faktu, że stała równowagi każdej z tych rekacji musy być zachowana. Jednakże istnieje inna metoda obliczania równowag chemicznych, która bazuje na generalnym kryterium równowagi chemicznej, które mówi, że w stani równowagi potencjał termodynamiczny całej mieszaniny osiaga minimum. Potencjal termodynamiczny nazywany jest też SWOBODNĄ ENERGIĄ GIBBSA- stąd nazwa tego reaktora.
7. Poprawkę na asocjację w fazie parowej należy użyć dla układów zawierających:
a) węglowodory aromatyczne
b) alkohole
c) HF
d) cykloparafiny
Dodatkowe podopcje w ramach definiowania stałej równowagi fazowej K.
- Vapor phase association (asocjacja w fazie parowej)
…
ChemCad ma opcję „Vapor Phase Association”, którą powinno się zawsze uwzględniać, jeżeli przynajmniej jeden ze składników jest kwasem organicznym i stosujemy model oparty na współczynnikach aktywności.
Substancje asocjujące w fazie parowej.
Problem dotyczy kwasów organicznych i HF. Wtedy współczynniki ![]()
i ![]()
różnią się bardzo istotnie od 1 nawet pod bardzo niskimi ciśnieniami.
8. Przy obliczaniu równowag fazowych ciecz - para lub ciecz - ciecz pod ciśnieniami bliskimi atmosferycznemu współczynniki aktywności γi zależą od:
a) Ti, xi ( ułamek molowy w fazie ciekłej)
b) Pi, xi
c) Ti, yi ( ułamek molowy w fazie gazowej)
d) Ti, Pi, xi
Lotność w mieszaninie ciekłej - funkcje nadmiariowe
Obliczanie lotności z równania stanu ma prawie zawsze miejsce w przypadku fazy gazowej. Nie zawsze jest ono odpowiednie dla fazy ciekłej. Może okazać się zbyt mało dokładne dla tej fazy lub trzeba by było wprowadzić do równania stanu szereg współczynników aby tą dokładność zwiększyć. Wtedy stosuje się podejście alternatywne.
Technika polega na zdefiniowaniu roztworu doskonałego i na opisie odchyleń od tego roztworu poprzez funkcje nadmiarowe.
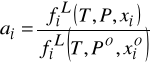
w skrócie 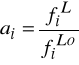
![]()
- odpowiednio ciśnienie i skład ustalone arbitralnie
![]()
- lotność składnika i w stanie standardowym
![]()
![]()
- współczynnik aktywności (ułamkowej)
![]()
(A)
Współczynniki aktywności ![]()
zależą od wyboru stanu standardowego. Ponieważ wybór ten jest arbitralny, to wygodnie jest tak zdefiniować ![]()
, aby współczynniki aktywności były bliskie jedności. (Kiedy są one dokładnie równe 1, to roztwór jest doskonały). Jednakże roztwór może być doskonały w sensie prawa Raoulta lub prawa Henry'ego.
Roztwór doskonały w sensie prawa Raoulta
![]()
, równanie (A) obowiązuje dla xi od 0 do 1, ![]()
Roztwór doskonały w sensie prawa Henry'ego
![]()
dla małego zakresu stężeń xi, ![]()
Tworzenie roztworu doskonałego odbywa się bez absorpcji lub wydzielania ciepła oraz bez zmiany objętości roztworu. W praktyce efekty te występują i mogą być opisane poprzez funkcje nadmiarowe.
9. Nasz układ zawiera kilka substancji reagujących ze sobą poprzez dwie reakcje równowagowe. Znamy stopnie konwersji dla obu tych reakcji. Jakiego reaktora należy użyć do zmodelowania tych reakcji?
a) Gibbsa
b) równowagowego z opcją approach fraction
c) równowagowego z opcją reaction conversion
d) stechiometrycznego
Reaktor równowagowy (equilibrium reactor)
Reaktor równowagowy daje możliwość symulowania zachowania się reaktora, w którym zachodzi wiele reakcji (do 20). Przy czym może on zakładać wyspecyfikowane przez użytkownika stopnie konwersji poszczególnych reakcji lub liczyć równowagi wszystkich tych reakcji.
Reaction conversion
Reaktor pracuje jak reaktor stechiometryczny, obliczając skład produktu na podstawie wyspecyfikowanych stopni konwersji i współczynników stechiometrycznych reakcji.
Approach fraction
Ułamek dojścia do stanu równowagi.
A + B = C + D
Jeżeli równowagowy stopień konwersji powyższej reakcji wynosi 0,6; to z jednego mola substancji A powstaje 0,6 mola C i 0,6 mola D. Jeżeli założymy, że approach fraction = 0,8 ( równowaga jest osiągnięta w 80%), to liczba moli substancji C i D na wyjściu z reaktora wynosi 0,6 . 0,8 = 0,48 mola.
Reaktor stechiometryczny (Stoichiomertic reaktor)
Ten typ reaktora modeluje 1 reakcję poprzez współczynniki stechiometryczne reakcji oraz ułamkowy stopień konwersji wskazanego składnika kluczowego - w stosunku do którego będzie obliczana konwersja.
Reaktor Gibbsa
Jest to reaktor, który oblicza skład mieszaniny poreakcyjnej zakładając, że w układzie jest osiągana równowaga chemiczna.
10. Poprawka Vapor fugacity/Poynting correction:
a) traktuje w obliczeniach gaz jako fazę niedoskonałą
b) traktuje w obliczeniach ciecz jako fazę niedoskonałą
c) ma zastosowanie gdy stałą równowagi fazowejK jest liczona z równania
d) ma zastosowanie gdy stałą równowagi fazowejK jest liczona z równania
1. Metody obliczania równowag fazowych ciecz - gaz oparte na równaniach stanu:
a) stanowią rozszerzenie prawo Raoulta dla niedoskonałych faz: gazowej i ciekłej
b) obliczają współczynniki lotności Φ w obu fazach z tego samego równania stanu
c) obliczają współczynniki aktywności γi obu fazach z tego samego równania stanu
c) obliczają współczynniki Φ w fazie gazowej z równania stanu SRK a współczynniki Φ w fazie ciekłej w oparciu o równanie NRTL
Obecnie do opisu lotności fazy gazowej i ciekłej przy ciśnieniach podwyższonych stosuje się równania stanu. To samo równanie dla obu faz.
![]()
![]()
![]()
![]()
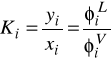
Współczynniki lotności oblicz się ze znanego wzoru, pod warunkiem, że mamy równanie stanu ważne dla obu faz.
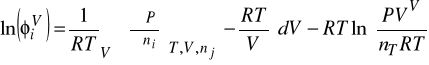
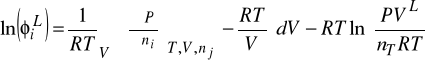
![]()
oraz ![]()
w każdym z równań odnoszą się do danej fazy
W pewnych przypadkach można przewidzieć równowagę ciecz - para. Zachodzi to w przypadku gdy zarówno roztwór jak i para odpowiadają pojęciom układów
doskonałych. Roztwory doskonałe spełniają pewne warunki i dla tych założeń prężność cząstkowa dowolnego składnika nad roztworem określić można z równania równowagi Raoulta.
W większości jednak spotykanych w praktyce przypadków odchylenia od prawa Raoulta są tak znaczne, że nie możemy go wtedy w ogóle brać pod uwagę, tzn. że roztwory rzeczywiste nie mogą być traktowane jako doskonałe, również para nad roztworem wykazuje znaczne różnice w porównaniu z gazem doskonałym. Odchylenia te wykazują roztwory substancji, których cząsteczki różnią się pod względem budowy, zwłaszcza rozmiarami, rozmieszczeniem atomów i obecnością grup lub atomów różnych
pierwiastków. Odchylenia po stronie fazy ciekłej występują nawet pod niskim
ciśnieniem wskutek działania sił międzycząsteczkowych.
Obliczenia równowagi w układach nie stosujących się do prawa Raoulta jest możliwe dzięki pojęciu aktywności. Przez aktywność rozumiemy funkcję matematyczną stanu danego składnika (temperatury i ciśnienia), której wartości są tak obliczone, że po podstawieniu zamiast ciśnienia lub stężenia spełniają prawa układów doskonałych, tzn. w naszym przypadku prawo Raoulta.
W przypadku wyższych ciśnień, przy których występują w fazie gazowej odchylenia od prawa gazów doskonałych, zależność między równowagowymi udziałami molowymi składników w fazie ciekłej i gazowej należy wyrazić przy pomocy wielkości termodynamicznej zwanej fugatywnością. Uwzględnienie odchyleń fazy gazowej od stanu doskonałego przez wprowadzenie fugatywności nie wystarcza jeszcze do wytłumaczenia odchyleń roztworów rzeczywistych od prawa Raoulta, gdyż odchylenia te występują również pod niskimi ciśnieniami, gdy faza gazowa (para) swoimi własnościami zbliża się do gazu doskonałego. Wynika z tego, że faza ciekła (roztwór) jest również źródłem odchyleń od tego prawa. Odchylenia spowodowane przez fazę ciekłą mogą być bardzo znaczne, nawet pod niskimi
ciśnieniami. Miarą ich są współczynniki aktywności składników 1 γ i 2 γ roztworu
dwuskładnikowego. Wartości współczynników aktywności obliczeń można
stosując odpowiednie równania. Najbardziej ogólnym równaniem jest równanie
Wohla.
2. Schemat technologiczny zawiera reaktor, w których zachodzi proces chemiczny w fazie gazowej pod ciśnieniem atmosferycznym oraz dwa dodatkowe aparat: chłodnicę i separator do rozdziału produktów, pracujące pod P= 1 bar. Jakiego modelu użyjesz do obliczenia entalpii:
a) LATENT HEAT (ciepła utajonego)
b) opartego na równaniu stanu SRK
c) opartego na prawie Henry'ego
d) AMINE
ChemCad oblicza entalpię jednym z dwóch poniższych sposobów:
1) Wykorzystując równanie stanu (metoda EOS)
2) Wykorzystując metodę ciepła utajonego (LATENT HEAT)
Metoda EOS bierze pod uwagę odchylenia entalpii od zachowania gazu doskonałego ze wzrostem ciśnienia. Metoda LATENT HEAT pomija to zjawisko.
Wyjątki od dwóch powyższych metod:
- do obliczania entalpii H2O stosuje się tabele pary wodnej
- do absorpcji gazów kwaśnych (H2S, CO2) w aminach przygotowana jest specjalna procedura (AMINE), której szczegóły są ukryte.
- użytkownik może wprowadzić własne wartości entalpii w postaci tabel lub wielomianów
- istnieje możliwość wczytania i wykorzystania ciepeł rozpuszczania
- jeżeli oblicza się tylko bilanse masowe - obliczenia entalpii mogą być pominięte
Ponieważ nie istnieją bezwzględne wartości entalpii, a obliczamy jedynie różnice - to stanem odniesienia jest entalpia tworzenia w temperaturze 298,15 K. Dla metody EOS fazy gazowej, dla metody LATENT HEAT przeważnie cieczy.
Model ciepła utajonego
Model ten jest odpowiedni dla układów reagujących, gdy efekty chemiczne zdecydowanie przewyższają efekty fizyczne, lub gdy ciśnienie jest bliskie atmosferycznemu i poprawka na zależność entalpii od ciśnienia jest do zaniedbania.
3. Zaletą modelu roztworu regularnego jest to że:
a) potrafi dokładnie modelować równowagi ciecz - para mieszanin składników polarnych z niepolarnymi
b) potrafi dokładnie modelować rozpuszczalność węglowodorów w wodzie
c) potrafi obliczać współczynniki aktywności γi wykorzystując własności czystych składników, bez konieczności znajomości danych eksperymentalnych równowagi ciecz - para dla wszystkich układów dwu- i więcej składnikowych rozpatrywanej mieszaniny
d)potrafi obliczać współczynniki lotności Φ wykorzystując własności czystych składników, bez konieczności znajomości danych eksperymentalnych równowagi ciecz - para dla wszystkich układów dwu- i więcej składnikowych rozpatrywanej mieszaniny
Model roztworu regularnego - pseudoskladniki
W roztworze regularnym niedoskonałość jest spowodowana wyłącznie czynnikiem energetycznym.
![]()
![]()
![]()
Teorię roztworu regularnego opracowali Hildebrand i Scatchard. Aby wyprowadzić wzór na ![]()
założyli:
1 ) Mieszające się ciecze mogą być opisane równaniem van-der-Waalsa o współczynnikach ![]()
i ![]()
.
2 ) Dla mieszaniny ![]()
Bazując na tych założeniach wyprowadzili wzór na energię kohezji - to znaczy część molowej energii wewnętrznej odpowiadającą energii oddziaływań międzycząsteczkowych.
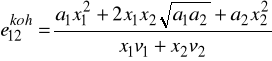
![]()
- objętość molowa składnika j
Dla czystego składnika 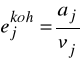
![]()
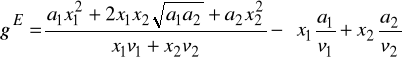
Wprowadzono definicję parametru rozpuszczalności ![]()
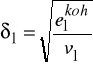
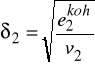
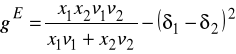
Zróżniczkowanie ![]()
względem ![]()
oraz rozszerzenie na układy wieloskładnikowe prowadzi do wzorów:
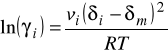
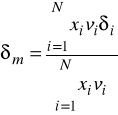
![]()
- parametr rozpuszczalności czystego składnika i
Wzór na obliczanie ![]()
ma szereg zalet:
- ![]()
zależy tylko od danych dotyczących składników czystych
- nie są konieczne dane dwu- i więcej składnikowe
- objętość jest skorelowana z łatwą do zmierzenia gęstością
- ![]()
![]()
- standardowa molowa entalpia parowania. Wyznacza się ją z pomiarów kalorymetrycznych lub oblicza metodami opartymi na udziałach grupowych.
Model roztworu regularnego może być stosowany do roztworów substancji niepolarnych i o zbliżonych rozmiarach. Często stosuje się go do frakcji naftowych traktowanych jako pseudoskładniki. Frakcje te są z reguły słabo polarne. Wprowadzając pseudoskładniki już zakłada się pewne uproszczenia. Wtedy odpowiednim modelem jest taki, który nie wymaga danych eksperymentalnych dwu- lub więcej składnikowych.
4. Model HRNM WILSON modyfikacja równania Wilsona opracowana przez Hiranumę)
został opracowany aby służyć do obliczeń:
a) równowagi ciecz - para
b) równowagi ciecz - ciecz
c) równowagi ciecz - ciało stałe
d) równowagi para - ciało stałe
ChemCad posiada 2 modele rozszerzające równanie Wilsona na równowagi ciecz - ciecz, chociaż ten przypadek może być liczony poprzez równania NRTL i Uniquac. Wzięto tu pod uwagę fakt, że użytkownik może być przyzwyczajony do równania Wilsona.
Model T.K. Wilson (opracowany przez Tsubokę i Katayamę) oraz
Model HRNM-Wilson (opracowany przez Hiranumę)
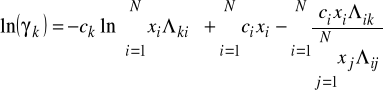
Oprócz ![]()
znaczenie pozostałych parametrów jest takie samo jak w równaniu oryginalnym.
![]()
zależy od mocy wiązania wodorowego i jest ustalony dla składnika a nie dla całego roztworu.
![]()
dla wody
![]()
dla alkoholi
![]()
dla wszystkich innych składników
5. Różnice pomiędzy modelem API SRK i SRK polegają na:
a) model API SRK służy do modelowania absorpcji gazów kwaśnych w etanoloaminach
b) drobnych różnicach w wartościach współczynników przy obliczaniach parametru a
c) model API SRK to równanie SRK specjalnie przystosowane do obliczania procesów osuszania węglowodorów z glikolem etylenowym
d) model API SRK używa nowych reguł mieszania dla parametru a wynikających z połączenia równań stanu z metodami opartymi na współczynnika aktywności γi
ChemCad zawiera 4 modyfikacje równania SRK. Trzy z nich (API SRK MSRK i TSRK) stanowią drobne modyfikacje . Czwarta (PSRK) stanowi nową generację równań stanu.
Model API SRK
Modyfikacja dotyczy współczynników liczbowych przy określaniu parametru a.
![]()
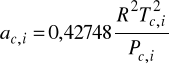
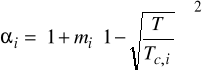
SRK: ![]()
API SRK: ![]()
6. Który z wymienionych modeli nadaje się do obliczania równowag fazowych ciecz - gaz
mieszanin węglowodorów pod ciśnieniem 50 barów:
a) metoda UNIFAC
b) równanie NRTL
c) równanie stanu SRK
d) równanie UNIQUAC
Równanie Redlicha - Konga jest wielomianem 3-ego stopnia z uwagi na objętość. Parametry a i b są obliczane tylko z własności czystych składników. Nie są wymagane dane dla układów dwu- i więcej składnikowych.
W roku 1972 Włoch Georgio Soave zmodyfikował powyższe równanie i w ten sposób powstało równanie Soave-Redlich-Kwong w skrócie SRK, które dzisiaj jest standardem.
ChemCad zgłasza się z tym równaniem jako domyślną opcją termodynamiczną jeżeli ciśnienie jest podwyższone, lub co najmniej jeden składnik jest w stanie nadkrytycznym.
7. Aby móc policzyć równowagę ciecz - para za pomocą równania Penga- Robinsona
z rozpatrywanych substancji powinna mieć w banku danych:
a) temperaturę krytyczną (Tc), ciśnienie krytyczne (Pc) i objętość krytyczną (Vc)
b) Tc, Pc i moment dipolowy
c) Tc, Pc i współczynnik acentryczny (ω)
d) Tc, Pc i temperaturę wrzenia pod ciśnieniem normalnym
Równanie stanu Penga - Robinsona (z roku 1976)
Podobnie jak SRK stanowi dzisiaj standard. Dokładne dla węglowodorów i ich mieszanin z prostymi gazami oraz dla układów kriogenicznych.
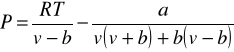
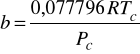
![]()
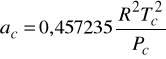
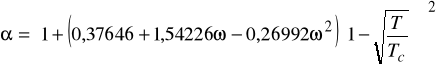
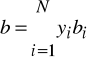
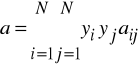
![]()
Wzór na współczynnik lotności ![]()
dla równania Penga - Robinsona ma poniższą postać:
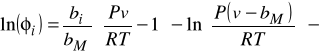
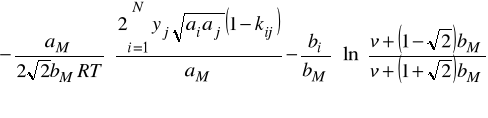
Znaczenie parametrów jest takie samo jak w równaniu SRK. Również i w tym modelu można zastosować ekstrapolację Bostona - Mathiasa dla gazów dla których w warunkach obliczania równowagi ![]()
.
Liczne modyfikacje równań stanu bazują albo na równaniu SRK albo na równaniu Penga - Robinsona.
8. Współczynniki lotności Φ w fazie gazowej wyprowadzone z równania... (?)
od:
a) Pi, yi ( ułamek molowy w fazie gazowej)
b) Ti, P
c) Ti, P, yi
d) Ti, yi
9. Współczynniki aktywności γ wyprowadza się:
a) różniczkując nadmiarową entalpię względem liczb moli
b) różniczkując nadmiarowy potencjał termodynamiczny względem liczby moli substancji i
c) całkując analityczną pochodną ciśnienia względem liczb moli wyprowadzonej z
NRTL
d) całkując analityczną pochodną ciśnienia względem liczby moli wyprowadzonej z
sześciennych równań stanu
Współczynniki aktywności z funkcji nadmiarowych w mieszaninach dwuskładnikowych.
W stałej temperaturze molowa nadmiarowa energia Gibbsa ![]()
dla mieszaniny zależy od składu i w niewielkim stopniu od ciśnienia. Pod ciśnieniami bliskimi atmosferycznemu (tzn. odległymi od ciśnienia krytycznego Pc) wpływ ciśnienia na ![]()
jest znikomy i może być pominięty.
Dla ![]()
![]()
Gdy ![]()
![]()
Rozważmy układ dwuskładnikowy, gdzie funkcje nadmiarowe odnoszą się do roztworu doskonałego w sensie prawa Raoulta. Wtedy:
![]()
dla ![]()
oraz ![]()
dla ![]()
Najprostsze wyrażenie które spełnia ten warunek:
![]()
A - stała empiryczna dla składników 1 i 2. ![]()
, ale ![]()
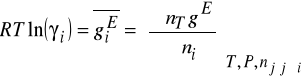
10. W obliczeniach równowag ciecz - para czynnik Poyntinga:
a) osiąga wartość bliską 1 i można go pominąć dla ciśnień bliskich (atmosferycznemu?)
b) osiąga wartość bliską 0 i można go pominąć dla ciśnień bliskich (atmosferycznemu?)
c) poprawia dokładność reguł mieszania dla sześciennych równań stanu
d) może być stosowany w metodach Φ - γ
Lotność czystej cieczy lub ciała stałego
Poniższe równanie jest ogólne i nie jest ograniczone tylko do gazów. Może być zastosowane do cieczy i ciał stałych.
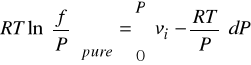
Stan czystej cieczy jest często stanem standardowym przy określaniu współczynników aktywności.
Aby obliczyć lotność czystej fazy ciekłej dla danej temperatury T i ciśnienia P - rozdzielamy całkę w powyższym równaniu na dwie części. Pierwsza wyraża lotność pary nasyconej pod T i ![]()
, a druga korekcję na kompresję fazy ciekłej od ciśnienia ![]()
do P.
Pod ciśnieniem nasycenia ![]()
lotność pary nasyconej jest równa lotności fazy ciekłej, ponieważ fazy nasycone są w równowadze.
(indeks „s” - stan nasycenia, indeks „L” faza ciekła)
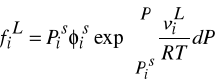
![]()
- współczynnik lotności pary nasyconej (odchylenie pary nasyconej od stanu doskonałego)
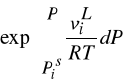
- czynnik Poyntinga
W warunkach odległych od punktu krytycznego można przyjąć, że ciecz jest nieściśliwa i wtedy:
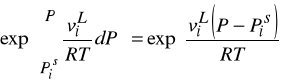
Te dwie korekcje są często (ale nie zawsze) małe i mogą być zaniedbane.
Gdy ![]()
to ![]()
(wyjątek kwasy organiczne i HF)
Czynnik Poyntinga jest ekspotencjalną funkcją ciśnienia. Przy niskich ciśnieniach ta poprawka jest mała, ale przy wysokich ciśnieniach może być duża.
Wartości czynnika Poyntinga dla T = 300K (27 oC) i substancji, dla której ![]()
P, bar |
Czynnik Poyntinga |
1 |
1,00405 |
10 |
1,0405 |
100 |
1,499 |
1000 |
57,0 |
Czyli dla 1 bara poprawkę tą można przeważnie pominąć.
Żródło: internet
Teraz przedstawimy kolejne uproszczenia zasadniczego wzoru metody γ - φ.
1. W zakresie umiarkowanych ciśnień możliwe są dwa uproszczenia: - dotyczące czynnika Poyntinga
- zakładające prawo Amagata w fazie parowej
2. W zakresie niskich ciśnień dalszym uproszczeniem jest założenie, że faza gazowa stosuje się do praw gazu doskonałego. Dla gazu doskonałego współczynniki fugatywności stają się równe )
To podejście do obliczania równowag ciecz - para nazywa się „![]()
”.
![]()
![]()
nie zależy od składu
![]()
Należy jednak pamiętać, że ścisłe zależności termodynamiczne mówią, iż ![]()
jest też funkcją ciśnienia.
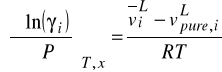
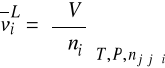
![]()
- objętość molowa czystego ciekłego składnika i
![]()
- pochodna cząstkowa objętości molowej względem liczb moli
Dla ciśnień bliskich atmosferycznemu zakłada się, że:
![]()
Stąd ![]()
nie jest funkcją ciśnienia Jednakże to decyduje o fakcie, że metody ![]()
stosuje się dla układów będących pod ciśnieniem nie większym niż kilka barów.
Gdy ![]()
wtedy często:
- zaniedbujemy czynnik Poyntinga (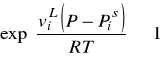
)
Zakładamy, że ![]()
lub ![]()
i ![]()
ale ![]()
![]()
1 Model T.K. WILSON ( modyfikacja równania Wilsona opracowana przez Tsubokę i Katayamę) został opracowany aby służyć do obliczeń:
a) równowagi ciecz - para
b) równowagi ciecz - ciecz
c) równowagi ciecz - ciało stałe
d) równowagi para - ciało stałe
ChemCad posiada też model UNIFAC LLE - do obliczania równowag ciecz - ciecz. Wszystkie wzory oraz parametry dla poszczególnych podgrup są takie same jak dla modelu ciecz - para. Wyjątek stanowi kilka podgrup stworzonych specjalnie dla równowagi ciecz - ciecz (np. grupa OH osobno w propanolu-1 i osobno w propanolu-2).
Liczba grup głównych jest mniejsza niż w przypadku równowagi ciecz - para (VLE) oraz oddziaływania są inne. Macierz oddziaływania jest w wielu miejscach niepełna. Dokładność przewidywania LLE jest znacznie mniejsza niż VLE.
ChemCad posiada 2 modele rozszerzające równanie Wilsona na równowagi ciecz - ciecz, chociaż ten przypadek może być liczony poprzez równania NRTL i Uniquac. Wzięto tu pod uwagę fakt, że użytkownik może być przyzwyczajony do równania Wilsona.
Model T.K. Wilson (opracowany przez Tsubokę i Katayamę)
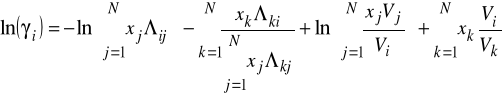
Znaczenie parametrów jest takie samo jak w oryginalnym równaniu, ale wartości liczbowe współczynników są inne i powinny być dopasowane z danych eksperymentalnych. (co ChemCad może zrobić sam poprzez regresję).
2. BIP's - "binary interaction parameters" (współczynniki oddziaływania międzycząsteczkowego) to w modelu opartym na równaniu stanu SRK:
a) parametr a dla mieszaniny
b) parametr b dla mieszaniny
c) parametr ae w regułach mieszania dotyczących parametru a
d) parametr ke w regułach mieszania dotyczących parametru a
ChemCad posiada opcję termodynamiczną BIP (binary interaction parameter). Dla metod ![]()
BIP to współczynniki równań Wilsona, NRTL itd. Dla równań stanu BIP to ![]()
.
Wzór na współczynnik lotności ![]()
dla równania SRK ma poniższą postać zarówno dla fazy gazowej jak i ciekłej. Jednakże wszędzie tam gdzie występuje objętość - dotyczy ona fazy dla której liczymy ten współczynnik. To samo dotyczy stężeń oznaczonych tu ![]()
.
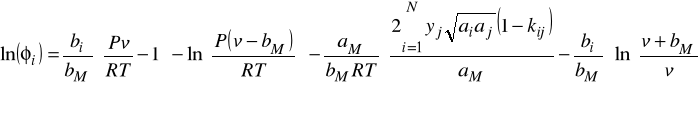
W oryginalnym równaniu SRK parametr a jest liczony ze wzorów:
![]()
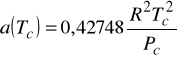
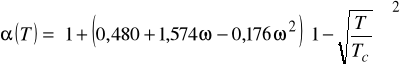
(A)
3. Metody obliczania równowag fazowych ciecz - para o ogólnej nazwie Φ - γ:
a) wykorzystują równanie van-der Waalsa
b) wykorzystują równanie stanu SRK (R)
c) stanowią rozszerzenie prawa Raoulta dla niedoskonałych faz: gazowej i ciekłej
d) opierają się na nowych regułach mieszania łączących równania stanu z metod
na współczynnika aktywności η
4. Schemat technologiczny zawiera separator do rozdziału mieszaniny węglowodorów C.C.
w temperaturze 10C pod ciśnieniem 30 barów. Jakiego modelu użyjesz do obliczenia entalpii
a) opartego na równaniu stanu SRK
b) AMINE
c) opartego na prawie Henry'ego
d) LATENT HEAT (ciepła utajonego)
5. Poprawkę na asocjację w fazie parowej należy użyć dla układów zawierających:
a) węglowodory aromatyczne
b) alkohole
c) kwasy organiczne
d) estry
Dodatkowe podopcje w ramach definiowania stałej równowagi fazowej K.
- Vapor phase association (asocjacja w fazie parowej)
…
ChemCad ma opcję „Vapor Phase Association”, którą powinno się zawsze uwzględniać, jeżeli przynajmniej jeden ze składników jest kwasem organicznym i stosujemy model oparty na współczynnikach aktywności
6. Różnice pomiędzy modelem PSRK i SRK polegają na:
a) drobnych różnicach w wartościach współczynników przy obliczaniach parametru a
b) model PSRK to równanie SRK specjalnie przystosowane do obliczania procesów osuszania węglowodorów z glikolem etylenowym
c) model PSRK używa nowych reguł mieszania dla parametru a wynikających z połączenia równań stanu z metodami opartymi na współczynnika aktywności γ
d) model PSRK służy do modelowania absorpcji gazów kwaśnych w etanolaminach
Model PSRK (predictive SRK)
Równania stanu dobrze przewidują zachowania indywiduów. Poprzez modyfikację czynnika ![]()
w parametrze a nawet proste równania stanu potrafią dobrze przewidywać zachowanie wody, czy alkoholi. Kłopoty sprawiają mieszaniny substancji polarnych i dlatego wprowadzono nowy typ reguł mieszania - zwłaszcza dla substancji polarnych.
Te reguły mieszania łączą równania stanu z potencjałami nadmiarowymi, czyli metodami opartymi na współczynnikach aktywności.
W pierwszej połowie lat dziewięćdziesiątych ubiegłego wieku pojawiło się kilka takich podejść. Jedno z nich o nazwie PSRK jest umieszczone w ChemCadzie.
7.Układ dwuskładnikowy i dwufazowy jest w równowadze ciecz - para jeżeli
T jest taka sama i P w obu fazach jest takie samo oraz:
a) Potencjały chemiczne składnika 1 w obu fazach są takie same oraz p...
w obu fazach są takie same
b) lotności składnika 1 w obu fazach są takie same oraz lotności składnika 2 w obu fazach są takie same
c) współczynnik aktywności γ składnika 1 w obu fazach są takie same oraz współczynniki aktywności γ składnika 2 w obu fazach są takie same
d) współczynniki lotności Φ składnika 1 w obu fazach są takie same oraz współczynniki lotności Φ składnika 2 w obu fazach są takie same
8. Metoda UNIFAC:
a) precyzyjnie modeluje równowagi ciecz - ciało stałe
b) jest równaniem stanu będącym wielomianem 3-ciego stopnia z uwagi na objętość
c) oblicza współczynniki aktywności γ mieszaniny wieloskładnikowej bez znajomości danych eksperymentalnych równowagi ciecz - para dla wszystkich układów
dwuskładnikowych tej mieszaniny
d) oblicza współczynniki lotności Φ mieszaniny wieloskładnikowej bez znajomości danych eksperymentalnych równowagi ciecz - para dla wszystkich układów
dwuskładnikowych tej mieszaniny
ChemCad ma ok. 50 opcji do obliczania stałej równowagi fazowej. Należą one generalnie do dwóch grup modeli:
- metody - ɣ (np. równanie Wilsona, NRTL, Uniquac, Unifac)
- metody oparte na równaniach stanu (EOS - equation of state) (np. Soave - Redlich - Kwong czyli SRK, czy Peng - Robinson).
Metoda UNIFAC - podejście oparte na udziałach grupowych
Dotychczas mówiliśmy o metodach obliczania ![]()
które posiadają stałe dopasowywane z eksperymentu. Istnieją takie metody, które tego eksperymentu nie wymagają. Są one oparte na udziałach grupowych.
Metoda ASOG (Analycical Solution Of Groups)
Metoda UNIFAC (UNIversal Functional gropu Activity Coefficient)
Ogromna ilość składników, a tym bardziej mieszanin występujących w technologii chemicznej może być traktowana jako mieszanina związków, które składają się ze stosunkowo niedużej liczby grup funkcyjnych typu: -CH2-, -NO2, -NH2, -OH itp. Zakłada się, że własności fizyczne danej substancji są suma wkładów jakie wnoszą do niej poszczególne składowe grupy funkcyjne.
Metody udziałów grupowych są oparte na założeniu, że nadmiarowy potencjał termodynamiczny ![]()
, a w konsekwencji logarytm ze współczynnika aktywności ![]()
, może być wyrażony jako suma dwóch członów Pierwszy z nich (człon kombinatoryczny) bierze pod uwagę kształt i rozmiar cząsteczek. Drugi (człon pozostałościowy) wyraża oddziaływania pomiędzy różnymi grupami wchodzącymi w skład roztworu. Występuje tu duża analogia do równania Uniquac - część kombinatoryczna jest liczona prawie tak samo.
![]()
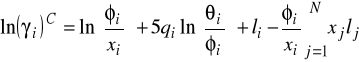
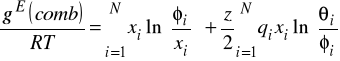
gdzie:
![]()
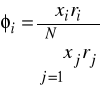
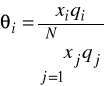
Podobnie jak w metodzie Uniquac ![]()
oraz ![]()
są odpowiednio powierzchniowym i objętościowym współczynnikiem van-der-Waalsa. Oblicza się je poprzez zsumowanie odpowiednich własności poszczególnych grup, z których składa się dana substancja.
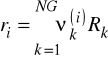
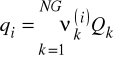
![]()
- liczba grup typu k w składniku i
![]()
, ![]()
- odpowiednio objętościowy i powierzchniowy współczynnik van-der-Waalsa dla grupy k
NG - liczba grup w roztworze
Wartości ![]()
i ![]()
są stablicowane dla ponad 100 grup (a właściwie podgrup). H2O, CH3OH i HCOOH są traktowane jako osobne grupy. Znając ![]()
oraz ![]()
i ![]()
można policzyć ![]()
i ![]()
. A następnie ![]()
, ![]()
, ![]()
oraz ![]()
.
Człon pozostałościowy jest obliczany ze wzoru:
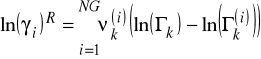
![]()
- współczynnik aktywności grupy k
![]()
- współczynnik aktywności grupy k w stanie odniesienia - tzn. roztwór zawiera tylko cząsteczki czystego składnika i
Obydwa te współczynniki są liczone z tego samego wzoru
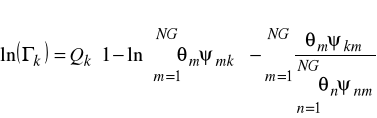
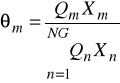
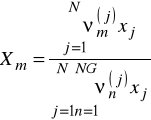
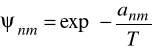
![]()
- ułamek grupowy
![]()
- parametr oddziaływań międzygrupowych
9. Współczynniki lotności Φ w fazie ciekłej wyprowadzone z równania stanu SRK (zależą od?):
a) Pi, xi ( ułamek molowy w fazie ciekłej) R
b) Ti, xi
c) Ti, Pi
d) Ti, Pi, xi
10. Strumień zawiera węglowodory parafinowe i olefinowe C1-C6 , który …
Chcemy poddać go półspalaniu z tlenem w obecności pary wodnej w celu otrzymania gazu
syntezowego. Jakiego reaktora należy użyć do obliczenia składu produktów?
a) Gibbsa
b) równowagowego
c) stechiometrycznego
d) kinetycznego
Gaz syntezowy z węglowodorów ciekłych można otrzymać dwoma metodami:
- metoda ICI - katalityczna konwersja parą wodną do CO i H2,
- metody Texaco i Shell - półspalanie do CO i H2
Dla reaktora Gibbsa: W podejściu tym nie ma żadnej wielkości, która wiązałaby się ze stechiometrią reakcji. Innymi słowy podejście to zwane metodą niestechiometryczną nie bierze pod uwage liczby i postaci reakcji niezależnych poprzez które układ osiąga stan równowagi. Metoda ta wymaga podania tylko T, P, skład surowca oraz listy składników które mogą ale nie muszą wystapic w stanie równowagi. Metoda ta jest szczególnie wygodna wtedy, gdy mamy dużo składników i stalenie stechiometrii reakcji jest trudne.
Wyszukiwarka