UNIWERSYTET ZIELONOGÓRSKI
WYDZIAŁ INŻYNIERII LĄDOWEJ I SANITARNEJ
LABORATORIUM
Z TECHNIKI CIEPLNEJ
Temat: WYZNACZENIE WARTOŚCI OPAŁOWEJ
DLA PALIWA STAŁEGO
Wykonałi:
Ania Kuczyńska
Angelika Sęk
Łukasz Ochotny
Grupa 26 B
Cel ćwiczenia.
Celem ćwiczenia jest określenie efektu cieplnego powstałego podczas spalania paliwa stałego w tzw. ` bombie kalorymetrycznej ` umieszczonej w kalorymetrze.
2. Schemat stanowiska pomiarowego.
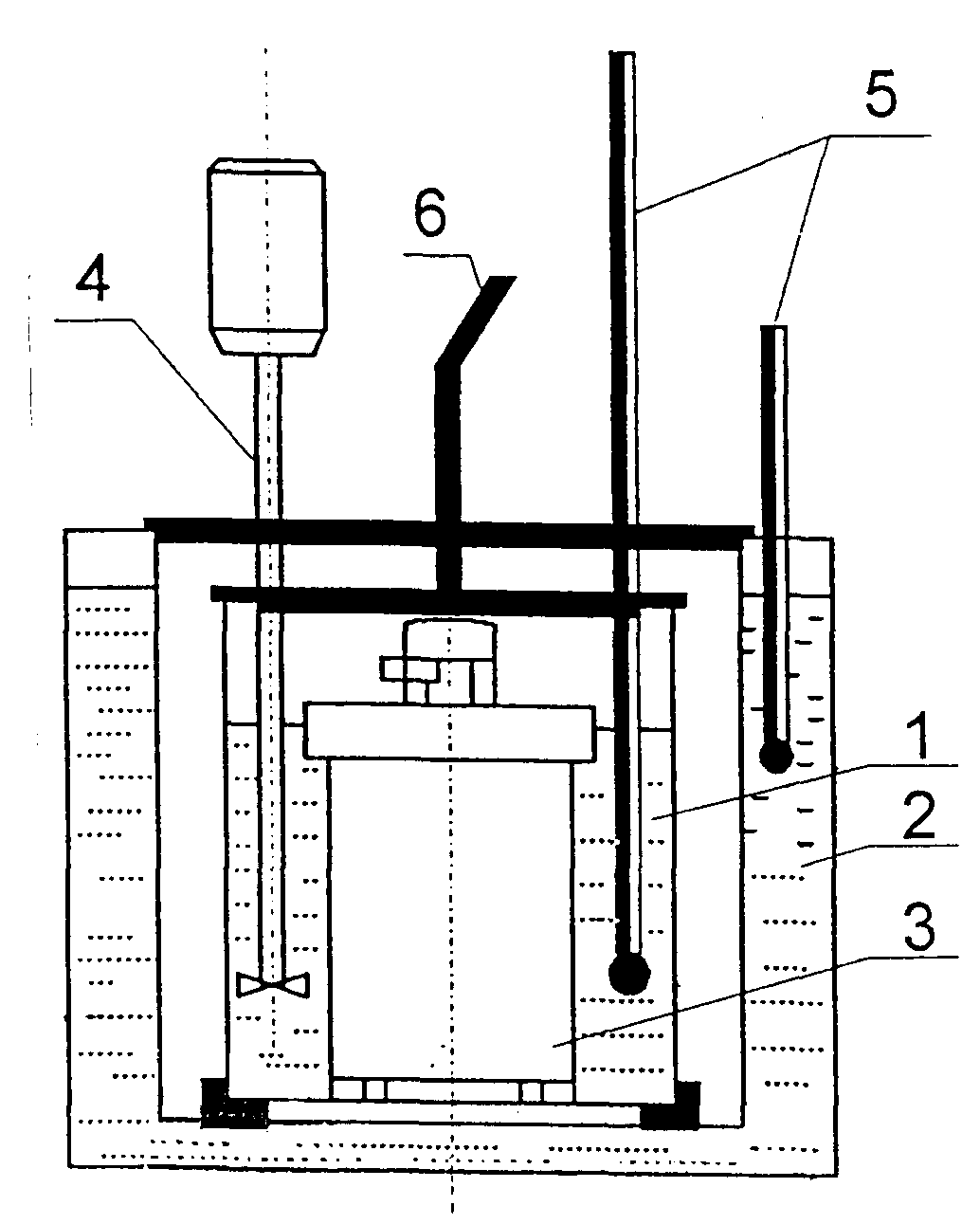
kalorymetr
naczynie kalorymetryczne
płaszcz wodny
bomba kalorymetrycznamieszadło
termometr
przewody zapłonowe
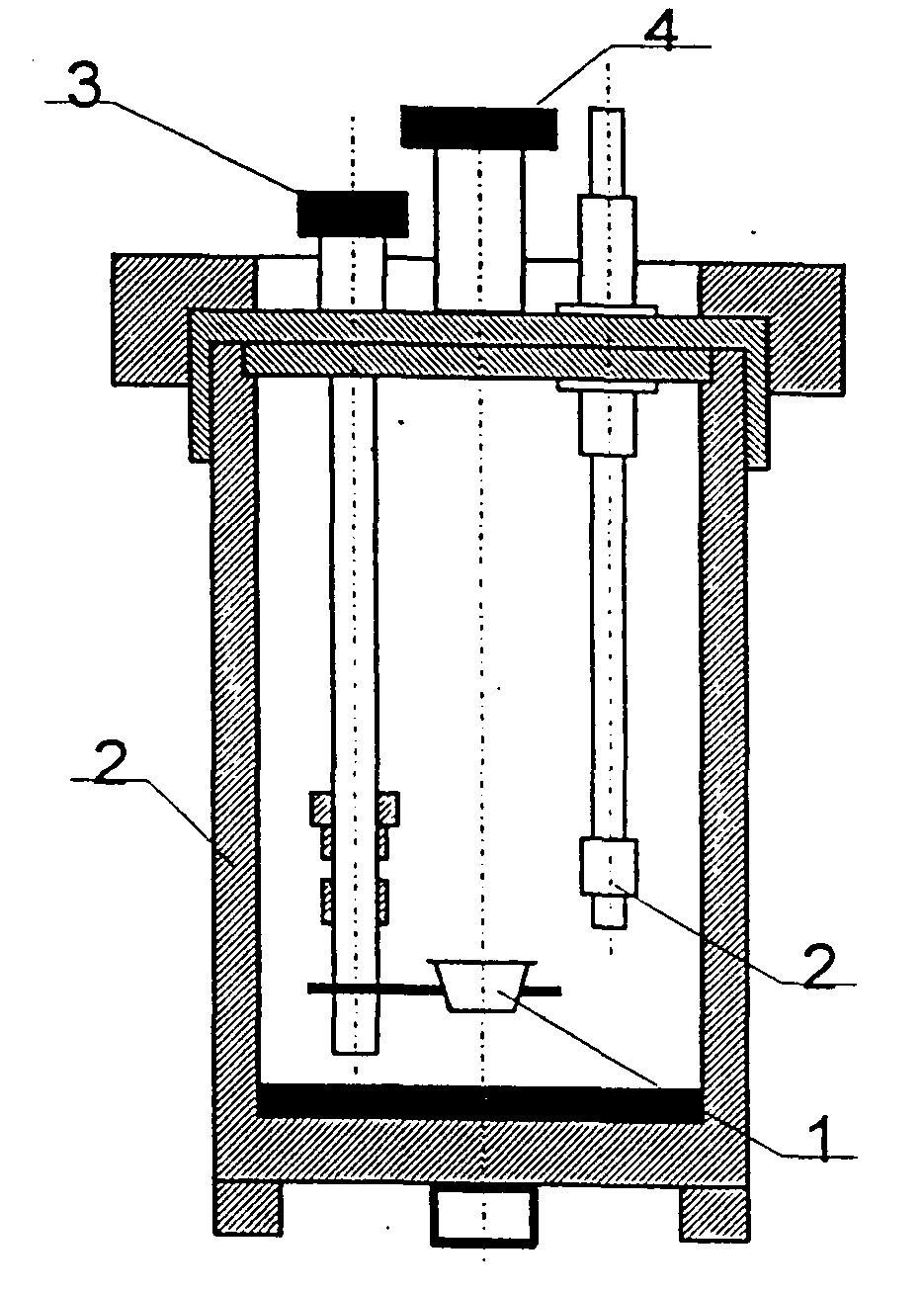
bomba kalorymetryczna
tygiel
elektrody
zawór wylotowy
zawór wlotowy
Część teoretyczna.
Paliwem nazywamy substancję, która ma następujące właściwości:
- przy łączeniu się pierwiastków z tlenem wydziela się duża ilość ciepła
- występuje w przyrodzie w większych ilościach
- koszt jej wydobycia i dostarczenia do miejsca spalania jest stosunkowo mały (w porównaniu z otrzymaną ilością ciepła )
Wartość cieplną paliwa charakteryzuje ilość ciepła otrzymana po ochłodzeniu spalin wytworzonych przy całkowitym spaleniu 1kg paliwa stałego lub ciekłego albo 1Nm3 gazu. Jeżeli do tej ilości ciepła nie wlicza się ciepło parowania pary wodnej powstałej przy spalaniu, to nosi ona nazwę wartości opałowej paliwa ( jeżeli wlicza się ciepło parowania pary wodnej, to nosi ona nazwę- ciepło spalania )
Paliwo |
Wartość opałowa paliwa kcal/kg |
Węgiel kamienny Węgiel brunatny (polski) Koks hutniczy Koks gazowniczy Drewno opałowe Węgiel drzewny Torf Ropa naftowa Benzyna Olej napędowy |
5000-8150 4100 7260 6600 2500-3650 3000-7000 3200-3600 9500-10000 9800-10500 10100-10400 |
Paliwo |
Wartość opałowa paliwa kcal/m3 |
Gaz ziemny Gaz świetlny Gaz koksowniczy |
8200-8600 4000-4800 3500-4300 |
Oznaczanie ciepła spalania paliw stałych polega na całkowitym i zupełnym spaleniu paliwa w umieszczonym w kalorymetrze zamkniętym naczyniu (bombie kalorymetrycznej) i określeniu efektu cieplnego podczas spalania.
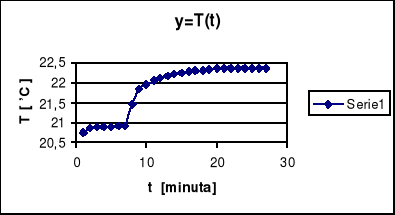
Pobraną porcję paliwa po zważeniu z dokładnością do 0,0001g umieszcza się w tyglu w postaci sprasowanej pastylki. Odważkę w tyglu można zapalić za pomocą stalowego drutu oporowego o średnicy 0,1mm wprasowanego w pastylkę. Na dno bomby kal. wlewa się 2cm3 wody destylowanej. Zamykamy bombę kal. i napełniamy nie zawierającym palnych domieszek tlenem. Napełnioną bombę kal. wstawia się do naczynia kalorymetrycznego zawierającego wodę o temp. niższej o 1K od temperatury wody w płaszczu kalorymetru, ilość wody w naczyniu kal. powinna być taka sama, jak podczas wcześniejszego oznaczania pojemności cieplnej kalorymetru. Woda powinna całkowicie zakrywać górną powierzchnię bomby kal. Przewody zapłonowe kalorymetru łączy się z elektrodami bomby kal., w naczyniu umieszcza się termometr i mieszadło, a całość zamyka się pokrywami. Pomiar kalorymetryczny rozpoczyna się po upływie 5-10minut od chwili włączenia mieszadła i składa się z trzech okresów: początkowego, głównego, końcowego, w których notuje się przebieg zmian temperatury naczynia kal. Odczytów dokonuje się co 1min. Okres początkowy trwa 5min. i dokonuje się w nim 6 odczytów. Okres główny rozpoczyna się w chwili zapłonu paliwa tj. po ostatnim odczycie temp. okresu początkowego, który jest jednocześnie pierwszym odczytem okresu głównego. Okres główny kończy się z chwilą odczytania maksymalnej temp. Okres końcowy następuje bezpośrednio po okresie głównym, trwa 5min. i składa się z 5 odczytów temp. Po zakończeniu pomiaru należy sprawdzić czy nastąpiło całkowite spalenie paliwa.
Tabela wyników.
Okres początkowy |
Okres główny |
Okres końcowy |
|||||||
L.p. |
°C |
L.p. |
°C |
L.p. |
°C |
L.p. |
°C |
L.p. |
°C |
0 |
21,13 |
1 |
21,20 |
10 |
22,52 |
19 |
22,61 |
1 |
22,61 |
1 |
21,16 |
2 |
21,65 |
11 |
22,54 |
20 |
22,61 |
2 |
22,61 |
2 |
21,19 |
3 |
22,08 |
12 |
22,55 |
21 |
22,61 |
3 |
22,60 |
3 |
21,19 |
4 |
22,25 |
13 |
22,56 |
22 |
22,61 |
4 |
22,60 |
4 |
21,20 |
5 |
22,34 |
14 |
22,57 |
23 |
22,61 |
5 |
22,58 |
5 |
21,20 |
6 |
22,38 |
15 |
22,58 |
24 |
22,61 |
|
|
|
|
7 |
22,43 |
16 |
22,59 |
25 |
22,61 |
|
|
|
|
8 |
22,47 |
17 |
22,60 |
26 |
22,62 |
|
|
|
|
9 |
22,49 |
18 |
22,60 |
27 |
22,61 |
|
|
Obliczenie ciepła spalania paliwa Q.
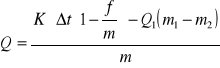
K - stała kalorymetru 13500 J/ °C
f - 0,0015 g
m - masa próbki paliwa 0,9343 g
Q1 - ciepło spalania drucika zapłonowego 6690 J/g
m1 - początkowa masa drucika zapłonowego 0,0057g
m2 - masa drucika po spaleniu 0,005 g
Δt - obliczeniowa różnica temperatur = tg-t0-k [°C] , gdzie
k=0,5(Δt1+Δt2)+(n-1) Δt2 [°C]
tg - ostatni odczyt temperatury okresu głównego 22,61 [°C]
t0 - ostatni odczyt temperatury okresu początkowego 21,20 [°C]
Δt1 - średni przyrost temperatury w okresie początkowym = (t0 - t1)/5
t1 - drugi odczyt temperatury w okresie początkowym 21,16 [°C]
Δt2 - średni przyrost temperatury w okresie końcowym = (tk - tk')/5
tk - pierwszy odczyt temperatury w okresie końcowym 22,61 [°C]
tk' - ostatni odczyt temperatury w okresie końcowym 22,58 [°C]
n - liczba pomiarów w okresie głównym 27
Δt1=(21,20-21,16)/5=0,008 [°C]
Δt2=(22,67-22,64)/5=0,006 [°C]
k=0,5(0,008+0,006)+(27-1)0,006=0,163[°C]
Δt=22,37-20,90-0,067=1,247 [°C]
Q=1784,36
6. Wnioski.
Działanie kalorymetru polega na tym, że ciepło wydzielające się przy spalaniu paliwa w palniku ogrzewa wodę przepływającą przez kalorymetr. Dzięki dobrej izolacji eliminuje się do minimum stratę promieniowania na zewnątrz. Mierząc ilość spalonego paliwa, ilość ogrzanej wody i różnicę temperatur wody na wlocie i wylocie z kalorymetru można obliczyć ciepło spalania paliwa. Dodatkowo zbierane są także skropliny powstające przy skraplaniu się pary wodnej znajdującej się w spalinach, co pozwala obliczyć wartość opałową danego paliwa np. węgla, koksu, drewna.
Wyszukiwarka