Wstęp teoretyczny
Ekstrakcją nazywa się proces przeprowadzania substancji rozpuszczonej w jednej fazie ciekłej do drugiej fazy ciekłej, nie mieszającej się z pierwszą. Jedną fazą ciekłą jest zwykle w analitycznych metodach rozdzielania roztwór wodny, drugą - rozpuszczalnik organiczny, nie mieszający się w znaczniejszym stopniu z wodą. [1]
Ekstrakcja podlega regule faz Gibbsa, według której liczba faz (f) w układzie plus liczba stopni swobody (s) równa się liczbie składników (n) układu plus dwa: f + s = n + 2.
W ekstrakcji typu ciecz - ciecz są dwie fazy ciekłe i jeden składnik. A więc w stałej temperaturze i pod stałym ciśnieniem reguła faz przewiduje tylko jeden stopień swobody. Oznacza to, że stężenie substancji w jednej fazie ciekłej determinuje jej stężenie w fazie drugiej. Tę ilościową zależność określa prawo podziału, zgodnie z którym substancja rozpuszczona dzieli się między dwa nie mieszające się rozpuszczalniki tak, że w stanie równowagi stosunek stężeń substancji rozpuszczonej w tych dwu rozpuszczalnikach jest stały w danej temperaturze i nie zależy od ogólnego stężenia substancji. Stosunek ten wyraża stała podziału P, którą opisuje równanie:
![]()
przy czym co i cw oznaczają stężenia danego składnika w rozpuszczalniku i w roztworze wodnym. [1]
Wielkością uwzględniającą wpływ zachodzących reakcji chemicznych substancji w obu fazach jest współczynnik podziału D, który stanowi stosunek sumy stężeń wszystkich form substancji (pierwiastka) w fazie organicznej (∑co) do sumy stężeń wszystkich form w fazie wodnej (∑cw): [1]
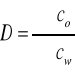
.
Grupą kompleksów chelatowych znajdujących szerokie zastosowanie w ekstrakcyjnych metodach rozdzielania małych ilości jonów metali są przede wszystkim wewnętrzne chelaty. Związki te trudno rozpuszczalne w wodzie, rozpuszczają się w ograniczonej ilości rozpuszczalnikach organicznych o małych wartościach stałej dielektrycznej. Do najważniejszych odczynników organicznych tworzących z jonami metali wewnętrzne chelaty należą: β - dwuketony (np. acetyloaceton, tienoilotrójfluoroaceton TTA), dwuoksymy (dwumetyloglioksym, α-furylodwuoksym), dwutiokarbaminiany, ditizon, 8-hydroksychinolina, kupferron. [2]
[1] - J. Minczewski Z. Marczenko „Chemia analityczna” Wydawnictwo Naukowe PWN , Warszawa 1985, rozdz. 2, punkt 2.2.1 str. 69
[2] - J. Minczewski Z. Marczenko „Chemia analityczna” Wydawnictwo Naukowe PWN , Warszawa 1985, rozdz. 2, punkt 2.2.2 str. 71
Obliczenia z części pierwszej.
![]()
dla 3 ml r-ru podst. T = 76% = 0,76 A = log 1/0,76 = log 1,31 = 0,119
dla 5 ml r-ru podst. T = 77% = 0,77 A = log 1/0,77 = log 1,30 = 0,114
dla 10 ml r-ru podst. T = 71% = 0,71 A = log 1/0,71 = log 1,40 = 0,149
dla 15 ml r-ru podst. T = 55% = 0,55 A = log 1/0,55 = log 1,82 = 0,260
dla 20 ml r-ru podst. T = 45% = 0,45 A = log 1/0,45 = log 2,22 = 0,347
dla 25 ml r-ru podst. T = 38% = 0,38 A = log 1/0,38 = log 2,63 = 0,420
dla 30 ml r-ru podst. T = 37% = 0,37 A = log 1/0,37 = log 2,70 = 0,432
dla 40 ml r-ru podst. T = 32% = 0,32 A = log 1/0,32 = log 3,13 = 0,495
Obliczanie stężenia roztworu podstawowego.
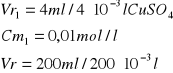
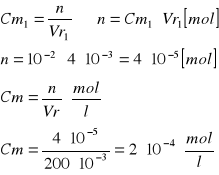
Obliczenie [Cu]0 [mol/l]
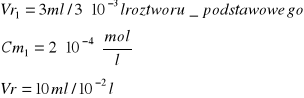
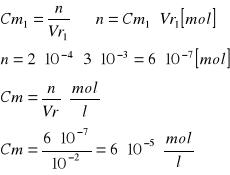
Obliczenie [Cu]0 [mol/l]
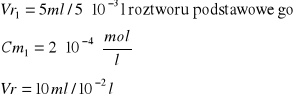
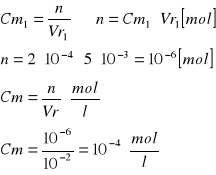
Obliczenie [Cu]0 [mol/l]
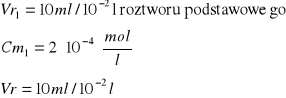
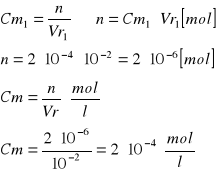
Obliczenie [Cu]0 [mol/l]
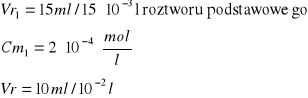
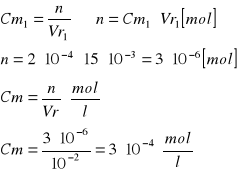
Obliczenie [Cu]0 [mol/l]
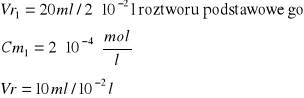
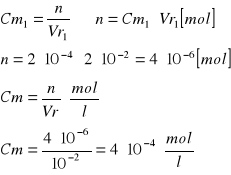
Obliczenie [Cu]0 [mol/l]
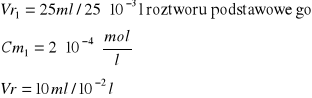
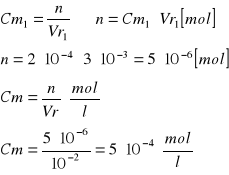
Obliczenie [Cu]0 [mol/l]
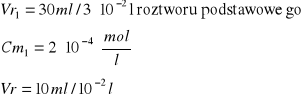
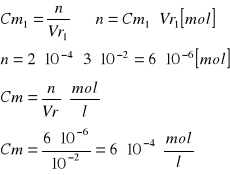
Obliczenie [Cu]0 [mol/l]
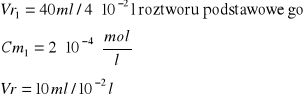
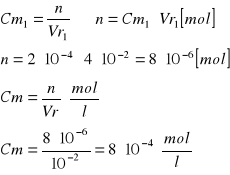
Wyniki umieszczamy w tabeli 1.
Tabela 1
Nr roztworu |
Objętość r-ru podstawowego [ml] |
[Cu]o [mol/l] |
A 400nm |
1 |
3 |
0,00006 |
0,119 |
2 |
5 |
0,0001 |
0,114 |
3 |
10 |
0,0002 |
0,149 |
4 |
15 |
0,0003 |
0,260 |
5 |
20 |
0,0004 |
0,347 |
6 |
25 |
0,0005 |
0,420 |
7 |
30 |
0,0006 |
0,432 |
8 |
40 |
0,0008 |
0,495 |
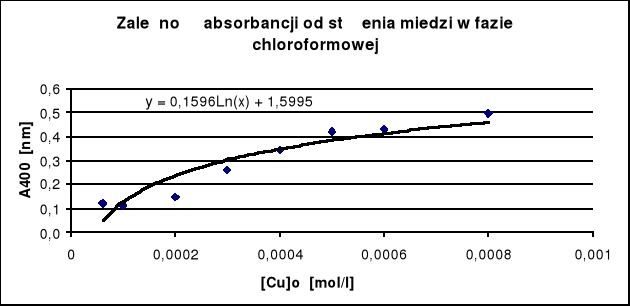
y = 0,1596 ln(x) +1,5995
y - absorpcja
x - stężenie miedzi [Cu]o
Obliczenia z części drugiej.
![]()
20 kropel HCl T = 80% = 0,79 A = log 1/0,79 = 0,102 pH = 2,62
18 kropel HCl T = 69% = 0,69 A = log 1/0,69 = 0,161 pH = 1,59
15 kropel HCl T = 65% = 0,63 A = log 1/0,63 = 0,201 pH = 2,45
9 kropel HCl T = 35% = 0,34 A = log 1/0,34 = 0,469 pH = 2,78
7 kropel HCl T = 26% = 0,31 A = log 1/0,31 = 0,509 pH = 2,80
5 kropel HCl T = 25% = 0,28 A = log 1/0,28 = 0,553 pH = 2,98
3 kropel HCl T = 25% = 0,27 A = log 1/0,27 = 0,569 pH = 3,12
0 kropel HCl T = 24% = 0,28 A = log 1/0,28 = 0,553 pH = 3,65
Tabela 2
pH |
A400nm |
[Cu]o [mol/l] |
[Cu]w [mol/l] |
Wsp.podz. D |
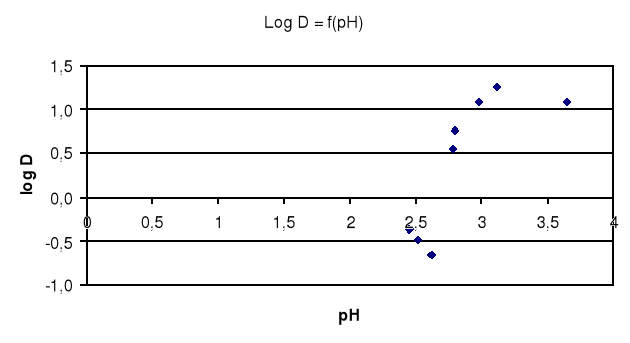
Log D |
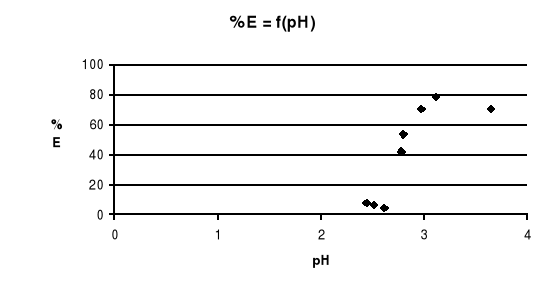
Proc.ekstrakcji %E |
2,62 |
0,102 |
0,00008 |
0,000383 |
0,220 |
-0,657 |
4,22 |
2,52 |
0,161 |
0,00012 |
0,000376 |
0,325 |
-0,489 |
6,10 |
2,45 |
0,201 |
0,00016 |
0,000369 |
0,423 |
-0,373 |
7,81 |
2,78 |
0,469 |
0,00084 |
0,000233 |
3,59 |
0,556 |
41,8 |
2,8 |
0,509 |
0,00108 |
0,000185 |
5,82 |
0,765 |
53,8 |
2,98 |
0,553 |
0,00142 |
0,000116 |
12,2 |
1,09 |
70,9 |
3,12 |
0,569 |
0,00157 |
0,000087 |
18,1 |
1,26 |
78,3 |
3,65 |
0,553 |
0,00142 |
0,000116 |
12,2 |
1,09 |
70,9 |
Wzór strukturalny kompleksu miedzi (II) z 8 - hydroksychinoliną
Obliczenia [Cu]o [mol/l] na podstawie krzywej z części pierwszej
y = 0,1596 ln(x) +1,5995
y - absorpcja
x - stężenie miedzi [Cu]o
a = 0,1596
b = 1,5995
Dla 20 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
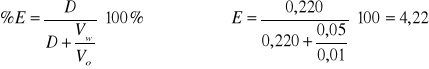
Dla 18 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
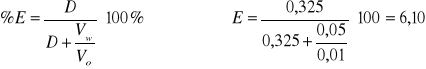
Dla 15 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
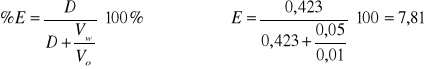
Dla 9 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
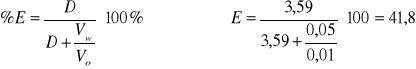
Dla 7 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
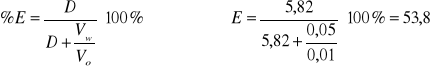
Dla 5 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
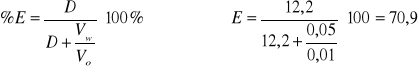
Dla 3 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
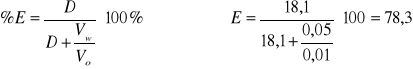
Dla 0 kropel HCl
![]()
![]()
![]()
![]()
![]()
![]()
![]()
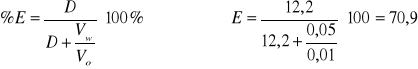
Wykres zależności logD = f(pH)
Wykres zależności %E = f(pH)
13
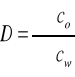
Wyszukiwarka