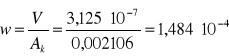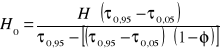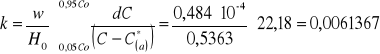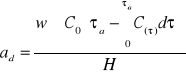Wydział Chemiczny |
Izotermiczna adsorpcja okresowa w układzie ciało stałe - ciecz
Laboratorium inżynierii chemicznej
Grupa 1 |
(TCC3055l 31-87B) |
Czwartek 8:15-11:00 |
Opracował: |
Dariusz Łozak |
Składowe |
Punktacja |
||
I |
Opracowanie arkusza wyników (schemat aparatury, metodyka badań, wyniki badań), oznaczenia |
(0-5), min. 2
|
|
II |
Przykład obliczeniowy |
(0-5), min. 3
|
|
III |
Wnioski |
(0-5), min. 2
|
|
∑ |
|
||
Punkty |
Ocena |
|
|
< 8 8 - 9 10 11-12 13 14 15 |
2.0 3.0 3.5 4.0 4.5 5.0 5.5 |
|
|
Wrocław, 23.03.2006
Oznaczenia
|
|
|
pole powierzchni |
m2 |
||
|
|
|
aktywność złoża adsorbenta |
kg/m3 |
||
|
|
|
aktywność równowagowa |
kg/kg złoża |
||
|
|
|
aktywność równowagowa |
kg/m3 |
||
|
|
|
stężenie składnika w cieczy wylotowej |
kg/m3 |
||
|
|
|
stężenie równowagowe do aktywności |
kg/m3 |
||
|
|
|
początkowe stężenie p-ksylenu w próbce |
kg/m3 |
||
|
|
|
średnica wewnętrzna kolumny |
m |
||
|
|
|
wysokość warstwy złoża adsorbenta |
m |
||
|
|
|
wysokość frontu adsorpcji |
m |
||
|
|
|
wysokość złoża adsorbenta |
m |
||
|
|
|
współczynnik przenikania masy |
1/s |
||
|
|
|
współczynnik załamania światła substancji w temperaturze pokojowej |
- |
||
|
|
|
czas przepływu określonej ilości cieczy |
s |
||
|
|
|
objętość |
ml |
||
|
|
|
objętościowe natężenie przepływu |
m3/s |
||
|
|
|
Prędkość cieczy odniesiona do całego pola przekroju poprzecznego warstwy złoża adsorbenta |
|
||
symbole greckie |
|
|||||
|
|
|
współczynnik symetrii |
- |
||
|
|
|
gęstość wypełnienia kolumny |
kg/m3 |
||
|
|
|
czas |
s |
||
indeksy dolne |
|
|||||
|
0,05 |
|
odnosi się do 5% wartości wielkości |
|
||
|
0,95 |
|
odnosi się do 95% wartości wielkości |
|
||
|
a |
|
odnosi się do całkowitego czasu adsorpcji |
|
||
|
d |
|
dotyczy aktywności dynamicznej |
|
||
|
k |
|
dotyczy kolumny |
|
||
nadpisania |
|
|||||
|
. |
|
strumień wielkości |
1/s |
||
1. Cel ćwiczenia
Celem ćwiczenia było wyznaczenie wartości współczynnika przenikania masy i aktywności dynamicznej warstwy złoża w kolumnie, w której zachodzi izotermiczna adsorpcja okresowa jednego ze składników mieszaniny ciekłej.
2. Aparatura
Schemat instalacji badawczej pokazano na rysunku 1 w załączniku A.
3. Metodyka badań
Badania zostały wykonane zgodnie z metodyką zawartą w załączniku A.
4. Wyniki badań
Wyniki badań zostały zgromadzone w tabeli 1 w załączniku A.
5 Metodyka obliczeń - przykład obliczeniowy
5.1 Obliczanie prędkości liniowej cieczy w kolumnie:
a) natężenie przepływu obliczono na podstawie danych doświadczalnych ze wzoru:
|
(1) |
b) prędkość liniową obliczamy z wykorzystaniem objętościowego natężenia przepływu dla pola przekroju kolumny Ak=0,002106:
|
(2) |
5.2 Obliczanie wartości stężenia C na podstawie zmierzonych wartości współczynnika załamania światła:
|
(3) |
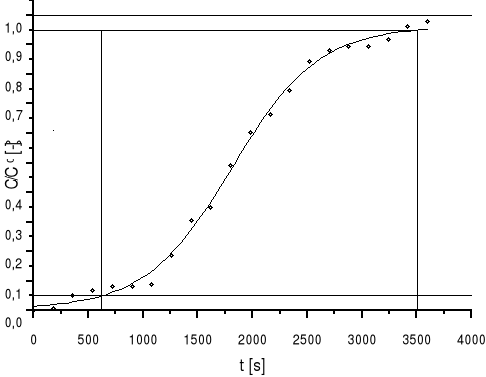
5.3 Wyznaczanie wykresu krzywej wyjściowej C/C0 w funkcji czasu:
a) początkowe stężenie p-ksylenu w próbce obliczono ze wzoru :
|
(4) |
b) po wyznaczeniu stosunku C/C0 wyznaczam krzywą wyjściową i obliczam pola A1 i A2:
|
||
Rysunek |
2 |
Wykres krzywej wyjściowej f(τ)=C/C0 |
5.4 Obliczanie współczynnika symetrii w zakresie zmian czasu τ (0,05) - τ (0,95):
|
(5) |
5.5 Obliczanie wysokości frontu adsorpcji:
|
(6) |
5.6 Wyznaczenie wykresu izotermy adsorpcji wraz z linią operacyjną o punktach skrajnych postaci (0,0) i (C0,a*(Co)):
a) aktywność równowagową dla stałych A=2,453.10-3 i B=5,002.10-3 obliczono z równania Langmuir'a:
|
(7) |
b) aktywność złoża obliczono ze wzoru:
|
(8) |
|
||
Rysunek |
3 |
Wykres izotermy równowagowej a*(C) i linii operacyjnej a(C) |
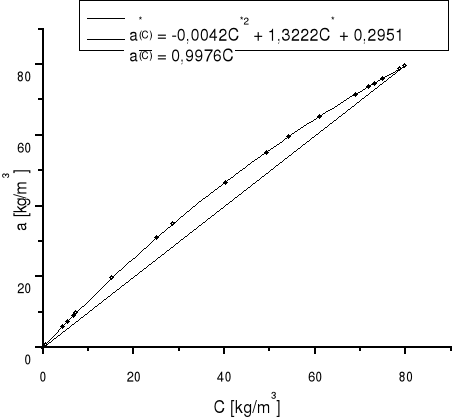
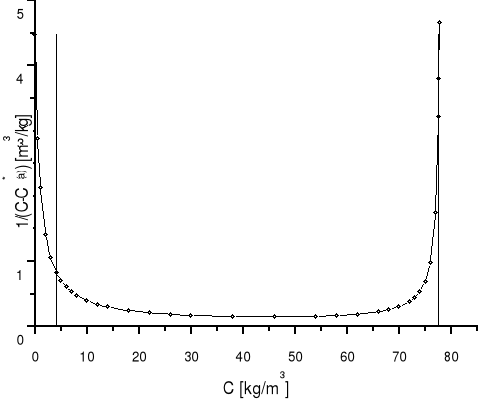
5.7 Obliczanie współczynnika przenikania masy korzystając z równań izotermy równowagowej i linii operacyjnej:
b) graficzne rozwiązanie całki 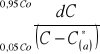
:
|
||
Rysunek |
4 |
Wykres zależności wyrażenia 1/(C-C*(a)) od stężenia C |
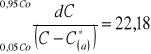
![]()
gdzie C*(a) obliczono korzystając z równań izotermy równowagowej i linii operacyjnej wg następującego schematu:
![]()
![]()
dla ![]()
![]()
![]()
![]()
![]()
![]()
b) współczynnik przenikania masy obliczono ze wzoru:
|
(9) |
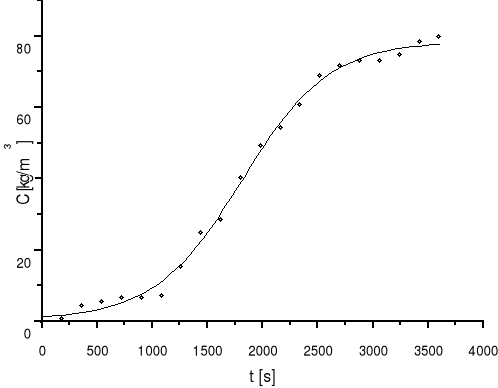
5.8 Obliczanie aktywności dynamicznej złoża:
a) graficzne rozwiązanie całki 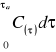
:
|
||
Rysunek |
5 |
Wykres zależności stężenia składnika na wylocie od czasu |
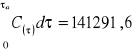
e) aktywność dynamiczną złoża obliczono ze wzoru:
|
(10) |
Tabela |
2. |
Wyniki obliczeń |
|||||||||||
|
|
|
|
|
|
|
|||||||
3,125·10-7 |
1,484·10-4 |
81,6328 |
0,3792 |
0,5363 |
0,0061367 |
71,20008 |
|||||||
Tabela |
3. |
Wyniki obliczeń |
|||||||||||
|
|
|
|
|
|||||||||
1,3801 |
0,0000 |
0,00000 |
0,000000 |
0,000000 |
|||||||||
1,3802 |
0,6092 |
0,00746 |
0,001490 |
0,847712 |
|||||||||
1,3808 |
4,2644 |
0,05224 |
0,010242 |
5,827757 |
|||||||||
1,3810 |
5,4828 |
0,06716 |
0,013090 |
7,448385 |
|||||||||
1,3812 |
6,7012 |
0,08209 |
0,015905 |
9,049900 |
|||||||||
1,3812 |
6,7012 |
0,08209 |
0,015905 |
9,049900 |
|||||||||
1,3813 |
7,3104 |
0,08955 |
0,017300 |
9,843595 |
|||||||||
1,3826 |
15,2300 |
0,18657 |
0,034715 |
19,752616 |
|||||||||
1,3842 |
24,9772 |
0,30597 |
0,054464 |
30,990299 |
|||||||||
1,3848 |
28,6324 |
0,35075 |
0,061436 |
34,957312 |
|||||||||
1,3867 |
40,2072 |
0,49254 |
0,082114 |
46,722766 |
|||||||||
1,3882 |
49,3452 |
0,60448 |
0,097082 |
55,239449 |
|||||||||
1,3890 |
54,2188 |
0,66418 |
0,104624 |
59,531250 |
|||||||||
1,3901 |
60,9200 |
0,74627 |
0,114535 |
65,170609 |
|||||||||
1,3914 |
68,8396 |
0,84328 |
0,125611 |
71,472739 |
|||||||||
1,3919 |
71,8856 |
0,88060 |
0,129699 |
73,798847 |
|||||||||
1,3921 |
73,1040 |
0,89552 |
0,131309 |
74,714758 |
|||||||||
1,3921 |
73,1040 |
0,89552 |
0,131309 |
74,714758 |
|||||||||
1,3924 |
74,9316 |
0,91791 |
0,133697 |
76,073398 |
|||||||||
1,3930 |
78,5868 |
0,96269 |
0,138378 |
78,737184 |
|||||||||
1,3932 |
79,8052 |
0,97761 |
0,139911 |
79,609643 |
|||||||||
Tabela |
4. |
Wyniki obliczeń do punktu 5.7 |
||||||
|
|
|
|
|
|
|
||
0,000 |
0,0000 |
1,7532 |
1,3241 |
-0,2230 |
4,4837 |
|
||
0,500 |
0,4988 |
1,7448 |
1,3209 |
0,1541 |
2,8913 |
|
||
1,000 |
0,9976 |
1,7364 |
1,3177 |
0,5322 |
2,1377 |
|
||
2,000 |
1,9952 |
1,7197 |
1,3114 |
1,2911 |
1,4106 |
|
||
3,000 |
2,9928 |
1,7029 |
1,3049 |
2,0537 |
1,0568 |
|
||
4,082 |
4,0718 |
1,6848 |
1,2980 |
2,8828 |
0,8341 |
<-- dla 0,05C0 |
||
5,000 |
4,9880 |
1,6694 |
1,2920 |
3,5903 |
0,7093 |
|
||
6,000 |
5,9856 |
1,6526 |
1,2855 |
4,3643 |
0,6114 |
|
||
7,000 |
6,9832 |
1,6359 |
1,2790 |
5,1423 |
0,5383 |
|
||
8,000 |
7,9808 |
1,6191 |
1,2724 |
5,9243 |
0,4818 |
|
||
10,000 |
9,9760 |
1,5856 |
1,2592 |
7,5005 |
0,4001 |
|
||
12,000 |
11,9712 |
1,5521 |
1,2458 |
9,0935 |
0,3441 |
|
||
14,000 |
13,9664 |
1,5185 |
1,2323 |
10,7037 |
0,3034 |
|
||
18,000 |
17,9568 |
1,4515 |
1,2048 |
13,9785 |
0,2487 |
|
||
22,000 |
21,9472 |
1,3845 |
1,1766 |
17,3298 |
0,2141 |
|
||
26,000 |
25,9376 |
1,3174 |
1,1478 |
20,7633 |
0,1910 |
|
||
30,000 |
29,9280 |
1,2504 |
1,1182 |
24,2852 |
0,1750 |
|
||
38,000 |
37,9088 |
1,1163 |
1,0566 |
31,6247 |
0,1569 |
|
||
46,000 |
45,8896 |
0,9822 |
0,9911 |
39,4199 |
0,1520 |
|
||
54,000 |
53,8704 |
0,8481 |
0,9209 |
47,7679 |
0,1605 |
|
||
58,000 |
57,8608 |
0,7811 |
0,8838 |
52,1900 |
0,1721 |
|
||
62,000 |
61,8512 |
0,7141 |
0,8450 |
56,8063 |
0,1925 |
|
||
66,000 |
65,8416 |
0,6470 |
0,8044 |
61,6449 |
0,2296 |
|
||
68,000 |
67,8368 |
0,6135 |
0,7833 |
64,1583 |
0,2603 |
|
||
70,000 |
69,8320 |
0,5800 |
0,7616 |
66,7413 |
0,3069 |
|
||
72,000 |
71,8272 |
0,5465 |
0,7392 |
69,4002 |
0,3846 |
|
||
73,000 |
72,8248 |
0,5297 |
0,7278 |
70,7602 |
0,4465 |
|
||
74,000 |
73,8224 |
0,5130 |
0,7162 |
72,1419 |
0,5382 |
|
||
75,000 |
74,8200 |
0,4962 |
0,7044 |
73,5463 |
0,6879 |
|
||
76,000 |
75,8176 |
0,4794 |
0,6924 |
74,9747 |
0,9753 |
|
||
77,000 |
76,8152 |
0,4627 |
0,6802 |
76,4283 |
1,7492 |
|
||
77,550 |
77,3639 |
0,4535 |
0,6734 |
77,2390 |
3,2154 |
<-- dla 0,95C0 |
||
77,650 |
77,4636 |
0,4518 |
0,6721 |
77,3873 |
3,8064 |
|
||
77,750 |
77,5634 |
0,4501 |
0,6709 |
77,5358 |
4,6694 |
|
||
6. Omówienie wyników, wnioski
6.1 Podstawy teoretyczne
Adsorpcja to zjawisko oraz proces zmiany stężenia (substancji w stanie ciekłym lub w roztworze) lub ciśnienia (w fazie gazowej) pojawiające się na granicy pomiędzy dwiema fazami - gazową i ciekłą, ciekłą i stałą oraz pomiędzy nie mieszającymi się cieczami. Najczęściej terminem adsorpcja określa się proces wiązania substancji gazowej na powierzchni substancji ciekłej lub stałej, lub też proces wiązania substancji ciekłej na powierzchni substancji stałej.
Adsorpcja może mieć charakter chemiczny (chemisorpcja - reakcja chemiczna) lub fizyczny (adsorpcja fizyczna). Adsorpcja ma charakter powierzchniowy, czym różni się od absorpcji polegającej na pochłanianiu adsorbatu w całej objętości adsorbentu. Zjawisko może mieć różny charakter ze względu na sposób gromadzenia się adsorbatu. Chemisorpcja jest z reguły monowarstwowa (czyli jednowarstwowy), a adsorpcja par przy ciśnieniu bliskim ciśnieniu pary nasyconej, gdy następuje samorzutna kondensacja pary to proces wielowarstwowy (poliwarstwowy).
Przykłady zastosowania adsorpcji:
pochłanianie zapachów przez filtr węglowy w lodówce lub samochodzie,
pochłanianie toksyn przez węgiel medyczny z przewodu pokarmowego pacjenta
oczyszczanie gazów przemysłowych i ścieków
Typowe metody pomiaru adsorpcji opierają się o analizę bilansu masy (bilansu materiałowego) - obserwując zmianę stężenia lub ciśnienia adsorbatu w "fazie objętościowej" określamy jaka ilość adsorbatu przemieściła się do lub z adsorbentu.
Do opisu stanu równowagi adsorpcyjnej stosuje się najczęściej tzw. równania izoterm adsorpcji (rys. 3) określające charakter zależności zaadsorbowanej ilości adsorbatu od jego ciśnienia lub stężenia przy zachowaniu stałości temperatury.
Proces adsorpcji zachodzi z pewną ograniczoną szybkością, zatem spadek stężenia tego składnika w roztworze zachodzi na pewnej wysokości złoża nazywanej frontem adsorpcji (6). Na powierzchni adsorbentu może być związana określona ilość cząsteczek, zatem w miarę wysycania kolejnych partii złoża, front adsorpcji przesuwa się wzdłuż wysokości warstwy zgodnie z kierunkiem przepływu mieszaniny, aż w końcu na wylocie z adsorbera w mieszaninie ciekłej pojawia się składnik adsorbowany.
6.2 Wyniki doświadczalne
Wyznaczona aktywność dynamiczna złoża (10) jest mniejsza niż aktywność równowagowa odpowiadającą stężeniu substancji w surowcu C0, zgodnie z zależnością:
ad < a*(Co)
0
2
0,95
τ(0,05)=618,1 s
τ(0,95)=3510,3 s
τ(0,95)
0,05
τ(0,05)
![]()
A1
F,L
A1=987,113 m2
A2=1615,894 m2
A2
Wyszukiwarka