 | Pobierz cały dokument potencjal.standardowy.elektrody.studia.doc Rozmiar 496 KB |
Robert Maniura
Sprawozdanie z ćwiczenia nr 2: Potencjał standardowy elektrody.
Wstęp teoretyczny:
Standardowy potencjał elektrody jest to SEM ogniwa zbudowanego ze standardowej elektrody wodorowej oraz standardowej elektrody badanej. Standardową elektrodę wodorową stanowi blaszka platynowa pokryta czernią platynową zanurzona w roztworze o stężeniu [H+]= 1 mol/dm3, i omywana gazowym wodorem pod ciśnieniem 1013 hPa. Standardowa elektroda badana- reagenty znajdują się w swoich stanach standardowych, czyli roztwór o stężeniu 1 mol/dm3 (dla gazów ciśnienie 1013 hPa), w dowolnej lecz określonej temperaturze (np. 25oC).
Standardowa elektroda wodorowa stanowi elektrodę lewą- jest elektrodą odniesienia. Umownie przyjęto potencjał standardowej elektrody wodorowej równy 0. W stosunku do potencjału normalnej elektrody wodorowej można określić potencjały badanych elektrod. Potencjał badanego półogniwa przyjmuje się:
-za dodatni jeżeli półogniwo SPW stanowi biegun ujemny (zachodzi proces utleniania: H2 2 H+ + 2 e)
-za ujemny gdy SPW jest biegunem dodatnim ( zachodzi proces redukcji: 2 H+ + 2 e H2 ) .
Wartość potencjału standardowego jest miarą aktywności chemicznej metali; metal jest tym aktywniejszy im wyższą ujemną wartość ma jego potencjał standardowy. Metale szlachetne mają dodatni potencjał standardowy. Przez uporządkowanie metali w kolejności wzrastających potencjałów otrzymuje się szereg elektrochemiczny metali.
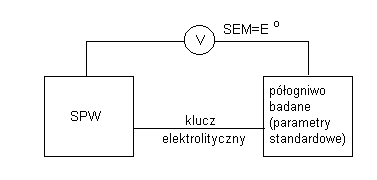
W celu wyznaczenia standardowych potencjałów elektrodowych można wykorzystać SEM dowolnego ogniwa zawierającego reagenty w stanach standardowych. W takim przypadku jedno z półogniw takiego ogniwa traktuje się jako
wzorcowe (o znanej wartości potencjału standardowego).
Opracowanie wyników:
Wyznaczenie potencjału standardowego elektrody żelazowo - żelazawej dokonałem poprzez pomiar siły elektromotorycznej ogniwa zbudowanego z półogniwa oksydacyjno - redukcyjnego - platyna zanurzona do roztworu jonów Fe2+ i Fe3+ - i elektrody odniesienia. Elektrodę odniesienia stanowiła elektroda chlorosrebrowa.
Reakcję przebiegającą w półogniwie oksydacyjno - redukcyjnym można przedstawić schematycznie: utleniacz + ne = reduktor. Potencjał elektrody oksydacyjno - redukcyjnej wyrazi się za pomocą równania:
![]()
Badane ogniwo można przedstawić schematem:
- Ag,AgCl(s)|Cl- || Fe +3, Fe +2 |Pt +
Lewa elektroda: Ag + Cl - AgCl + e E chlor = 0,222
Prawa elektroda: Fe +3 + e Fe +2 EFe+2/Fe+3
![]()
Wyznaczam potencjał E:
Echlor = 0.222 V (elektroda chlorosrebrowa ); T = 220 C = 295,15 [K]
Fe2+ : Fe3+ |
|
|
||
1 : 9 |
-0,503 |
E = 0,222+0,503 = 0,725
Podobne podstrony: więcej podobnych podstron |