Prelekcja I:
Podstawowe określenia:
Genotyp - to materiał genetyczny danej osoby uporządkowany w charakterystyczny układ alleli
Fenotyp - to końcowy efekt działania czynników genetycznych i środowiskowych, ujawniający się w postaci określonego obrazu klinicznego lub obserwowanej ekspresji genu. Badania korelacji genotypowo-fenotypowej służą do oceny i powiązania obrazu klinicznego choroby ze specyficzną mutacją genu.
Jeżeli allele w tym samym locus są identyczne, to osobę z takim układem nazywa się homozygotą. Oba allele mogą być prawidłowe lub nieprawidłowe.
Jeżeli allele w tym samym locus są różne to osobę z takim układem nazywa się heterozygotą. Określenie to odnosi się zazwyczaj do sytuacji posiadania jednego prawidłowego i jednego nieprawidłowego lub zmutowanego allelu. Takie heterozygotyczne osoby nazywane są nosicielami.
Pojęcie „autosomalny” odnosi się do chromosomów (autosomów) nie będących chromosomami płciowymi. O cechach dziedziczonych autosomalnie mówi się, gdy są one uwarunkowane genami zlokalizowanymi w autosomach.
Sprzężenie z chromosomami X i Y odnosi się do genów mających loci na chromosomie X lub Y. Z allelami sprzężonymi z chromosomami X związane jest dziedziczenie dominujące lub recesywne. Określenie sprzężenie z płcią jest synonimem używanym do przedstawienia dziedziczenia sprzężonego z chromosomem X.
Cechy uwarunkowane dominująco występują zarówno u heterozygot, jak i homozygot. Oznacza to, że obecność pojedynczego allelu danego genu wystarcza do ujawnienia się cech.
Cechy uwarunkowane recesywnie występują tylko u homozygot, co oznacza, że do ich wystąpienia konieczna jest obecność alleli recesywnych w obu chromosomach. Pojęcia dominacji i recesywności dotyczą obrazu klinicznego, a nie samych genów.
Dziedziczenia autosomalne dominujące:
Ponad połowa opisanych dotychczas cech jest dziedziczona dominująco: około 1/3, a 1/10 jako cechy sprzężone z chromosomem X. Pojęcie choroby dziedziczonej dominująco oznacza, że pojedynczy allel danej choroby ( jak u heterozygoty) wystarcza do ujawnienia się jej objawów.
Kryteria dziedziczenia autosomalnego dominującego są następujące:
dana cecha przekazywana jest bez przeskoków z pokolenia na pokolenie.
przy skojarzeniu osoby chorej (heterozygoty) ze zdrową homozygotą (najczęściej występująca sytuacja) każde dziecko ma 50% ryzyka dziedziczenia zmutowanego allelu prawidłowego.
osoby obu płci chorują z jednakową częstością
Dziedziczenia autosomalne dominujące - cechy kliniczne:
Nowa mutacja:
Nowe mutacje są najczęściej przyczyną chorób o tak ciężkim przebiegu, że zmniejszają zdolność do reprodukcji. Większość przypadków achondroplazji jest wynikiem nowej mutacji.
Późny wiek ojca może być związany ze zwiększeniem częstości nowych mutacji w niektórych loci.
Częstość występowania nowych mutacji w niektórych chorobach dziedziczonych dominująco jest znana i wykorzystywana w poradnictwie genetycznym:
zmniejszona penetracja - jeśli częstość ekspresji fenotypowej danego genotypu jest mniejsza niż 100%, to mówi się o obniżonej penetracji. O braku penetracji mówi się , gdy dany allel dziedziczony, lecz nie wykazuje ekspresji fenotypowej.
zmniejszona ekspresja - ekspresja jest zmniejszona w zależności od tego, w jakiej postaci klinicznej lub w jakim stopniu poszczególny allel ujawnia się w fenotypie danej osoby.
Nowa mutacja:
Zmienność ekspresji jest powszechna w choroabach dziedziczonych dominująco.
Osoby chore, lecz zdolne do reprodukcji, wykazują zwykle mniejsze nasilenie objawów choroby.
Przykłady kliniczne:
Choroba Huntingtona
Zespół Marfana
Dziedziczenie autosomalne recesywne:
W tym typie dziedziczenia charakterystyczny fenotyp obserwuje się tylko u homozygot, a wtypowym rodowodzie występuje obok probanta chore rodzeństwo obu płci oraz ich zdrowi rodzice.
Dziedziczenie recesywne podejrzewa się, jeśli rodzice są spokrewnieni, i uważa się za pewne, jeśli stwierdza się niski poziom lub brak aktywności określonego enzymu u każdego z obojga rodziców probanta.
Kryteria:
jeśli cecha jest rzadka, rodzice i krewni, w odróżnieniu od potomstwa są zazwyczaj zdrowi.
jeśli recesywne geny są heterozygotami, to częstość segregacji w każdej ciąży wynosi 25% zdrowych homozygot, 50% heterozygot i 25% chorych homozygot.
choroba występuje z jednakową częstością u oby płci
jeśli cecha jest rzadka to istnieje duże prawdopodobieństwo, że rodzice są spokrewnieni.
Cechy charakterystyczne:
częstość występowania heterozygot w populacji. Chore osoby są prawie zawsze potomkami zdrowych heterozygot (nie homozygot).
nosicielstwo. Nosiciele to osoby zdrowe lecz u n iektórych z nich występuje obniżenie o połowę w stosunku do normy aktywności określonego enzymu.
Przykłady kliniczne:
Galaktozemia
Homocystynuria
Mukowiscydoza
Dziedziczenie sprzężone z chromosomem X:
Może być zarówno recesywne i dominujące.
Objawy choroby dziedziczonej recesywnie w sprzężeniu z chromosomem X obserwuje się tylko u mężczyzn.
Dziedziczenie sprzężone chromosomem X podejrzewa się, jeśli dana cecha występuje u kilku mężczyzn spokrewnionych poprzez kobiety. Ponieważ mężczyźni mają tylko jeden chromosom X, są zatem homozygotami dla genów sprzężonych z chromosomami X
Kryteria:
jeśli cecha jest rzadka, rodzice i krewni (wyłączając wujów ze strony matki i innych męskich krewnych w linii kobiecej) są zazwyczaj zdrowi.
chorzy homozygotyczni mężczyźni nie mają ani chorych synów, ani chorych córek.
heterozygotyczne kobiety nosicielki są klinicznie zdrowe, lecz przekazują zmutowany gen 50% męskiego potomstwa. 50% córek to zdrowe heterozygoty a 50% zdrowe homozygoty.
chore córki są najczęściej potomstwem heterozygotycznej kobiety i chorego mężczyzny
każdy chory mężczyzna jest urodzony przez heterozygotyczną kobietę (z wyjątkiem nowych mutacji)
jeśli cecha jest dominująca to wszystkie córki chorego mężczyzny są chore.
Przykłady kliniczne
Dystrofia mięśniowa Duchenne'a (DMD)
Zespół leniwego chromosomu X [fra(X)]
Dziedziczenie mitochondrialne:
Ludzkie komórki mają setki mitochondriów rozpoznanych w cytoplazmie, z których każde zawiera pewną liczbę kolistych cząstek DNA
Mutacje mitochondrialne DNA są odpowiedzialne za niewielką liczbę schorzeń genetycznych.
Kryteria:
Każde mitochondrium zawiera pewną liczbę kopii kolistego genomu.
Niemal cały mitochondrialny DNA jest dziedziczony od matki
Określone tkanki mają różnż liczbę mitochondriów.
Duże rearanżacje genowe:
Delecje są łatwo wykrywane dzięki technologii rekombinacji DNA przez stwierdzenie nieobecności lub zmianę wielkości fragmentu DNA. Delecje genowe, z wyjątkiem kilku zespołów są rzadkimi przyczynami mutacji w ludzkim genomie.
Duplikacje sekwencji DNA są powszecjne w procesie ewolucji i mogą być spowodowane nieprawidłowym procesem koniugacji homologicznych sekwencji DNA położonych blisko siebie, z duplikacją materiału genetycznego, który jest zawarty wewnątrz genu. Mechanizm duplikacji jest podobny do obserwowanego w balasemii. Duplikacje mogą zmienić ramkę odczytu. Rodzinna hipercholesterolemia i DMD są przykładami chorób genetycznych, które mogą być spowodowane duplikacjami.
Insercje są rzadkimi przyczynami mutacji w ludzkim genomie. Transpozycja DNA jest jednak zjawiskiem powszechnym w ludzkim genomie, lecz zwykle nie obejmuje sekwencji kodujących. Transpozycja może niekiedy przerwać ciągłość genomu i być przyczyną nieprawidłowej ekspresji uszkodzonego genu.
Mutacje punktowe. Zastąpienie pojedynczego nukleotydu, podobnie jak obserwowane u bakterii i wirusów, jest najczęstszą przyczyną mutacji w ludzkim genomie. Jeśli w kodonie dojdzie do zmiany pojedynczego nukleotydu, to powstałe punktowe mutacje nazywa się mutacjami zmiany sensu. Zaburzenia, które są skutkiem różnych mutacji punktowych, to np. beta-talasemia, mukowiscydoza, fenyloketonuria i zespół Taya-Sachsa.
Mutacje transkrypcyjne:
Mogą wystąpić w obszarze od 5' końca początku kodonu inicjującego w sekwencji DNA.
Miejsce to jest krytyczne dla regulacji transkrypcji.
Przykładem mogą być różne mutacje znalezione w sekwencji TATA, regionie zlokalizowanym około 30 nukleotydów w kierunku końca 5' od kodonu inicjującego.
Ważną rolę w regulacji transkrypcji odgrywają także reszty na 3' końcu genu beta-globiny. Mutacje w tych dystalnych elementach promotora mogą być przyczyną obniżenia aktywności transkrypcyjnej i spadkiem produkcji białka beta-globiny.
Mutacje translacyjne:
Mutacje uszkadzające translację obserwowane są czasem w talasemii. Opisane zostały także w innych chorobach takich jak fenyloketonuria.
Mutacje nonsensowne
Mutacje zmiany ramki odczytu.
Mutacje RNA:
Mutacje procesu cięcia RNA i jego stabilności mogą spowodować nieodpowiednie cięcie wytwarzanego RNA w sekwencjach w kierunku do końca 3'. Wynikiem tego jest powstanie RNA, który jest nienormalnie duży, niestabilny i szybko ulega degradacji.
Mutacje procesu składania RNA.
Mutacje dynamiczne:
W ostatnich latach opisano nowy mechanizm powstawania mutacji u ludzi, spowodowany wzrostem liczby trójnukleotydowych sekwencji powtarzalnych w genie. Trój nukleotydy te mogą znajdować się w nie ulegającym translacji regionie 5' genu, w regionie kodującym genu lub w nie ulegającym translacji regionie 3' genu.
Negatywne mutacje dominujące:
Mutacja jednego z alleli w danym locus może dać efekt dominujący, jeśli obecność tylko jednego funkcjonalnie prawidłowego allelu jest niewystarczająca do wytworzenia odpowiedniej ilości produktu tego genu. Hipercholesterolemia rodzinna jest chorobą będącą przykładem takiej mutacji.
Polimorfizm genetyczny
Polimorfizm i markery genetyczne
Definicje
Polimorfizm genetyczny - oznacza występowanie w populacji dwóch lub więcej alleli w danym locus z częstością większą niż wynikająca z ogólnej częstości mutacji. Polimorfizm to zrównoważenie genetyczne warunkujące zmienność wewnątrz gatunku.
Polimorfizm. Wszystkie odmiany polimorfizmu są efektem zmian zachodzących w sekwencji DNA, które mogą być wykryte metodami biologii molekularnej. Polimorfizm można również wykazać w badaniach białek o zmienionej funkcji, enzymów lub antygenów oraz nieprawidłowych cech fizycznych organizmu. Polimorfizm może być zatem klasyfikowany zależnie od metody jego wykrycia.
Polimorfizm DNA - jest identyfikowany poprzez bezpośrednie wykrycie zmienionych sekwencji DNA.
Polimorfizm długości fragmentów restrykcyjnych (RFLP) - polimorfizm krótkich tandemowych powtórzeń (STRP)
Znaczenie kliniczne polimorfizmu:
Większość rodzajów polimorfizmu nie wpływa na cechy kliniczne fenolu.
Bez względu na ich efekt fenotypowy są one użytecznymi markerami genetycznymi.
Markery genetyczne:
Markery genetyczne mogą być wykorzystane do określenia prawdopodobieństwa asocjacji genów choroby w rodzinie lub u pojedynczych chorych, a także do ustalenia pokrewieństwa oraz genetycznej zgodności krwi, nasienia czy tkanki.
Bliźnięta. Z genetycznego punktu widzenia istnieją dwa rodzaje bliźniąt:
Jednojajowe (MZ) lub identyczne bliźnięta mają wszystkie geny takie same. Pochodzą z jednej zygoty, która dzieli się na dwa embriony.
Dwujajowe (DZ) lub braterskie bliźnięta mają około połowy genów takich samych. Rozwijają się z dwóch oddzielnych zygot i są tak samo genetycznie spokrewnione, jak z pozostałym rodzeństwem.
Markery genetyczne:
Ustalenie ojcostwa:
Ustalenie ojcostwa wymaga pobrania próbek od dziecka, matki i domniemanego ojca.
Badania z zastosowaniem markerów genetycznych mogą wykluczyć, ale nie udowodnić ojcostwo. Są dwie możliwości wykluczenia ojcostwa:
ojcostwo jest wykluczone jeśli żaden z dwóch alleli danego locus u domniemanego ojca nie występuje u dziecka
ojcostwo jest wykluczenie, jeśli u domniemanego ojca brakuje allelu, który jest obecny u dziecka, a nie m ago u matki.
Im więcej markerów zostanie przebadanych i mniej wspólnych alleli ustalonych, tym bardziej prawdopodobne, że ojcostwo danego mężczyzny będzie wykluczone.
Prawdopodobieństwo ojcostwa może być obliczone na podstawie liczby przebadanych markerów oraz częstości alleli, dla których dziecko jest informacyjne. Za pomocą techniki DNA fingerprinting, pozwalającej badać szczególnie polimorficzne markery prawdopodobieństwo ojcostwa, które jest bardzo wysokie, można zazwyczaj uzyskać, kiedy porównanie dotyczy dziecka i jego biologicznego ojca.
Zastosowanie markerów genetycznych w sądownictwie obejmuje ponadto:
określenie pochodzenia krwi, nasienia lub próbek tkanek uzyskanych na miejscu przestępstwa
małe ilości DNA mogą być użyte do określenia markerów genetycznych charakterystycznych dla ofiary lub podejrzanego
identyfikacja zaginionych osób, w celu ustalenia rzeczywistego pokrewieństwa biologicznego markery genetyczne osoby zaginionej można pobrać z markeru jej rodziców i innych członków rodziny
Sprzężenie i mapowanie:
Sprzężenie to występowanie dwóch lub więcej loci genowych w tak bliskiej odległości fizycznej w chromosomie, że bardziej prawdopodobne jest przekazanie ich razem niż oddzielnie podczas mejozy.
Sprzężenie loci występuje, gdy położone są one w niewielkiej odległości od siebie i crossing over zachodzi między nimi rzadko.
Mapowanie genów:
Jest przyporządkowaniem genów od określonego miejsca w chromosomie.
Ponad 6000 loci genetycznych zostało zmapowanych w poszczególnych chromosomach człowieka.
Większość z tych loci to polimorfizmy krótkich tandemowych powtórzeń, które są idealnymi markerami ze względu na ich olbrzymi polimorfizm i łatwość w badaniach za pomocą reakcji łańcuchowej polimerazy PCR .
Powyższe badanie obejmuje ponad 450 genów.
Przeciętna odległość miedzy mapowanymi markerami wynosi mniej niż 1cM.
Wiele kolejnych loci mapuje się na bieżąco w ramach Projektu Badania Genomu Człowieka.
Znanych jest kilka metod mapowania genów:
badania rodzinne
Istnieje wiele rodzajów map genetycznych zawierających różne, ale uzupełniające się informacje. Przybliżona ich kolejność w skali wzrastającej dokładności jest następująca:
mapa cytogenetyczna
mapa sprzężeń
mapa fizyczna
sekwencja DNA
Korelacja genotyp-fenotyp:
Korelacja genotyp-fenotyp jest związkiem specyficznych zmian w genomie z charakterystycznymi objawami klinicznymi choroby genetycznej.
Wiele chorób genetycznych wykazuje istotną różnorodność w ekspresji czy niekompletnej penetracji.
Przyczyny takich różnic zależą od rodzaju choroby i są zróżnicowane międzyosobniczo.
Prawdopodobne przyczyny tej klinicznej zmienności objawów obejmują:
heterogenność locus
heterogenność alleli
somatyczne zmiany zmutowanego allelu
efekty epistatyczne
efekty epigeniczne
czynniki pozagenetyczne.
Genetyka molekularna chorób serca i naczyń:
W ostatnich dziesięcioleciach dokonał się znaczny postęp w rozumieniu, jaką rolę odgrywają czynniki dziedziczne w procesach patologii człowieka, w tym również w chorobach układu sercowo-naczyniowego.
Choroby układu krążenia rozwijają się na skutek czynników wrodzonych ( choroba obecna przy urodzeniu) lub nabytych, zależnych głównie od naszego trybu życia, Choroby genetyczne serca, inaczej dziedziczne, to zaburzenia wrodzone powstające na tle nieprawidłowości genetycznych.
Choroby genetyczne mogą być wynikiem nieprawidłowości pojedynczego genu - tu rozróżniamy geny dominujące (wystarczy jeden gen do ujawnienia choroby) i geny recesywne ( potrzebny komplet dwóch wadliwych genów do pełnego ujawnienia choroby).
Nieprawidłowe geny mogą być związane z chromosomem X lub Y albo z pozostałymi ( autosomalne).
Jednogenowe choroby genetyczne serca to m.in. kardiomiopatia (przerostowa, rozstrzeniowa), kanałopatie ( zespół wydłużonego i skróconego QT, zespół Brugadów), choroby spichrzeniowe (choroba Pimpego, Fabry'ego), zespół Marfana, choroba węzła zatokowego, hipercholesterolemia rodzinna i inne.
Prelekcja II:
Genetyka molekularna chorób serca i naczyń:
Choroby układu krążenia rozwijają się na wskutek czynników wrodzonych (choroba obecna przy urodzeniu) lub nabytych, zależnych głównie od naszego trybu życia. Choroby genetyczne serca, inaczej dziedziczone to zaburzenia wrodzone powstające na tle nieprawidłowości genetycznych.
Choroby genetyczne mogą być wynikiem nieprawidłowości pojedynczego genu - tu rozróżniamy geny dominujące (wystarczy jeden do ujawnienia choroby) i geny recesywne (potrzeba komplet dwóch wadliwych genów do pełnego ujawnienia się choroby).
Nieprawidłowe geny mogą być związane z chromosomem X lub Y albo z pozostałymi.
Jednogenowe choroby genetyczne serca to m.in. kardiomiopatia (Przerostowa, rozstrzeniowa), kanałopatie (zespół wydłużonego, skróconego QT, zespół Brugadów), choroby spichrzeniowe ( choroba Pompego, Fabry'ego) zespół Marfana, choroba węzła zatokowego, hipercholesterolemia rodzinna i inne.
Choroby genetyczne serca mogą się ujawnić już przy urodzeniu, w czasie dorastania lub dopiero w wieku dorosłym. W niektórych przypadkach nie dochodzi do ujawnienia się choroby. Zależne jest to od typu defektu, ale także od wpływu dodatkowych czynników genetycznych i środowiskowych.
Choroby genetyczne serca związane są często z trudną i kosztowną diagnostyką. W wielu przypadkach choroba nasila się z wiekiem i możne prowadzić do rozwoju niewydolności serca lub/i przedwczesnej śmierci.
Choroby genetyczne serca niosą ze sobą ryzyko nagłej śmierci sercowej w w przebiegu groźniej arytmii lub pęknięcia aorty. Dlatego przy rozpoznaniu choroby uwarunkowanej genetycznie bardzo ważna jest ocena ryzyka wystąpienia takiego powikłania.
Chorym w dobrym stanie z wysokim ryzykiem można zaproponować zabiegowe postępowanie zapobiegawcze - wszczepienie kardiowertera w przypadku arytmii czy profilaktyczną operację aorty w zespole Marfana.
Jednogenowe schorzenia układu sercowo naczyniowego. Kardiomiopatia przerostowa:
Kardiomiopatia przerostowa jest jedną z najczęstszych chorób genetycznych w kardiologii i najczęstsza przyczyną nagłego zgonu wśród dzieci i młodych dorosłych.
Częstość występowania tej patologii ocenia się na ok 1 zachorowanie na 500 osób
Kardiomiopatia przerostowa dziedziczy się najczęściej jako cecha autosomalna dominująca, rzadziej jako cecha autosomalna recesywna sprzężona z chromosomem X lub choroba wynikająca z zaburzeń DNA mitochondrialnego.
Schorzenie to spowodowane jest przez mutacje genów związanych głównie z białkami aparatu kurczliwego mięśnia sercowego
Genetycy odkryli liczne mutacje genów przynajmniej 10 różnych elementów białek sarkomeru, takich jak łańcuch ciężki sercowej beta-miozyny, sercowe białko wiążące miozynę, sercowa troponina T, sercowa troponina I, alfa-tropomiozyna, sercowe białko C i regulatorowe łańcuchy lekkie oraz sercowa aktyna.
Poza typowymi zmianami sercowymi obserwowano w tych rzadkich przypadkach np. dodatkowe szlaki przewodzenia prowadzące do współwystępowania zespołu Wolffa-Parkinsona-White'a, głuchotę czuciowo - nerowową, neurologiczne napięcia mięśni tułowia i encefalopatię.
Na obraz patologiczny kardiomiopatii przerostowej składa się przede wszystkim znaczny przerost lewej komory serca, pogrubienie przegrody międzykomorowej, powiększenie lewego przedsionka i zwykle mała jama komory lewej
Przerost i dezorganizacja w układzie miocytów oraz włóknienie śródmiąższowe występuje w całym mięśniu sercowym
Badania polimorfizmów genów kodujących angiotensynę II, aldosteron i endotelinę, które mogą modyfikować fenotyp kardiomiopatii przerostowej nie przyniosły jednoznacznych wyników.
Geny, których mutacje najczyściej związane są z kardiomiopatią przerostową:
Gen |
Częstośc mutacji % |
Obraz kliniczny i rokowanie |
MYH7 łańcuch ciężki beta-miozyny |
35-50 |
Mutacje R403Q ( często łącznie z R719W i R453C) - niekorzystne rokowanie Mutacje V1606M, L908V, G256Q, P513C - rokowanie dobre |
MYBPC3 |
30-47 |
Późne objawy kliniczne, duże ryzyko zgonu w wyniku arytmii |
TNNT2 |
6.05.2015 |
Łagodny przerost, duże ryzyko nagłego zgonu w wyniku arytmii |
TMP1 |
3.05.2010 |
Pośredni i niejednorodny poziom przerostu |
TMP1 alfa-tropomiozyny |
|
Współwystępowanie przerostu z zespołem WPW, rzadko występowanie rodzinne |
Geny których mutacje najczęściej związane są z kardiomiopatią rozstrzeniowią:
Do najczęstszych przyczyn rozstrzeni komór należą:
choroba wieńcowa,
przebyty zawał serca
wady zastawkowe
nadciśnienie tętnicze
zapalenie mięśnia sercowego i choroby układowe
Jednak w niektórych przypadkach identyfikacja czynnika sprawczego jest niemożliwa. Choroba określana jest wtedy jako kardiomiopatia idiomatyczna.
Niekóre z tych przypadków mają podłoże genetyczne i występują w sposób rodzinny lub sporadyczny. Kardiomiopatii rozstrzeniową dziedziczy się najczęściej w sposób autosomalny dominujący, ale występują też przypadki dziedziczenia autosomalnego recesywnego związanego z mitochondrialnym DNA i sprzężonego z chromosomem X
Białka szkieletu komórkowego |
|
DES (desmina) |
Kardiomiopatii mogą towarzyszyć miopatia szkieletowa, bloki przewodzenia w sercu, zaburzenia rytmu |
SGCD, SGCB |
Czysta postać kardiomiopatii kub w przypadku SGCB dziedziczona autosomalnie recesywnie ciężka odmiana dystrofii mięśniowej |
DMD |
Postać sprzężona z chromosomem X, małe stężenie dystrofiny sercowej przy prawidłowych poziomach dystrofiny mięśni szkieletowych |
Białka Połączeń międzykomórkowych |
|
VCL (winkulina), DSP, CSRP3 |
Kardiomiopatia jest skutkiem zaburzenia interakcji ??????????( kontakt zasłania :/ ) |
Kardiomiopatia rozstrzeniowa typu left ventricular non-conpaction:
Wynika ona z zahamowania biogenezy w mięśniu sercowym i charakteryzuje się przerostem lewej komory z głębokim beleczkowaniem i upośledzeniem czynności skurczowej ze współistniejącą często rozstrzenia.
Podobne zmiany mogą dotyczyć również prawej komory. Kardiomiopatia typu left ventricular non-conpation towarzyszą często różnego rodzaju wady wrodzone wady serca np. ubytki w przegrodzie między przedsionkowej lub międzykomorowej oraz zwężenie zastawki pnia płucnego.
Choroba może ujawnić się w niemowlęctwie lub w wieku późniejszym. Jej przebieg jest zwykle niekorzystny z szybko postępującą dysfunkcją lewej komory i jawną klinicznie niewydolnością serca
Zaburzenia rytmu serca:
Nagłe zgony związane z groźnymi zaburzeniami rytmu serca ze względu na ich wielką liczbę stanowią bardzo istotny problem kliniczny w kardiologii.
Czynniki genetyczne mogą modyfikować ryzyko arytmii związane z typowym podłożem patologicznym
Opisano geny sprzyjające zaburzeniom rytmu, co pozwoliło na pogłębienie wiedzy na temat molekularnego podłoża różnych typów tych zaburzeń.
Zespół wydłużonego odstępu QT:
Zespół wydłużonego odstępu QT (zespół LQT) jest wrodzoną chorobą arytmogenną objawiającą się przede wszystkim nieprawidłowym wydłużeniem okresu repolaryzacji, czyli odstępu QT, w powierzchniowym elektrokardiogramie, nieprawidłowym kształtem załamka T oraz groźnymi dla życia zaburzeniami rytmu serca.
Choroba występuje w strukturalnie prawidłowym sercu i jest związana z dużym ryzykiem nagłego zgonu. Pierwsze objawy choroby, omdlenia lub nagły zgon występują średnio w wieku 12 lat.
Opisano dwie główne formy fenotypowe choroby:
zespół Romano - Warda dziedziczony w sposób autosomalny dominujący oraz rzadziej występujący;
zespół Jervella - Langego - Nielsena dziedziczony w sposób autosomalny recesywny i współwystępujący z głuchotą czuciowo - nerwową;
Geny związane z występowaniem różnych postaci zespołu wydłużonego odstępu QT:
Kanał |
Gen (białko) |
Postacie choroby |
Częstość (%) |
Obraz kliniczny |
IKs |
KNCQ1 (KvLQT1) KCNE1 (MinK) |
LQT1 lub JLN1 LQT5 lub JLN2 |
50 2 - 3 |
LQT1 - zmniejszona penetracja, łagodniejszy przebieg, objawy wywołane bezpośrednio bodźcem adrenergicznym, zwykle występują w czasie wysiłku |
IKr |
KCNH2 (HERG) KCNE2 (MiRP) |
LQT2 LQT6 |
35 - 40 <1 |
LQT2 - większa penetracja i bardziej ciężki przebieg niż LQT1, zwłaszcza u kobiet, zaburzenia rytmu wyzwalane bodźcem dźwiękowym LQT6 - niepełna penetracja, łagodny przebieg |
INa |
SCN5A (Nav1.5) |
LQT3 |
10 - 15 |
Gorsze rokowanie, zwłaszcza u mężczyzn, zaburzenia rytmu występują w spoczynku |
|
ANK2 (ankrynina? B) |
LQT4 |
|
Towarzyszy bradykardia, napadowe migotanie przedsionków, wielofazowe załamki T |
ICa |
CACNA1c (Cav1.2) |
LQT8 Zespół Timothy-ego |
|
Znaczne wydłużenie QT, towarzyszy syndaktylia skórna, blok AV 2:1, wrodzone wady serca, opóźnienie umysłowe, autyzm, zaburzenia metaboliczne, duża śmiertelność |
Zespół skróconego odstępu QT:
Zespół ten został po raz pierwszy opisany stosunkowo niedawno, w 2000r.
Charakteryzuje się on nieprawidłowo krótkim okresem repolaryzacji objawiającym się w zapisie EKG odstępem QT < 300ms oraz wąskimi i spiczastymi załamkami T.
Klinicznie zespół ten objawia się napadowym migotaniem przedsionków, omdleniami i nagłym zgonem.
Pierwszym genem, którego mutacja została wskazana jako leżąca u podłoża tego zespołu, był KCNH2 kodujący białko HERG.
Opisana mutacja powoduje wzrost aktywności ośrodkowego prądu potasowego IKr.
Do tej pory opisano również mutacje w innych genach poza KCNH2 objawiające się fenotypem zespołu skróconego odstępu QT: KCNQ1, SCN5A, KCNE2, KCNJ2.
Zespół Brugadów:
Jest to wrodzona choroba arytmogenna występująca w prawidłowym strukturalnie sercu, dziedziczona w sposób autosomalny dominujący.
Wyraźnie częściej jest stwierdzana wśród mężczyzn niż u kobiet (8:1).
Zespół ten charakteryzuje się elektrokardiograficznie zupełnym lub niezupełnym blokiem prawej odnogi pęczka przedsionkowo - komorowego (Hisa) oraz uniesieniem odcinka ST w pierwszych trzech odprowadzeniach przedsercowych (V1 -V3) z występowaniem groźnych dla życia tachyarytmii komorowych.
Objawy kliniczne w postaci omdleń lub nagłego zatrzymania krążenia ujawniają się zwykle w 3 - 4 dekadzie życia i występują zwykle w spoczynku lub podczas snu.
W 20% przypadków podłożem molekularnym zespołu Brugadów jest mutacja w genie SCN5A kodującego białko Nav1.5, składową kanału sodowego.
W 80% przypadków udało się jedynie ustalić locus związane z zespołem Brugadów zlokalizowane na ramieniu krótkim 3 chromosomu (3p22-25), bez określenia genu odpowiedzialnego za chorobę.
Czynnościowo mutacje leżące u podłoża tego zespołu prowadzą do upośledzenia prądu sodowego
Rozpoznanie stawia się na podstawie wystąpienia nagłego zatrzymania krążenia (skutecznie reanimowanego), wywiadu rodzinnego (nagłe zgony w młodym wieku) oraz badania EKG.
Leczenia zespołu polega na zabezpieczeniu chorego przed nagłym zatrzymaniem krążenia. Wszczepia się kardiowerter-defibrylator.
Genetyka cukrzycy typu 1:
Skłonność do rozwoju cukrzycy typu 1 jest uwarunkowana dziedziczeniem wielogenowym
Analiza sprzężeń 767 rodzin multipleksowych potwierdziła znaczenie 7 regionów w genomie mających związek z cukrzycą t.1:
chromosom 6 - IDM1 [LOD=65,8](3)
chromosom 6 - IDDM15 [LOD=2,36 - 4,8](4)
chromosom 11 - IDDM2 w miejscu genu insuliny [LOD=4,28](5)
chromosom 1q42 - [LO=2,2](6)
chromosom 2 - IDDM12 w regionie genu CTLA - 4 [LOD=2,62 - 3,22](7)
chromosom 10 - IDM10 [LOD=2,8](8)
chromosom 20 - w miejscu D16S3098 [LOD=4,13](6)
Wyodrębnia się monogenowe formy cukrzycy t.1.
zespół autoimmunologicznej poliendokrynopatii typu 1
zespół XPI (X-linked poliendocrinopathy, immune dysfunction, diarrhea) związanych z chromosomem X
Mutacje dotyczące występowania tych zespołów dotyczą genów kodujących czynniki transkrypcyjne: AIRE (autoimmune regulator) na chromosomie 23 oraz FOX p3 na chromosomie X (33,34).
Genetyka cukrzycy typu 2:
Forma monogenowa:
konsekwencja rzadkich mutacji w pojedynczych genach; znane formy monogenowe cukrzycy t.2 charakteryzują się istotnym defektem w zakresie wydzielania insuliny bądź też głębokim upośledzeniem wrażliwości na insulinę;
Forma poligenowa:
obraz kliniczny tych form choroby wynika z interakcji czynników środowiskowych i genetycznych rozumianych jako wpływ wielu genów; allele polimorficznych genów są obecne zarówno u zdrowych jak i u chorych na cukrzycę, chociaż występują w tych grupach z różną częstością;
Monogenowe formy cukrzycy typu 2:
mutacje genu insuliny mogą prowadzić do powstania również monogenowych form cukrzycy typu 2
w nielicznych przypadkach wykazano, że mutacje mogą dotyczyć części kodującej genu
powodują one zmianę struktury insuliny i osłabienie lub zniesienie jej czynności
u osób z mutacją genu insuliny pojawia się nietolerancja glukozy, której towarzyszy hiperinsulinemia, prawidłowa insulinowrażliwość, bez współwystępujących zaburzeń immunologicznych
w rzadkich przypadkach mutacje mogą dotyczyć punktów uchwytu endopeptydaz przekształcających proinsulinę w insulinę
Monogenowe formy cukrzycy typu 2 z dominującą insulino opornością:
Mutacje w genie receptora insuliny są bardzo rzadkie. Insulinooporność w tym przypadku jest spowodowana mutacją w jednym lub dwóch allelach genu receptora insuliny
Krasnoludkowatość (leprechaunizm) - charakteryzuje się nasiloną insulinoopornością, cukrzycą, niższą masą urodzeniową, powolnym wzrostem. Zespół ten źle rokuje.
Zespół Robsona - Mendeholla. Ujawnia się klinicznie w okresie dzieciństwa. Charakteryzuje się szybkim wzrostem, hipertrofią paznokci i zębów, przedwczesnym dojrzewaniem oraz wzrostem szyszynki.
Zespół insulinooporności typu A - dotyczy młodych kobiet. Charakteryzuje się hiperandrogenizmem, zespołem policystycznych jajników oraz zmianami skórnymi o typie acanthosis nigricans (na slajdzie było acanthosis migricaus ale sprawdziłam w internecie i nie ma takiego czegoś, za to nigricans brzmi uderzająco podobnie…)
Poligenowe formy cukrzycy typu 2:
Kalpaina 10:
Zmniejsza uwalnianie insuliny pobudzane glukozą
Z drugiej strony inhibitory kalpainy hamują pobudzaną insuliną absorpcję w adipocytach i miocytach
Kalpainy zmniejszają również pobudzaną insuliną syntezę glikogenu w mięśniach. Niski poziom RNA dla kalpainy 10 w mięśniach prowadzi do narastania insulino oporności
Gen dla kalpainy 10 jest zlokalizowany na chromosomie 2q. Ryzyko zachorowania na cukrzycę typu 2 nie wiązało się z wariantem jednego polimorfizmu genu kalpainy, ale wynika raczej z obecności kilku niekorzystnych haplotypów tworzonych przez allele trzech SNP-ów o numerach: 19, 43 i 63. Wszystkie te SNP-y zlokalizowane są w intronach, a więc nie wpłyną na strukturę aminokwasową białka
Najprawdopodobniej mechanizmem patogenetycznym o podstawowym znaczeniu jest jej wpływ na ekspresję genu kalpainy 10. Znaczenie kalpainy 10 w patogenezie cukrzycy typu 2 jest różne w różnych populacjach
Peroksysomalny aktywowany proliferacyjnie receptor γ (peroximose proliferator activated receptor) PPAR - γ
Ostatnio opublikowane badania zarówno osób niespokrewnionych, jak i rodzin bezspornie udowodniły znaczenie polimorfizm allelu proliny Pro12Ala w patogenezie cukrzycy typu 2
Opublikowane dane pozwalają na powiązanie wariantu dziedziczenia Pro12 aminokwasu w PPARγ z patogenezą cukrzycy typu 2 (ryzyko rozwoju cukrzycy u osób homozygot Pro12Pro PPARγ zwiększa się o 25%)
Ponieważ allel ten występuje z dużą częstością, około 85%, jego umiarkowany efekt przekłada się na duże ryzyko odnoszące się do całej populacji i może odpowiadać aż za 25% przypadków cukrzycy typu 2
W ostatnim okresie zidentyfikowano również u chorych na cukrzycę typu 2 na chromosomie 10q region o podwyższonym ryzyku rozwoju tej choroby wykazano także linkage disequilibrium
W tym miejscu znajduje się gen czynnika transkrypcyjnego 7 jak 2 (transcription factor 7 like 2 - TCF7L2)
Jego obecność częściej spotyka się u chorych na cukrzycę typu 2
Znaczenie genu TCF7L2 w patogenezie cukrzycy typu 2 wiąże się z jego wpływem na drogę przekazu sygnałów typu Wingless - WNT
Droga WNT odgrywa z kolei znaczną rolę w regulacji proliferacyjnego różnicowania się komórek. WNT wiąże się ze swoim receptorem. W wyniku tego uwalniana jest β-katemina. β-katemina dostaje się do jądra, gdzie tworzy heterodimer z TCF7L2
Gen TCF7L2 ma wielkość 215,9 kb. Jest zlokalizowany na chromosomie 10q25. Zidentyfikowano mikrosatelitarny marker DG10S478 zlokalizowany w 3 intronie tego genu, który ściśle wiąże się z ryzykiem rozwoju cukrzycy typu 2. Wykazano to w badaniach przeprowadzonych wśród Irlandczyków, Duńczyków oraz w populacjach europejsko-amerykańskich. Autorzy zgenotypowali 5 polimorfizmów w obrębie tego genu. Wykazali ścisłe ich powiązanie z markerem DG10S478 oraz ryzykiem rozwoju cukrzycy typu 2
Autorzy Zahng i wsp. potwierdzili ścisłą zależność pomiędzy pospolitym wariantem TCF7L2 (RS 12255372 T/G), a wczesnym ryzykiem rozwoju cukrzycytypu 2. Autorzy wykazali, że obecność allelu T wiąże się z 32% u kobiet wzrostem ryzyka rozwoju cukrzycy typu 2, a u mężczyzn z 53% ryzykiem. U homozygot TT ryzyko to było odpowiednio wyższe o 86% (? dziwne ale tak było na slajdzie) u kobiet i o 11,5% u mężczyzn. W badaniu metaanalitycznym wykazali, że obecność allelu T wiąże się z 48% większym ryzykiem rozwoju cukrzycy typu 2
Genetyka nadciśnienia tętniczego:
Choroba |
Gen lub locus |
Dziedziczenie |
|
Niedobór 11-hydroksylazy steroidowej |
CPY111 |
Autosomalne recesywne |
|
Niedobór 17- hydroksylazy steroidowej |
CPY17 |
Autosomalne recesywne |
|
Zespól Liddle'a |
SCNN18 |
Autosomalne dominujące |
|
|
SCNN16 |
|
|
Pozorny nadmiar mineralokortykoidów AME |
HSD11b2 |
Autosomalnie recesywnie |
|
Mutacja S810L genu receptora mineralokortykosteroidów |
NR3C2 |
Autosomalnie dominująco |
|
Rodzinny Hiperaldosteronizm Typ 1 (FH I, GRA) |
CYP11B1/B2 |
Autosomalnie dominująco |
|
Rodzinny Hiperaldosteronizm Typ 2 (FH II) |
7p22 |
Autosomalnie dominująco |
|
zespół Gordona (PAH II) |
1q31-q42 |
Autosomalnie dominująco (?) |
|
|
PRKWNK1 |
|
|
|
PRKWNK4 |
|
|
Nadciśnienie z brachydaktylia |
12p |
Autosomalne dominujące |
|
Nadciśnienie z hipercholesterolemia i hipomagnezemia |
mtDNA |
mitochondrialne |
|
Choroby nerek wywołane mutacją pojedynczego genu:
Zespół Alporta:
Zespół Alporta jest wrodzona dziedziczną glomerulopatią spowodowaną genetycznie uwarunkowanym zaburzeniem syntezy jednego z łańcuchów kolagenu IV. Zespołowi temu towarzyszą często upośledzenia słuchu. Rzadko wystepują zmiany w narządzie wzroku.
Przyczyną choroby jest zaburzenie syntezy błony podstwanej spowodowane genetycznie uwarunkowanym brakiem łańcucha kolagenu IV. W 80-85% przypadkach choroba jest dziedziczona w sposób dominujący związany z płcią. Defekt dotyczy wówczas łańcucha 5 kolagenu IV, a zmutowany gen jest położony na dystalnym ramieniu chromosomu X(COL4A5, Xq22). W genie COL4A5 zidentyfikowano ponad 300 różnych mutacji. Są to mutacje bezsensu, mutacje procesu składania RNA lub delecje poniżej 10 par zasad. Mężczyźni chorzy na zepół Alporta (związany z chromosomem X) nie przenoszą tej choroby na synów, lecz tylko na córki. Kobiety chore na zespół Alporta (związany z chromosomem X) przenoszą chorobę w 1/3 do ½ przypadków. U kobiet zwykle jedynym objawem jest mikrohematuria. U mężczyzn z delecjami w genie COL4A5 stwierdzono połączona z głuchotą progresję do krańcowej niewydolności nerek w 2 lub 3 dekadzie życia.
Choroba przebiega łagodnie u kobiet, ale w sposób umiarkowany lub ciężki u mężczyzn. W postaci dziedziczonej z sposób autosomalny recesywny defekt dotyczy łańcuchów 3 i 4 kolagenu IV, a geny kodujące COL4A3 i COL4A4 znajdują się na chromosomie 2 (2q36-37). Prawdopodobnie defekty genetyczne mogą wystepować także na innych chromosomach (13?). Błona podstawna z omówionych defektem na unikatowe właściwości antygenowe: nie wiąże ona przeciwciał przeciwko błonie podstawnej. Wymienione zmiany w błobnie podstawnej występują również w naskórku, śliniankach i soczewkach.
Rozpoznanie stawia się w oparciu o charakterystyczne objawy oraz wyniki badań dodatkowych: rodzinne wystepowanie objawów klinicznych wymienionych powyżej, wynik badania biopsyjnego nerki, a zwłaszcza wygląd błony podstawnej w mikroskopie elektronowym, wykrycie mutacji genowej po przeprowadzeniu badań genetycznych, i wzmożone wydalanie z moczem produktów degradacji kolagenu.
W rozpoznaniu różnicowym należy wziąć pod uwagę stany chorobowe przebiegające z krwiomoczem o charakterze rodzinnym. Wśród takich chorób wymienić można: łagodny rodzinny krwiomocz, zespół cienkich błon podstawnych i stany zagrożenia kamicą. Nie należy zapominać o tym, że aż 20% przypadków zespołu Alporta rozwija się w wyniku nowych mutacji.
Nawroty krwiomoczu mogą utrzymywać się wiele lat przed rozwojem niewydolności nerek. Rozwój niewydolności nerek postępuje powoli. U mężczyzn terminalna niewydolność nerek rozwija się w 4 i 5 dekadzie zycia. U kobiet terminalna niewydolność nerek rozwija się rzadziej. Brak zadowalających metod terapeutycznych. Choroba nie przenosi się zwykle na przeszczepioną nerkę. Poradnictwo genetyczne prenatalne może zapoznać rodziców z ryzykiem rozwoju choroby u dziecka.
Choroby nerek wywołane mutacją pojedynczego genu
Zwyrodnienie torbielowate (Wielotorbielowatość) nerek:
Zwyrodnienie torbielowate jest częstą przyczyną krańcowej niewydolności nerek. Aż >10% chorych leczonych nerkozastępczo to chorzy ze zwyrodnieniem torbielowatym nerek. Wielotorbielowatość nerek to schorzenie charakteryzujące się niezliczoną ilością różnej wielkości torbieli, rozmieszczonych zarówno w korze jaki i w rdzeniu obu nerek. Torbiele te powodują zniekształcenie i powiększenie narządu,
Molekularna i kliniczna charakterystyka ADPKD I ARPKD:
|
ADPKD |
ARPKD |
|
Charakterystyka molekularna: |
Autosomalnie dominująco |
Autosomalnie recesywnie |
|
sposób dziedziczenia |
PKD1(16p13.3) |
PKHD1(16p21.1-12) |
|
Gen |
PKD2(4q21-22) |
Fibrycystyna(polidacyna) 4074 reszt aminokwsowych |
|
produkt genu-białko |
Policystyna1(PC-1)- 4302 reszt aminokwasowych |
Fibrycystyna(polidacyna) zintegrowane białko błonowe |
|
struktura białka |
Policystyna2(PC-2)- 968 reszt aminokwasowych |
Fibrycystyna/polidacyna- nerki, wątroba, trzustka |
|
lokalizacja tkankowa |
PC1L-integralne białko błonowe |
Fibrycystyna/polidacyna-białka cytoplazmatyczne, rzęski pierotne, ciałko podstawne |
|
lokalizacja komorkowa |
PC-2 integralne białko błonowe podobne do kanału TRPC |
Nieznana |
|
Funkcja |
PC-1, PC-2 heterogeniczne |
1:6000--1:40000 |
|
Charakterystyka kliniczna: |
PC-1 błona cytoplazmatyczna, rzeski pierwotne |
wczesne dzieciństwo |
|
Czestość występowania |
PC-2 reticulum endoplazmatyczne, rzeski pierwotne |
kanaliki zbiorcze |
|
Wiek wystąpienia EXRD |
Pc-2 kanał jonowy aktywowany przez Ca |
Zaburzenia rozwoju dróg żółciowych, zwłóknienie wątroby, nadciśnienie tętnicze, nadciśnienie wtórne |
|
Umiejscowienie torbieli nerkowych |
1:400-1:1000 |
|
|
objawy pozanerkowe |
6 i 7 dekada zycia |
|
|
|
wszystkie segmenty nefronu |
|
|
|
torbiele watrobowe, trzustka, śledziona |
|
|
|
tętniaki wewnątrzczaszkowe, nadciśnienie tętnicze |
|
|
Prelekcja III:
Wybrane zagadnienia z genetyki chorób tkanki łącznej
Wprowadzenie:
Wrodzona podatność na chorobę tkanki łącznej ma znaczenie dla wystąpienia, rozwoju i ciężkości jej przebiegu
Badania populacyjne, w tym badania nad rodzinnym występowaniem chorób autoimmunologicznych, wykazały związek tych chorób z układem HLA
W przeciwieństwie do wielu chorób uwarunkowanych genetycznie przyczyną chorób tkanki łącznej nie jest defekt 1 genu, lecz dysfunkcja wzajemnej relacji wielu genów
Toczeń rumieniowaty układowy:
Toczeń rumieniowaty układowy (łac. lupus erythematosus systemicus, ang. systemic lupus erythematosus, SLE ) - choroba autoimmunologiczna, rozwijająca się na tle złożonych i niejasnych zaburzeń układu odpornościowego, doprowadzający do procesu zapalnego wielu tkanek i narządów.
Zachorowalność szacuje się na 40-50 przypadków na 100 000, 10-krotnie częściej chorują kobiety i szczyt zachorowań występuje w wieku 16-55 lat.
Choroba charakteryzuje się bardzo zróżnicowanym nasileniem i przebiegiem naturalnym.
Przez dłuższy czas mogą dominować objawy z jednego narządu (co może być niewystarczające do pewnego rozpoznania SLE), mogą pojawiać się częściowe remisje i zaostrzenia. W miarę trwania choroby mogą pojawiać się objawy z kolejnych narządów, jednak objawy uprzednio występujące nie ulegają wycofaniu.
Genetyczne badania epidemiologiczne dowiodły silnego związku TRU z wrodzoną podatnością na chorobę
Stwierdza się 100 razy większe ryzyko występowania TRU u kolejnych członków rodziny w porównaniu z ryzykiem stwierdzanym w populacji ogólnej
Toczeń rumieniowaty układowy - podgrupy:
Podostry toczeń skórny
Toczeń indukowany lekami
Toczeń noworodków
Toczeń z zespołem Sjögrena
Toczeń z zespołem antyfosfolipidowym
Kryteria Amerykańskiego Towarzystwa Reumatologicznego:
Zmiany skórne typu rumienia (często w kształcie motyla na twarzy), nigdy nie przekraczają bruzd nosowo-wargowych.
Zmiany skórne rumieniowo-bliznowaciejące - rumień krążkowy (typu DLE).
Nadwrażliwość na światło słoneczne.
Nadżerki w jamie ustnej.
Zapalenie lub ból stawów - dotyczące co najmniej dwóch stawów, bez zmian w obrazie RTG.
Zapalenie błon surowiczych - opłucnej (pleuritis) lub osierdzia (pericarditis), stwierdzone w wywiadzie lub w chwili badania.
Zmiany w nerkach - utrzymująca się proteinuria (białkomocz) powyżej 0,5 g/dobę lub obecność wałeczków nerkowych w moczu.
Zaburzenia neuropsychiatryczne - szeroki wachlarz, najczęściej napady drgawek lub psychoza (po wykluczeniu przyczyn polekowych, metabolicznych, mocznicy).
Zaburzenia hematologiczne - niedokrwistość hemolityczna z retikulocytozą lub limfopenia (poniżej 1500 w 1 mm3) lub leukopenia (poniżej 4000 w 1 mm3) lub trombocytopenia (poniżej 100 000 w 1 mm3 ).
Zaburzenia immunologiczne - obecność komórek LE lub przeciwciał przeciw dsDNA (natywne DNA), lub przeciwciał anty-Sm, lub fałszywie dodatnie serologiczne odczyny kiłowe przy ujemnym teście na immobilizację krętków.
Przeciwciała przeciwjądrowe (ANA) - w mianie nie niższym niż 80 (zwykle ANA>160), badane metodą immunofluorescencji lub inna odpowiednia jeśli nie stosowano leków powodujących lekowe zespoły LE.
Za pewnym rozpoznaniem tocznia przemawia spełnienie co najmniej czterech spośród 11 kryteriów, przy czym kryteria mogą być spełnione w chwili badania lub w wywiadzie. Spełnienie dwóch lub trzech kryteriów pozwala na rozpoznanie choroby toczniopodobnej.
U ok. 5% chorych nie wykrywa się obecności przeciwciał przeciwjądrowych. Rozpoznaje się wtedy toczeń seronegatywny.
Nie można rozpoznać SLE, jeżeli chory nie spełnia żadnego z kryteriów immunologicznych choroby, tzn. kryteriów 10 lub 11.
Kryteria pomocnicze rozpoznania:
Objaw Raynauda
Przerzedzenie włosów (allopecia)
Obniżenie stężenia dopełniacza
Obecność kompleksów immunologicznych w skórze pozornie nie zmienionej
Hipergammaglobulinemia
Charakterystyczne zmiany histologiczne z odkładaniem się kompleksów immunologicznych w nerkach (biopsja).
Postępowanie diagnostyczne:
Skóra, błony śluzowe, narząd wzroku: LBT, badanie okulistyczne, badanie laryngologiczne.
Układ ruchu: RTG stawów.
Układ oddechowy: RTG klatki piersiowej, dodatkowo: HRCT klatki piersiowej, scyntygrafia płuc, testy czynnościowe płuc, badanie płynu opłucnowego (ogólne lub bakteriologiczne).
Układ sercowo-naczyniowy: EKG, echokardiogram, dodatkowo: przepływy naczyniowe.
Układ wydalniczy: ogólne badanie moczu i posiew moczu, proteinuria dobowa, kreatynina z klirensem i mocznik, USG jamy brzusznej, dodatkowo: biopsja nerki.
Układ nerwowy: badanie neurologiczne, badanie psychiatryczne, badanie psychologiczne, EEG, tomografia komputerowa głowy, MRI głowy/kręgosłupa, EMG.
Toczeń trzewny układowy - leczenie:
Stosuje się leczenie objawowe, najczęściej farmakologiczne, oparte o leki immunosupresyjne i przeciwmalaryczne.
Zwiększenie spożycia omega-3 wielonienasyconych kwasów tłuszczowych może mieć korzystny wpływ na objawy choroby.
Twardzina:
Twardzina, sklerodermia (łac. Scleroderma) - rzadka, przewlekła choroba charakteryzująca się stwardnieniem skóry i tkanek w wyniku nadmiernego gromadzenia kolagenu. Choroba ta jest spowodowana występowaniem przeciwciał przeciw topoizomerazie oraz centromerom (w CREST).
Częściej występuje w rodzinach, w których choroba już wcześniej się pojawiała.
Występuje w dwóch postaciach:
Ograniczonej (skóra palców, przedramion i twarzy)
Układowej (zmiany w skórze, układzie naczyniowym, mięśniowym, kostnym i narządach wewnętrznych).
Zmiany skórne charakteryzują się twardymi, wyraźnie odgraniczonymi ogniskami barwy porcelanowej. Początkowo są one otoczone obwódką barwy fioletowej, a następnie ulegają przebarwieniu i zanikowi.
Łagodną postacią twardziny jest zespół CREST (od Calcinosis - ogniskowych wapnień, występowaniu objawu Raynauda, zaburzeń przełykowych - Esophageal dysmotility, Sclerodactylia i Teleangiectasia).
Z czasem dochodzi do zwiększenia ilości i pogrubienia wiązek kolagenu, zaniku odczynu zapalnego i zaniku przydatków skórnych „zatopionych” w kolagenie.
Zapalenie skórno - mięśniowe:
Dermatomyositis (zapalenie skórno-mięśniowe, DM) - jest odmianą zapalenia wielomięśniowego, w której zmiany dotyczą głównie mięśni obręczy barkowej i biodrowej. Występuje dwa razy częściej u kobiet niż u mężczyzn. Czasami dochodzi do wystąpienia zmian narządowych z zajęciem przełyku (trudności w połykaniu - dysfagia) i pozostałych mięśni gładkich przewodu pokarmowego , mięśnia serca (myocarditis), mięśni oddechowych. W przypadku zajęcia mięśni oddechowych, może dochodzić do niewydolności oddechowej, która w ciężkich przypadkach może doprowadzić do śmierci . U 20-40% dochodzi do śródmiąższowej choroby płuc, która może doprowadzić do włóknienia płuc.
Objawy i przebieg:
Postępujące, symetryczne osłabienie siły mięśniowej, podwyższony poziom enzymów mięśniowych (aldolazy i kinazy kreatynowej), zmiany elektromiogramie, zmiany w biopsji mięśnia (zmiany zapalno-zwyrodnieniowe).
Towarzyszą temu zmiany skórne zlokalizowane najczęściej w obrębie dłonie (rumienie, grudki nad drobnymi stawami- Objaw Gottrona), wybroczyny, rumienie w obrębie wałów paznokciowych, hyperkeratoza na dłoniach („ręce mechanika”) oraz zmiany rumieniowe w obrębie twarzy z nasilonym obrzękiem i rumieniem w okolicy oczodołów („rzekome okulary”, „heliotrop”).
Przy długo trwającej chorobie, częściej u dzieci, pojawiają się złogi wapnia w tkance podskórnej.
Dermatomyositis jest rewelatorem nowotworowym (w ok. 20-50% towarzyszy nowotworom narządów wewnętrznych), zwykle u pacjentów, u których choroba pojawiła się po 60. roku życia.
U dzieci DM nie jest związane z chorobą nowotworową.
Polimorfizmy genetyczne a predyspozycja do TRU, twardziny układowej, zapalenia skórno-mięśniowego i wielomięśniowego:
Polimorfizm genów klasy III HLA (C2, C4A, C4B)
Nosicielstwo allela T1858 PTPN22 (protein tyrosine phosphatase)
Polimorfizm genu CTLA4 kodującego antygen związany z cytotoksycznym limfocytem T
Polimorfizmy genów kodujących cytokiny: TNF-alfa, TNF-beta, IL-10, IL1A
Polimorfizm promotora genu MCP1 (monocyte chemotactic protein 1)
Polimorfizm genu fibrylaryny (FBN1) - związek tylko z TU
Polimorfizm genetyczny a autoprzeciwciała u chorych na TU, twardzinę układową, zapalenie skórno-mięśniowe i wielomięśniowe:
Allele klasy II układu HLA są mocnej związane z autoprzeciwciałami niż podatnością na chorobę lub jej obrazem klinicznym
Związek przeciwciał u chorych na TRU, TU, DM i PM z określonymi genami wskazuje na znaczne zróżnicowanie w zależności od badanej rasy i kraju, w którym badanie przeprowadzono
Opisano związek przeciwciał przeciw topoizomerazie I, ACA, PM-Scl, przeciwciał przeciw fibrylarynie, U1-RNP z niektórymi genami
Polimorfizm genetyczny a zmiany narządowe u chorych na TU, zapalenie wielomięśniowe i skórno-mięśniowe:
W niektórych badaniach wykazano związek między genami i zmianami narządowymi u chorych na TU
Zwrócono także uwage na powiązanie pewnych zmian narządowych w zapaleniu mięśni z obecnościa genów. Chorzy z przeciwciałami antysyntetazowi mieli istotnie częściej zapalenie stawów, gorączke, śródmiąższowe zapalenie płuc i allel HLA-DRw52
Allel A (-308) TNFA związany jest z wapnieniem tkanek w młodzieńczym DM i przewlekłym zapaleniu mięśni.
Genetyczne podstawy trombofilii i hemofilii:
Klinicznym obrazem niewydolności toru krzepnięcia jest hemofilia, a przejawem nadmiernej aktywacji tego układu- trombofilia.
Hemofilia:
Hemofilie- grupa trzech uwarunkowanych genetycznie skaz krwotocznych, których objawy wynikają z niedoborów czynników krzepnięcia:
VIII(hemofilia A),
IX (hemofilia B),
XI (hemofilia C)
Łączna częstość hemofilii A i B w populacji wynosi ok. 1 :12000. Hemofilia A jest 4 do 8 razy częstsza niż hemofilia B.
Etiologia:
Hemofilia A i B są chorobami sprzężonymi z płcią. Geny, których mutacje wywołują choroby, znajdują się na chromosomie X. Hemofilie dziedziczone są w sposób recesywny, co oznacza, iż chorują jedynie osoby z pełną ekspresją recesywnego genu;
Meżczyźni hemizygotyczni wzg zmutowanego genu
Kobiety homozygotyczne wzg zmutowanego genu.
Kobieta nosicielka zmutowanego allela genu posiada drugi chromosom X z prawidłowym allelem i nie choruje.
Syn, który urodzi się ze związku z nosicielką wadliwego genu, może odziedziczyć od matki mutacje i wtedy będzie chorował na hemofilie, natomiast córka z takiego związku może być tylko nosicielką zmutowanego allelu ( prawdopodobieństwo odziedziczenia wadliwego allelu wynosi 50%)
Możliwe jest zachorowanie na hemofilie córki kobiety- nosicielki wadliwego genu, w przypadku, kiedy ojciec takiej dziewczynki będzie chory na hemofilię: wówczas obydwie kopie genu będą miały mutacje.
Dziecko mężczyzny chorującego na hemofilie będzie zdrowe ( chłopiec) lub b edzie nosicielem (dziewczynka)-(przy założeniu, że drugi rodzic nie jest nosicielem uszkodzonego genu).
Dziecko kobiety będącej nosicielka może być nosicielem(dziewczynka) lub może być chore (chłopiec), ale może być też zdrowe- (przy założeniu, że ojciec nie jest chory na hemofilie czyli nie jest nosicielem uszkodzonego genu).
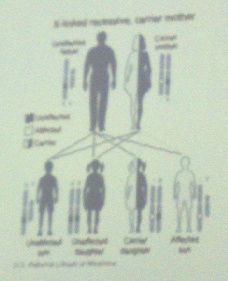
Schemat dziedziczenia hemofilii:
Typy hemofilii;
Hemofilia A- spowodowana mutacja locus Xq28 powodującą niedobór czynnika VIII krzepnięcia krwi (czynnika antyhemolitycznego):klasyczna hemofilia
Hemofilia B- mutacja w locus Xq27.1-q27.2, niedobór IX czynnika krzepnięcia krwi (czynnika Christmasa)
Hemofilia C- mutacja w locus 4q35, niedobór XI czynnika krzepnięcia krwi ( czynnik Rosenthala), najczęściej w populacji Żydów Aszkenazyjskich, dziedziczenie autosomalne recesywne.
Postacie kliniczne:
Ciężka, stężenie czynnika VIII/IX w osoczu <2% normy
Umiarkowana, stężenie czynnika VIII/IX w osoczu 2-5% normy
łagodna, stężenie czynnika VIII/IX w osoczu 5-25% normy
utajona , stężenie czynnika VIII/IX w osoczu 25-50% normy
Objawy hemofilii:
krwawienia podskórne
wylwey do mięśni
nawracające wylewy do dużych stawów: obrzęk, ucieplenie, ograniczenie ruchomości, bolesność, zniszczenie struktury stawu-artropatia hemofilowa
krwawienie
krwawienia z błony śluzowej jamy ustnej i nosa
krwioplucie okołoinfekcyjne
u niemowląt i małych dzieci wylewy na głowie
krwiomocz
krwawienie do OUNu (objawia się silnym bólem głowy)
krwawienie pozaotrzewnowe, do mięśnia biodrowo-lędźwiowego
Rozpoznanie:
wydłużony czas kaolinowo-kefalinowy (APTT)
obniżenie aktywności VIII lub IX
czas protrombinowy jest prawidłowy
czas krwawienia jest prawidłowy
ilość płytek krwi jest prawidłowa
prosty test róznicujący hemofilie A i B polega na dodaniu osocza pacjenta z hemofilia B, jeśli badane osocze pochodzi od pacjenta z hemofilia A, dojdzie do korekcji czasu kaolinowo-kefalinowego
Leczenie:
Leczenie polega na suplementacji preparatami czynników VIII lub IX. Preparaty są rekombinowane (uzyskane metodami inżynierii genetycznej) lub wysokooczyszczone, i na ogół są słabo immunogenne. Czynnik VIII ma czas biologicznego półtrwania 10-15 godzin, czynnik IX około 24 godzin, stąd w dawkowaniu czynnika IX podaje się go raz na dobę, a w celu utrzymania prawidłowego stężenia czynnika VIII połowę dawki początkowej podaje się co 12 godzin.
W zależności od postaci hemofilii leczenie może przebiegać profilaktycznie bądź objawowo.
Leczenie profilaktyczne (zapobiegawcze) polega na okresowym, powtarzanym uzupełnieniu brakującego czynnika krzepnięcia (dożylnie).
Leczenie objawowe polega na podawaniu dawek czynnika jedynie w przypadku wystąpienia krwawienia i ma na celu jego zatrzymanie.
Leczenie profilaktyczne prowadzone jest dwa razy w tygodniu w przypadku hemofilii B lub trzy razy w tygodniu w przypadku hemofilii A. Podawanie leku chroni stawy dzieci przed uszkodzeniami i późniejszym inwalidztwem.
W łagodnych postaciach hemofilii A lekiem z wyboru jest pochodna wazopresyny (DDAVP), uwalniająca czynnik VIII z rezerwy tkankowej jaką są komórki śródbłonka. Po podaniu DDAVP stężenie czynnika VIII wzrasta w osoczu 2-4 razy w ciągu 2-4 godzin. Po 3-4 dniach leczenia DDAVP należy się spodziewać zjawiska tachyfilaksji.
Powikłania:
Najczęściej występującymi powikłaniami są postępujące zmiany zwyrodniniowe (artropatia hemofilowa) na skutek długotrwałych, nawracających wylewów dostawowych. Dzieje się tak gdy dzieci chore na hemofilię nie są objęte leczeniem profilaktycznym, polegającym na regularnym podawaniu czynnik krzepnięcia do 18. roku życia.
Powikłaniem leczenia koncentratem czynnika VIII (rzadziej IX) jest wytworzenie przeciwciał skierowanych przeciwko temu białku. Dotyczy to 15-20% leczonych pacjentów.
Historia:
Najstarsze wzmianki o hemofilii znajdują się w księgach Starego Testamentu i na papirusach pochodzących ze starożytnego Egiptu. Pisemne opisy chorych z objawami skazy krwotocznej, prawdopodobnie hemofilii, zawarte są w Talmudzie, w którym przedstawiono przypadki śmiertelnego wykrawienia obrzezanych chłopców. Te relacje pochodzą mniej więcej z roku 140 n.e. Najstarszy opis hemofilii na obszarze europejskim wyszedł spod pióra arabskiego lekarza i autora podręcznika chirurgii Khalaf ibn Abbas, znany także jako Alabucasis z Kordoby już w XI wieku.
Królowa Wiktoria przekazała mutację swojemu synowi Leopoldowi oraz swoim córkom: Alice i Beatrycze (nosicielki genu hemofilii), co zapoczątkowało „epidemię” hemofilii wśród członków rodów królewskich w całej Europie, w Hiszpanii, Niemczech i Rosji. Stąd też hemofilię nazywa się często „chorobą królów”.
Hemofilia wywarła także wielki wpływ na losy carskiej Rosji - a przez to na losy całej Europy. Syn ostatniego cara, a jednocześnie prawnuk królowej Wiktorii (carewicz Aleksiej) był hemofilikiem - a wówczas nie istniały skuteczne leki na tę dolegliwość. Jedną z przyczyn pojawienia się Rasputina na dworze carskim była właśnie jego obietnica, że będzie w stanie uzdrowić Aleksego.
W decydującej chwili car Mikołaj zdecydował się abdykować na rzecz swojego brata (a nie syna) - ponieważ obawiał się, że Aleksy nie będzie w stanie znieść ciężaru władzy. Brat cara z kolei nie był zainteresowany przyjęciem władzy, co doprowadziło do pogłębienia kryzysu i w konsekwencji przyspieszyło wybuch rewolucji.
Trombofilia:
Trombofilia - wrodzony lub nabyty zespół chorobowy charakteryzujący się zwiększoną skłonnością do tworzenia zakrzepów żylnych lub rzadko tętniczych spowodowaną zaburzeniami w ukł. krzepnięcia.
Przyczyny trombofilii wrodzonej:
częste:
mutacja Leiden czynnika V (>20%)
niedobór białka C (6-9%)
rzadkie:
niedobór antytrombiny III
niedobór białka S (kofaktora białka C)
Leiden V:
Mutacja pojedynczego nukleotydu w genie czynnika V (mutacja typu Leiden) odpowiada za oporność na aktywowane białko C.
Czołowe miejsce pod względem częstości występowania na liście genetycznych czynników ryzyka trombofilii, stwierdza się u 20-50% pacjentów z zakrzepicą żylną.
Wśród kobiet stosujących doustną antykoncepcję hormonalną, u których wystąpiła zakrzepica, 80% to homozygoty czynnika V Leiden.
Polimorfizmy innych białek a zwiększone ryzyko dziedzicznej trombofilii:
Protrombina
Czynnik VII
Fibrynogen
Inhibitor aktywatora plazminogenu
Trombomodulina
Homocysteina
Plazminogen
Białko bogate w histydynę (HRPG)
Kofaktor II heparyny
Przyczyny trombofilii nabytej:
Zespół antyfosfolipidowy
Palenie tytoniu
Genetyka molekularna chorób układu endokrynnego:
MEN:
Mnoga gruczolakowatość wewnątrzwydzielnicza, gruczolakowatość wewnątrzwydzielnicza (ang. multiple endocrine neoplasia, MEN) może dotyczyć różnych narządów, obejmuje trzy zespoły określane jako MEN I, MEN IIa, MEN IIb, dziedziczone w sposób autosomalny dominujący. U krewnych chorych należy przeprowadzić badania genetyczne, mające na celu wykrycie zmutowanych genów, co pozwoli na wczesne wykrywanie guzów wchodzących w skład zespołów.
MEN I - zespół Wermera:
Przyczyna: defekt genu kodującego białko meninę zlokalizowanego na długim ramieniu 11 chromosomu (11q13). W skład zespołu wchodzą:
Guz dominujący: nowotwór trzustki: insulinoma, gastrinoma, i inne
Pierwotna nadczynność przytarczycy
Guz przedniego płata przysadki
MEN II:
Mnoga gruczolakowatość wewnątrzwydzielnicza typu 2 (zespół gruczolakowatości wewnątrzwydzielniczej typu 2, MEN II, ang. multiple endocrine neoplasia type II) - rzadka choroba genetyczna objawiająca się predyspozycją do raka rdzeniastego tarczycy, guza chromochłonnego nadnerczy i nadczynności przytarczyc, a także innych rzadszych guzów i wad wrodzonych.
Etiologia MEN II:
MEN II wywołana jest przez mutacje w protoonkogenie RET. Dziedziczenie mutacji jest autosomalne dominujące z wysoką penetracją.
Epidemiologia MEN II:
Na całym świecie rozpoznano około 500 - 1000 rodzin z MEN II. Szacuje się, że częstość schorzenia wynosi 1 : 30 000. 80% przypadków stanowi MEN IIA, około 5% MEN IIB.
MEN II:
W zależności od obrazu klinicznego wyróżnia się dwa podtypy MEN II:
MEN IIA (zespół Sipple'a)
MEN IIB (zespół Williamsa - Pollocka, zespół Gorlina - Vickersa, zespół Wagenmanna - Froboese'a)
MEN IIA - zespół Sipple'a:
Rak rdzeniasty tarczycy
Jedno lub obustronny guz chromochłonny nadnerczy (ponad 50%)
Nadczynność przytarczyc spowodowana gruczolakiem lub hiperplazją komórek gruczołu (15 - 30%)
Liszajowate (ang. lichenoid) zmiany skórne, zlokalizowane najczęściej w górnej części pleców
Choroba Hirschsprunga (rzadko)
MEN IIB - zespół Gorlina:
Szczególnie agresywny rak rdzeniasty tarczycy
Nerwiaki podśluzówkowe (np. warg, języka)
Nerwiakowłukniaki
Nerwiakowłókniakowatość przewodu pokarmowego (ganglioneuromatosis) mogąca skutkować objawami niedrożnościowymi, okrężnicą olbrzymią (megacolon), zaparciami lub biegunkami (około 40%)
Cechy marfanoidalne (wiotkość stawów, deformacje kostne, kifoskolioza lub lordoza)
Widoczne włókna nerwowe rogówki
Guz chromochłonny (40 - 50%)
Rodzinny rak rdzeniasty tarczycy - (FMTC)-non-MEN:
W FMTC rdzeniasty rak tarczycy jest jedyną cechą zespołu
Przypadek Abrahama Lincolna:
W listopadzie 2007 r amerykański kardiolog John G. Stos wysunął hipotezę, że Abraham Lincoln chorował na MEN II B. Argumenty przemawiające za tym rozpoznaniem to marfanoidalna budowa ciała 16. prezydenta USA ( hipoteza o zespole Marfana u L. została wysunięta wcześniej), wydatna dolna warga, słabe napięcie mięśniowe i wycieńczenie fizyczne pod koniec życia, mogące świadczyć o chorobie nowotworowej.
Nerwiakowłókniakowatość:
Nerwiakowłókniakowatości (neurofibromatozy, łac. neurofibromatoses) są grupą chorób genetycznych dziedziczonych autosomalnie dominująco cechujących się obecnością licznych, niezłośliwych nowotworów pochodzenia nerwowego
Znane są przynajmniej dwa typy choroby różniące się objawami i defektem genetycznym
Nerwiakowłókniakowatość Typu 1:
Nerwiakowłókniakowatość typu 1 (neurofibromatoza typu I, choroba von Recklinghausena, NF 1)- choroba genetyczna o dziedziczeniu autosomalnym dominującym, ?należąca do grupy fakomatoz. W obrazie klinicznym występują zmiany skórne, oczne, guzy wewnątrzczaszkowe i inne nowotwory o lokalizacji pozaczaszkowej, a także zmiany kostne
Nerwiakowłókniakowatość typu 1 spowodowana jest mutacją w genie NF1 kodującym neurofibrominę 1.
Choroba ta jest nieuleczalna
Pierwszy opis choroby przedstawił irlandzki chirurg Robert William Smith w 1849
Klasyczna praca Friedricha Daniela von Recklinghausena z 1882 r. zawierała opis symptomatologii choroby i wprowadziła do medycyny termin neurofibromatosis
Etiologia:
Choroba spowodowana jest odziedziczoną mutacją genu supresorowego NF1 w locus 17q11.2 kodującego białko neurofibrominę
Wskutek spontanicznej mutacji drugiego allela genu NF1 i tzw utraty heterozygotyczności rozwijają się charakterystyczne dla choroby guzy nowotworowe i hamartomatyczne
Epidemiologia :
NF1 jest stosunkowo częstą chorobą genetyczną i najczęstsza z fakomatoz
Częstość około 1:2500 żywych urodzeń i przynajmniej 1:4000- 1:5000 w populacji
Objawy duże:
plamy cafe au lait (>99%) na całym ciele, niekiedy już od urodzenia, zazwyczaj pojawiające się w okresie niemowlęcym
piegowate nakrapiania średnicy 2-3 mm i przebarwienia skórne (70%) w ?okolicach pachowych i pachwinowych (objaw Crowe'a), pojawiają się najczęściej w okresie dojrzewania
guzki podskórne będące histologicznie nerwiakowłókniakami (>99%)
guzki Lischa (90-95%), ciemnożółte lub brązowe hamartomatyczne guzki tęczówki, dobrze widoczne w lampie szczelinowej
Objawy wtórne i powikłania:
Nerwiakowłókniaki splotowate (35%), o różnych lokalizacjach - tkanka podskórna , narządy wewnętrzne
upośledzenie umysłowe , deficyty psychospołeczne, nadpobudliwość, drobne nieprawidłowości orientacji wzrokowo- przestrzennej(30%)
padaczka (5%) zwykle pod postacią napadów częściowych złożonych lub uogólnionych napadów toniczno -klonicznych
guzy OUN
glejak nerwu wzrokowego (1,5%)
Nerwiakowłókniaki rdzenia kręgowego
glejak ze stenozą wodociągu mózgu (1,5%)
nowotwory złośliwe
złośliwe guzy otoczki i nerwów obwodowych, MPNST (1,5 % ryzyko że u pacjenta w ciągu całego życia rozwiana się te guzy wynosi 7-12%)
mięsaki prążkowano komórkowe (1,5%)
guz chromochłonny (0,7%)
białaczki, zwłaszcza wczesnodziecięca białaczka nielimfocytowa (<1,0%)
rakowiak dwunastnicy (1,5%)
powikłania ortopedyczne: dysplazje i deformacje kostne, zwłaszcza skolioza odcinka piersiowego kręgosłupa, dysplazja skrzydeł większych kości klinowej, deformacje kości strzałkowej i piszczelowej, złamania patologiczne z tendecją do tworzenia stawów rzekomych (25%)
zwężenie naczyń nerkowych (1,5%), które może być spowodowane dysplazją włóknisto - mięśniową i wywoływać nadciśnienie tętnicze nerkowopochodne
Problemy poznawcze
Najczęstszym problemem u pacjentów jest upośledzenie poznawcze oraz w zdolności do uczenia się. Wykazano, że problemy poznawcze występują u około 80% dzieci z NF1 i mają znaczący wpływ na codzienne oraz szkolne życie.
ADHD występuje u około 38% dzieci z NF1.
Wykazano, że problemy poznawcze utrzymują się na stałym poziomie do dorosłości i nie ulegają pogorszeniu, jak niektóre inne objawy fizykalne w NF-1.
Leczenie
NF1 jest chorobą nieuleczalną, możliwe jest jedynie leczenie objawowe.
Rokowanie zależy od stopnia nasilenia zmian narządowych i właściwego prowadzenia pacjenta.
Główną przyczyną przedwczesnej śmierci chorych z NF1 są choroby układu krążenia.
Nerwiakowłókniakowatość Typu 2:
Choroba genetyczna o dziedziczeniu autosomalnym dominującym, przypominająca obrazem klinicznym nerwiakowłókniakowatość typu 1.
NF2 spowodowana jest mutacjami w genie NF2 w locus 22q12.2 kodującym neurofibrominę-2, zwaną także merliną.
Epidemiologia:
NF2 jest rzadką chorobą; ocenia się,że w populacji europejskiej rozpoznawana jest z częstością 1:210 000, a częstość żywych urodzeń wynosi 1:30 000 - 1:40 000.
W obrazie klinicznym NF2 można wyróżnić trzy grupy objawów, obejmujące:
zmiany nowotworowe (charakterystyczne są obustronne schwannoma nerwu przedsionkowego - 68%)
zmiany skórne (plamy typu cafe au lait - 40%)
zmiany oczne (zaćma - 81%)
Rak jest chorobą genetyczną - nowotwór złośliwy jest w ostatecznym rachunku chorobą związaną z wadami DNA.
Musi być zburzonych pięć czy sześć systemów regulacyjnych, by normalna komórka zmieniła się w rakową. - R. Weinberg:
Wzrost przy braku sygnałów inicjujących rozmnażanie.
Większość normalnych komórek czeka z podziałem na odpowiednią informację z zewnątrz. Komórki rakowe często wysyłają swoje własne sygnały.
Wzrost mimo zakazu.
Kiedy rozrastający się guz uciska sąsiadujące tkanki, wysyłają one chemiczne sygnały, które mają powstrzymać komórki od dalszych podziałów. Nowotwór ignoruje takie polecenia.
Wyłączenie mechanizmów samozniszczenia.
W zdrowych komórkach uszkodzenia genetyczne przekraczające pewien poziom krytyczny aktywują zaprogramowane samobójstwo. Komórki rakowe oszukują ten mechanizm, choć niektóre elementy układu odpornościowego mogą je zmusić do samozniszczenia.
Umiejętność symulowania rozwoju naczyń krwionośnych
Aby się rozwijać, nowotwór potrzebuje tlenu i składników odżywczych. Uzyskuje je, zmuszając przebiegające w pobliżu naczynia krwionośne do wytwarzania nowych odgałęzień przenikających rosnący guz.
Nieśmiertelność
Zdrowe komórki mogą si podzielić najwyżej 70 razy. Komórki nowotworowe potrzebują większej liczby podziałów, by wytworzyć guz. Obchodzą więc zabezpieczenia, takie jak telomery znajdujące się na końcach chromosomów. To przełamuje barierę ograniczającą zdolność do rozmnażania.
Zdolność tworzenia przerzutów i atakowania innych tkanek.
Rak staje się zwykle groźny dla życia, gdy zablokuje mechanizmy ograniczające jego obecność do organu, w którym powstał. Pojawiają się przerzuty, które w pewnym momencie zakłócają prawidłowe funkcjonowanie całego organizmu
Niektóre cechy komórki nowotworowej:
zmiany ładunku elektrycznego
utrata antygenów, nowe antygeny
maskowanie antygenów
Zaburzenia cytoplazmatyczne, zaburzona budowa i funkcja organelli komórkowych
zmiany w składzie glikoprotein, glikosfingolpidów, utrata lub zmiana struktury glikolipidów
zmieniona fagocytoza i endocytoza
obniżona adhezja i zniesienie hamowania kontaktowego wzrostu komórek nowotworowych
zaburzenia transportu przez błonę komórkową, zmiany przepuszczalności
wzrost aglutynacji pod wpływem lektyn, zwiększenie ruchliwości cząsteczek w błonie
zmiana aktywności enzymów głównie proteaz i glikozydaz
Klasyczne etapy nowotworzenia:
inicjacja
promocja
progresja
Teoria standardowa:
Kancerogeny
Np. promieniowanie UV czy dym tytoniowy bezpośrednio wpływają na zmianę sekwencji DNA w genach związanych z rakiem
W wyniku mutacji genów supresorowych w komórce nie ma prawidłowo działających białek które powstrzymają jej wzrost. Komórka dzieli się nadal choć nie powinna.
Równocześnie mutacje onkogenów powodują zwiększoną aktywność onkoprotein. Stymulują one dodatkowe rozmnażanie komórek.
Nadmiar onkoprotein i brak białek supresorowych nowotworów powoduje szybki wzrost liczby zmutowanych komórek
Po wielu cyklach mutacji i ekspansji jedna ze zmodyfikowanych komórek pokonuje wszelkie ograniczenia utrudniające jej rozwój. Rak atakuję tkankę przyległą do zajętego organu.
W najbardziej zaawansowanym stadium komórki rakowe przedostają się do krwi. W odległych miejscach organizmu tworzą wtórne ogniska choroby, czyli przerzuty. W pewnym momencie zakłócają jego podstawowe funkcje życiowe
Onkogeny:
mechanizm aktywacji protoonkogenu w onkogen:
amplikacja
(zwielokrotnienie genu, mutacje punktowe, insercja promotora, translokacja)
protoonkogen onkogen
mRNA mRNA
Białko białko zmienione pod względem struktury i funkcji (onkoproteina)
funkcja fizjologiczna transformacja nowotworowa
Przykłady niektórych onkogenów i ich rola w procesie nowotworowym:
Onkogen |
Miejsce na chromosomie |
Przypuszczalna funkcja |
Typ nowotworu |
Czynnik wzrostu |
|
|
|
INT? |
11q13 |
Czynnik wzrostu fibroblastów |
Rak żołądka |
SIS |
22q12 |
Podjednostka B czynnika wzrostu pochodzącego z płytek |
Glioza (nowotwór mózgu) |
Receptory czynników wzrostu |
|
|
|
? |
10q |
Receptor kinazy tyrozynowej |
Liczne nowotwory układu gruczołów dokrewnych |
? |
|
Receptor czynnika wzrostu naskórka |
Glejak, rak piersi |
? |
17q11 |
Receptor hormonu tarczycy |
Białaczka promielocytowa |
? |
|
Receptor kinazy białkowej |
Nerwiak niedojrzały |
Białka transdukcji sygnału |
|
|
|
? |
11p15 |
GTPaza |
Rak okrężnicy, płuc, grasicy |
? |
12p12 |
GTPaza |
Czerniak, rak tarczycy, AML* |
? |
9q34 |
Kinaza białkowa |
Przewlekła białaczka szpikowa, ostra białaczka limfocytowa |
Czynniki transkrypcji |
|
|
|
? |
2p24 |
Białko wiążące DNA |
Nerwiak niedojrzały, rak płuc |
? |
6q22 |
Białko wiążące DNA |
Czerniak złośliwy, Chłonia, białaczka |
? |
14q24 |
Wchodzi w interakcje z onkogenami jun dla regulowania transkrypcji |
kostniakomięsak |
GENY SUPRESOROWE- białko p53:
Zespół Li Fraumeni - brak supresorowego działania białka p53:
Mózg 12%, mięsak tkanek miękkich 12%, rak sutka 25%, nadnercza 1%, kości 6% (mięsak kości), szpik kostny6% (białaczka)
Inne możliwe nowotwory: płuc, prostaty, trzustki, jelita grubego, Chłoniak, czerniak
Retinoblastoma (białko Rb) - objawy:
Biały refleks źreniczny
Guz siatkówki
Duży guz gałki ocznej
Nerwiakowłókniakowatość - NF1/NF2:
Nerwiakowłókniakowatość typu 1 (NF 1) (choroba von Rocklinghausena)
Autosomalnie dominująca, częstotliwość występowania 1/3000, Locus genu 17q11.2, plamy typu cafe-au-lait, guzki Lischa na tęczówce, rozsiane nerwiakowłókniaki, nieprawidłowości kośćca, predyspozycja do nowotworów układu nerwowego, 50% to nowe mutacje.
Główne objawy Nerwiakowłóknikowatości typu 1
Guzek Lischa
Plamy cafe-au-lait
nerwiakowłókniaki
APC- gen polipowatości rodzinnej, jego rola w powstawaniu nowotworów jelita grubego
Niektóre przykłady genów supresorowych i ich rola w powstawaniu nowotworu:
Gen ( geny pokrewne w nawiasach ) |
Miejsce na chromosomie |
Funkcja produktu genowego |
Choroba wywołana przez mutacje w liniach komórek rozrodczych |
RB1(p107, p130) |
13q14 |
Hamuje cykl komórkowy, wiąże się z E2F |
Retinoblastoma, osteosarkoma |
APC |
5q21 |
Interakcje z β-kateniną na szlaku sygnalizacyjnym Wnt |
Rodzinna polipowatość gruczolakowata |
NF1 |
17q11 |
Zmniejszenie aktywności białka ras |
Nerwiakowłóknikowatość typu 1 |
NF2 |
22q12 |
Prawdopodobnie stanowi połączenie pomiędzy białkami błony komórkowej i strukturalnymi podporowymi komórkami |
Nerwiakowłóknikowatość typu 2 |
P53 (p63,p73) |
17p13 |
Czynnik transkrypcyjny; indukuje zatrzymanie cyklu komórkowego lub apoptozę |
Zespół Li-Fraumeni |
VHL |
3p25 |
Reguluje elongację procesu transkrypcji |
Choroba von Hippla-Lindaua (rak nerki) |
WT1 |
11p13 |
Czynnik transkrypcyjny typu palca cynkowego |
Guz Wilmsa |
P16 (p15) |
9p21 |
Inhibitor CDK |
Czerniak rodzinny |
P16(p15) BRCA1 |
17q21 |
Wchodzi w interakcję z białkiem naprawczym DNA RADS1 |
Rodzinny rak piersi/jajnika |
BRCA2 |
13q12 |
Wchodzi w interakcję z białkiem naprawczym DNA RADS1 |
Rodzinny rak piersi |
PTEN |
10q23 |
Fosfataza |
Choroba Cowdena (rak piersi i tarczycy) |
AT |
11q22 |
Regulator cyklu komórkowego; reaguje na uszkodzenie DNA; interakcja z BRCA1 |
Ataksja teleangiektazja |
CHC2? |
22q12 |
Fosforylacje p53 i BRCA1 |
Zespół Li-Fraumeni |
Geny, których zmutowane formy odgrywają rolę w nowotworzeniu:
Rodzaj genów |
Funkcje w komórkach prawidłowych |
Rodzaj mutacji |
Udział w nowotworzeniu |
Onkogeny |
Proliferacja komórkowa, programowana samo destrukcja (apoptosis) |
Dominujący |
Nie kontrolowana proliferacja, zahamowanie różnicowania |
Supresory transformacji nowotworowej |
Proliferacja |
Recesywna |
Stała proliferacja |
Geny związane z angiogenezą |
Unaczynienie |
Recesywna |
Wzrost unaczynienia |
Geny związane z inwazyjnością |
Adhezja komórek, komunikacja międzykomórkowa |
Dominujący |
Inwazyjność, ruchliwość komórek |
Geny związane z przerzutowaniem |
Komunikacja miedzykomórkowa |
Recesywna |
Zmniejszanie reaktywności na sygnały międzykomórkowe, autonomizacja komórek |
Geny MHC |
Kontrola immunologiczna |
Recesywna |
Zmniejszenie kontroli immunologicznej |
Antygeny powierzchniowe |
? |
Dominujący |
?? |
Geny fuzyjne jako przyczyna nowotworów- przewlekła białaczka szpikowa:
Przewlekła białaczka szpikowa (CML):
podwyższona liczba mielocytów we krwi obwodowej
przebieg przewlekły
chorują dorośli
pochodzenie z pojedynczej komórki szpiku
u około 90% chromosom Filadelfia (Ph ¹)
(translokacja 22q na 9q)
gorsze rokowanie przy braku chromosomu
Filadelfia (Ph ¹)
Inne ostre białaczki z obecnością chromosomu Filadelfia Ph ¹ (+):
Podwyższona liczba limfocytów lub mielocytów
Przebieg ostry
20% dorosłych z ALL Ph ¹(+)
2% dorosłych z AML Ph ¹ (+)
5% dzieci z ALL Ph ¹(+)
Translokacja Filadelfia taka jak w CML
Gorsze rokowanie przy obecności Ph ¹(+)
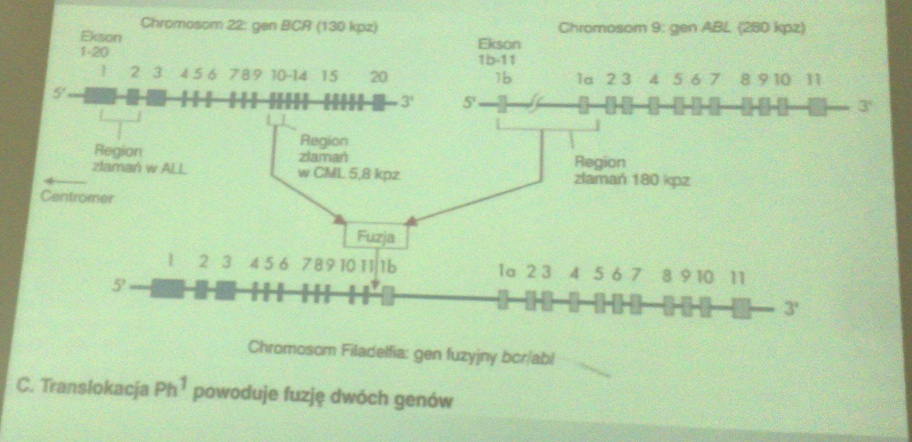
CML - fuzja genów BCR/ABL:

Translokacja Ph1 powoduje fuzję dwóch genów
Rak - proces chaotyczny, łączący działanie praw Murphy'ego i Darwina:
jeśli coś ma się zepsuć, to na pewno się zepsuje, a w środowisku, w którym toczy się walka o przetrwanie przeżyją i rozmnożą się najbardziej przystosowani.
Czynniki wzrostu - rola w kontroli podziałów komórek:
Ważne czynniki wzrostu i antagoniści:
G0 G1
Naskórkowy czynniki wzrostu (EGF)
Czynnik wzrostu nerwu (NGF)
Czynnik wzrostu fibroblastów (FGF)
Płytkowopochodny czynnik wzrostu (POGF)
G1 S
Insulinopodobny czynnik wzrostu (IGF-1)
Antagoniści
Transformujący czynnik wzrostu β (TGF-β)
Czynnik martwicy nowotworu (TNF)
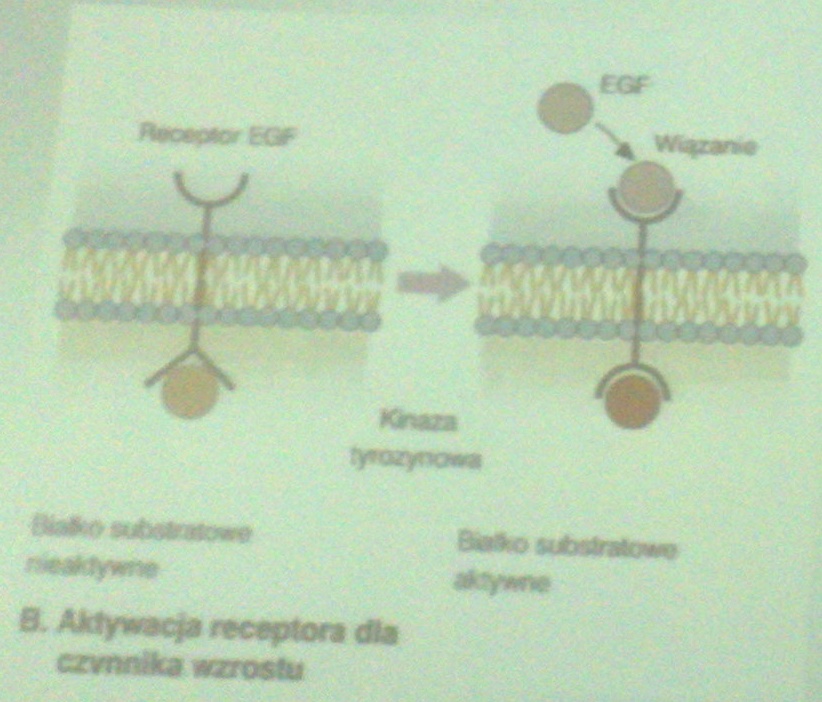
Protoonkogeny o funkcji receptorów, lub aktywności fosfokinazowej:
Receptory błonowe, cytoplazmatyczne, jądrowe
Wykrywanie mutacji:
Wykrywanie mutacji w sekwencji DNA jest często kluczowe dla zrozumienia procesu wywoływania przez gen specyficznej choroby
Metody molekularne rozwinięte ostatnio pozwoliły na opracowanie licznych technik wykrywania mutacji na poziomie DNA
Techniki analizy DNA:
Enzymy restrykcyjne
Hybrydyzacja
Amplifikacja DNA metodą PCR
Analiza RFLP
PCR Multipleks
Hybrydyzacja ASO
PCR w czasie rzeczywistym
Metody przesiewowe
Sekwencjonowanie
Diagnostyka pośrednia
Analiza SSCP
Enzymy restrykcyjne:
Rozpoznają specyficzne sekwencje w obrębie dsDNA, co w efekcie prowadzi do powstania ściśle określonych fragmentów DNA, zarówno pod wzglądem długości jak i struktury końców
Hybrydyzacja:
Tworzenie podwójnej helisy pomiędzy komplementarnymi niciami DNA lub RNA pochodzącymi z różnych źródeł
Oddziaływanie badanego fragmentu DNA i sondy molekularnej prowadzi do utworzenia hybrydu (kompleksu) o dwuniciowej strukturze
Sonda musi być denaturowana (jednoniciowa), wyznakowana radioaktywnie lub fluorescencyjnie
Hybrydyzacja typu Southern (Southern blotting):
Stosowana najczęściej
Dotyczy hybrydyzacji DNA-DNA
Można tą metodą wykryć:
rearanżacje genowe np. delecje albo insercja
mutacje punktowe
Hybrydyzacja typu Northern Blot:
Dotyczy hybrydyzacji RNA-DNA
Stosowana w celu badania ekspresji określonych genów
Dostarcza dodatkowych informacji o występowaniu w badanych komórkach określonego RNA
DNA fingerprinting:
Wykorzystuje się obecność w genomie polimorficznych sekwencji powtórzonych VNTR (zmienna liczba tandemowych powtórzeń)
W wyniku badań hybrydyzacyjnych z sondami molekularnymi rozpoznającymi jednocześnie kilkanaście loci otrzymuje się dla każdego osobnika charakterystyczny obraz fragmentów DNA tzw. Fingerprint (odcisk genetyczny)
Amplifikacja DNA metodą PCR:
Reakcja ta odzwierciedla naturalny proces replikacji i umożliwia w warunkach In vitro szybkie powielenie wybranych odcinków DNA lub RNA, przepisanych na cDNA w reakcji odwrotnej transkrypcji.
Analiza RFLP (polimorfizmu długości fragmentów restrykcyjnych):
Polimorfizmy RFLP objawiają się utworzeniem lub zanikiem miejsca rozpoznawanego przez enzymy restrykcyjne lub zmianą liczby nukleotydów pomiędzy takimi miejscami.
Zastosowanie- identyfikacja mutacji punktowych w obrębie miejsca rozpoznawanego przez enzym restrykcyjny, np. fenyloketonuria.
PCR Multipleks:
Jednorazowo można amplifikować 10 markerów.
Można badać DNA zmieszany i zdegenerowany.
Zastosowanie- duże mutacje genowe, delecje, duplikacje, insercje
Hybrydyzacja ASO:
Hybrydyzacja z sondą specyficzną dla produktu DNA.
Sonda rozpoznaje allel dziki i zmutowany.
Zastosowanie- wykrywanie mutacji punktowych, które nie zmieniają miejsc restrykcyjnych, np. mukowiscydoza.
PCR w czasie rzeczywistym:
Metoda ilościowa oparta na amplifikacji DNA In vitro- opiera się na pomiarze liczby kopii DNA przez pomiar fluorescencji.
Zastosowanie:
ilościowe określenie ekspansji genów
testowanie stabilności genetycznej
detekcja patogenów
wykrywanie trisomii i mikrodelecji
Metody przesiewowe PCR- SSCP:
Analiza konformacji jednoniciowych DNA.
Polega na porównaniu konformacji badanych fragmentów kwasów nukleinowych.
Umożliwia wykrywanie punktowych zmian w DNA, np. z. Marfana.
Metoda sekwencjonowania enzymatycznego Sangera:
Polega na enzymatycznej replikacji jednoniciowej matrycy DNA, rozpoczynającej się od jednego startera, a kończącej wbudowaniem dideoksynukleotydu do nowo powstałego łańcucha DNA.
Pirosekwencjonowanie - sekwencjonowanie w czasie rzeczywistym:
Wykorzystuje się pirofosfonian uwalniany podczas syntezy DNA.
W wyniku reakcji enzymatycznych dochodzi do emisji światła, jego intensywność zależy od ilości uwalnianego pirofosfonianu, czyli od liczby wbudowanych nukleotydów.
Stosowana do genotypowania poznanych wcześniej polimorfizmów.
Diagnostyka pośrednia:
Analiza asocjacji- porównuje rozkład alleli różnych polimorfizmów pomiędzy grupą niespokrewnionych chorych a grupą kontrolną. Stosowana w chorobach uwarunkowanych wielogenowo/ wieloczynnikowo.
Analiza sprzężeń- wykrywa sprzężenia pomiędzy markerami a poszukiwanymi genami, wymaga badań rodzinnych. Stosowana w chorobach jednogenowych.
Polimorfizm pojedynczego nukleotydu - SNP (single nucleotide polymorphism):
Zjawisko zmienności sekwencji DNA, która polega na zmianie pojedynczego nukleotydu (A,T, C, G) pomiędzy osobnikami danego gatunku lub drugim, odpowiadającym chromosomem danego osobnika.
PrelekcjaIV:
Wskazania do skierowania pacjenta (rodziny) do Poradni Genetycznej:
każda choroba genetycznie uwarunkowana lub o podejrzanej etiologii genetycznej
choroba o niewyjaśnionej etiologii powtarzająca się w rodzinie u dwóch lub więcej osób
wrodzona wada rozwojowa lub zespół wad (także wówczas, gdy jest to pierwszy przypadek wady rozwojowej w rodzinie)
upośledzenie umysłowe lub opóźnienie rozwoju psycho-motorycznego (nawet jeśli jest to pierwszy przypadek w rodzinie)
zaburzenia determinacji i różnicowanie płci oraz rozwoju płciowego
osoby w wieku rozrodczym, narażone na działanie szkodliwych czynników mutagennych. Ciężarne eksponowane na czynniki teratogenne (np. infekcje wirusowe, niektóre leki, alkohol i inne)
pary małżeńskie z niepowodzeniami rozrodu (dwa lub więcej poronienia samoistne, martwe porody lub niepłodność małżeńska)
kobiety powyżej 35 roku życia, planujące potomstwo
Model dziedziczenia autosomalnego dominującego:
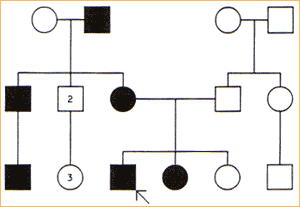
Model dziedziczenia autosomalnego recesywnego:
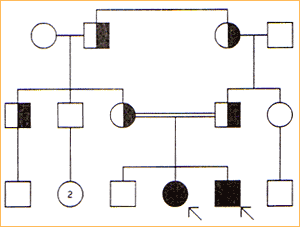
Model dziedziczenia sprzężonego z chromosomem X
(cechy sprzężone recesywnie):
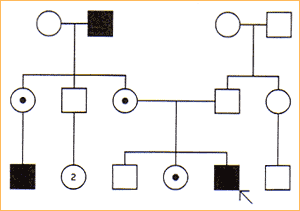
Model dziedziczenia sprzężonego z chromosomem X
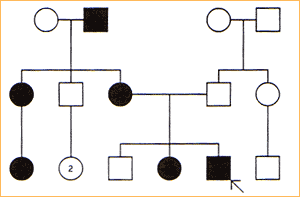
(cechy sprzężone dominująco):
Model dziedziczenia mitochondrialnego:
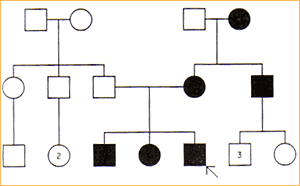
Cele diagnostyki prenatalnej:
ocena stanu płodu
w ciążach podwyższonego ryzyka wykluczenie wady rozwojowej i / lub choroby uwarunkowanej genetycznie
wykrycie wady rozwojowej i / lub choroby uwarunkowanej genetycznie, w przypadku których interwencja lekarska w okresie życia wewnątrzmacicznego stwarza szanse uratowania dziecka lub zmniejsza ryzyko powikłań okresu okołoporodowego
wykrycie u płodu wad wrodzonych, w przypadku których istnieje szansa uratowania dziecka pod warunkiem interwencji lekarskiej bezpośrednio po urodzeniu
wykrycie wad letalnych
Metody nieinwazyjne:
Ultrasonografia:
Zaleca się przynajmniej 3-krotne wykonanie w czasie trwania ciąży:
11-14 tydzień
ok. 20 tygodnia
ok.30 tygodnia
Cele:
potwierdzenie wieku ciążowego
ocena żywotności płodu
ocena ilości płodów
diagnostyka wad płodu
ocena przezierności fałdu karkowego (11-14tydzień ciąży)
Przezierność karkowa (NT):
rosnie wraz z wiekiem ciazowym, a tym samym dlugoscia ciemieniowo-siedzeniowa
(CRL-crown-rump lenght)
Normy:
CRL= 45mm (11Hbd); mediana wynosi 1.2mm
CRL= 84mm (13+6Hbd); mediana wynosi 1.9mm
Ryzyko indywidualne obliczamy mnozac wartosc ryzyka wstepnego dla danej pacjentki (wynikajacego z jej wieku oraz wieku ciazowego) przez roznice miedzy wartoscia NT zmierzona a mediana dla danego CRL
Badanie NT:
pozwala zidentyfikowac okolo 72% plodow z zespolem Downa
(odsetek wynikow falszywie dodatnich 5%):
NT= 3mm - ryzyko trisomi podwyzszone ponad ryzyko wynikajace z wieku matki 3 razy
NT= 4mm - ryzyko trisomi podwyzszone ponad ryzyko wynikajace z wieku matki 18 razy
NT= 5mm - ryzyko trisomi podwyzszone ponad ryzyko wynikajace z wieku matki 28 razy NT> 5mm - ryzyko trisomi podwyzszone ponad ryzyko wynikajace z wieku matki 38 razy
Inne przyczyny zwiększenia grubości fałdu karkowego:
niewydolnosc plodowego ukladu krazenia zwiazana z wada serca i/lub duzych naczyn
zastoj krwi zylnej spowodowany uciskiem
nieprawidlowy lub opozniony rozwoj ukladu limfatycznego
niedokrwistosc plodowa
hipoproteinemia
infekcje plodu powodujace niedokrwistosc lub niewydolnosc krazenia
Brak lub niedorozwój kości nosowej u płodu jako marker aberracji chromosomowych:
Brak kosci nosowej stwierdza sie:
u 67% plodow z trisomia 21
u 55% plodow z trisomia 18
u 34% plodow z trosomia 13
u 11% plodow z monosomia X (zesp TURNERA)
u 7% plodow z triploidia
Wady wrodzone a aberracje chromosomowe:
Wskazania do wykonania inwazyjnej diagnostyki prenatalnej z ocena kariotypu plodu:
zesp Dandy'ego-Walkera (1/1000)- wystepuje w ok 50 zespolach genetycznych (40% aberracje chomosomowe)
cystic hygroma (torbielowate struktury w okolicy potyliczno-szyjnej)- 75% aberracje chromosomowe (gl. zespol Turnera)
małogłowie(1/1000)- 15% aberracje chromosomowe (trisomia 13, delecja 4p i 5p)
brak ciala modzelowatego (1/1000) wystepuje w ok 100 zespolach genetycznych w tym trisomii 13 i 18
przepuklina przeponowa (1/3000) 20% aberracja chromosomowe
przepuklina sznura pepowinowego (1/3000) 60% aberracje chromosomowe
Wady wrodzone a aberracje chromosomowe:
Wskazania do wykonania inwazyjnej diagnostyki prenatalnej z ocena kariotypy plodu:
wady serca (5-10/1000)- 5% aberracje chromosomowe
zarosniecie przelyku (1/3000)- 4% aberracje chromosomowe
hipotrofia plodu - 1% aberracje chromosomowe (trisomia 21, triploidia)
wodonercze - 3% aberracje chromosomowe
Ryzyko aberracji chromosomowych wzrasta wraz z iloscia wad wrodzonych
Badania przesiewowe surowicy krwi matki:
I Trymestr ciazy:
badania przesiewowe w 1. trymestrze (test PAPP-A):
wolna podjednostkowa beta-hCG
PAPP-A
Test PAPP-A wraz z pomiarem NT (wykonywanie miedzy 11 a 14 tygodniem ciazy)
dla trisomii 21 (tzn zespolu Downa) - wykrywalnosc wynosi 86,3% przy odsetku wynikow falszywie dodatnich rownym 5%
dla wszystkich aberracji chromosomowych wykrywalnosc siega 90% przy 6% wynikow falszywie dodatnich
Polegaja na oznaczeniu markerow biochemicznych w surowicy krwi kobiet ciezarnych:
Alfa-fetoproteina (AFP)
podjednostka beta ludzkiej gonadotropiny kosmowkowej (beta-hCH)
nieskoniugowany estriol (uE3)
PAPP-A
inhibina A
II Trymestr ciąży:
test potrojny (wykonywany miedzy 15 a 19 tygodniem ciazy)
test potrojny polega na okresleniu stezen podjednoski beta-hCG, alfa-fetoproteiny, i nieskoniugowanego estriolu (uE3). Wykrywa ono 50-75% ciaz z trisomia 21 (zesp Downa), a falszywie dodatnie wyniki otrzymuje sie w 5% przypadkow. Przy uwzglednieniu NT, wykrywalnosc siega 85-90% przy odsetku wynikow falszywie dodatnich wynoszacym 5%. Patologie ciazy w jakich obserwuje sie wzrost lub spadek stezen markerow biochemicznych, badanych testerem potrojnym
podjednostka beta-hCG wyzsze stezenie w ciazy z trisomia 21, zasniadzie groniastym, ciazy mnogiej,nizsze stezenie w ciazy z trisomia 18, ciazy obumarlej
nieskoniugowany estriol (uE3) nizsze stezenie w ciazszy z trisomia 21. bezmozgowiem. aplazja lub hipoplazja nadnerczy
AFP
Patologia plodu w ktorej podwyzszone jest stezenie AFP w surowicy
otwarte wady cewy nerwowej
ubytki sciany brzucha
cystic hygroma
atrezja przewodu pokarmowego
choroby spory(epidermolysis bullosa simplex, aplasia cutis congenita)
Inne przycZyny matczyno-plodowe wzrostu AFP w surowicy:
ciaza mnoga,
ciaza obumarla,
wady lozyska lub pepowiny,
immunizacja Rh
Choroby matki w ktorych podwyzszone jest AFP:
guzy watroby,
ostre zapalenie watroby
Komorki i DNA pochodzenia plodowego we krwi kobiety ciężarnej:
we krwi ciezarnch krazy pewna ilosc komorek plodowych (kom. trofoblastu. pierwotne erytrocyty jadrzaste, granulocyty) dostepnych w badaniu. Ograniczeniami metody sa jednak mala ilosc komorek pochodzenia plodowego we krwi ciezarnej oraz trudnosci w odroznieniu komorek matcznych od komorek plodowych
odsetek komierech pochodzenia plodowego w pobranej probce krwi kobiety ciezarnej moze zostac zwiekszony poprzez zastosowanie metod automatycznego sortowania komorek; MACS (magnetic cell sorting) lub FACS (flourescense activated cell sorting). Na uzyskanych komorkach mozna nastepnie przeprowadzac badania cytogenetyczne technika FISH. Czulosc metody podobna jest do czulosci biochemicznych testow przesiewowych
we krwi kobiet ciezarnych wystepuja takze niewielekie ilosci wolnego DNA pochodzenia plodowego ktory moze byc wykorzystany do badan genetycznych technika PCR kurwa koniec.
Metody inwazyjne:
Aminopunkcja (aminocenteza):
wykonywana jest między 15-18 tyg. ciąży
pobranie 15-20 ml płynu owodniowego
ryzyko utraty ciąży (poronienia) w związku z badaniem wynosi 0,5 - 1%
Aminocenteza jest możliwa do wykonania także między 10 a 14 tyg ciąży (aminocenteza wczesna), ale wówczas ryzyko poronienia wzrasta do 2 %, a ryzyko wystąpienia wad kończyn (m.in. stóp końsko- szpotawych u płodu) jest wysokie.
Wskazania:
Podwyższone ryzyko urodzenia dziecka z abberacją chromosomową:
wiek ciężarnej >35l.
urodzone dziecko z abberacja chromosomową w poprzedniej ciąży
nosicielstwo translokacjii lub innej abberacji chromosomowej u jednego z rodziców
stwierdzenie w USG patologii płodu, sugerującej występowanie abberacji chromosom.
nieprawidłowy wynik testów biochemicznych (test PAPP-A, test potrójny)- ryzyko abberacji płodu >1:200
urodzenie dziecka z wadą cewy nerwowej z poprzedniej ciąży
Biopsja kosmówki:
wykonywana między 10-14 tyg. Ciąży
pobranie 5-10g tkanki
oczekiwanie na wynik 1-3 tyg.
ryzyko poronienia 2%
Stwierdzono związek między biopsją kosmówkową wykonywana przed 10 tyg. ciąży, a występowaniem wad ubytkowych kończyn płodu oraz niedorozwojem żuchwy i języka.
Wskazania:
podobnie jak w przypadku aminocentezy z wyjątkiem podwyższonego ryzyka ur. Dziecka z wadą cewy nerwowej
CVS jest metodą z wyboru w przypadku molekularnej diagnostyki prenatalnej chorób monogenowych
Kordocentoza:
wykonywana od 17 tyg. ciąży do momentu porodu
pobranie 0,5-1 ml krwi płodu z żyły pępowinowej
ryzyko poronienia 1-1,5 %
istnieje ryzyko zanieczyszczenia krwią matki i otrzymania błędnego wyniku kariotypu płodu
Wskazania:
wykrycie po 18 tyg. ciąży wad sugerujących możliwość abberacji chromosomowych u płodu
uzyskania materiału do badań cytogenetycznych (np. weryfikacja mozaikowatości) lub badań molekularnych
diagnostyka i leczenie konfliktu serologicznego, ocena morfologii krwi płodu
diagnostyka prenatalna genetycznie uwarunkowanych chorób płodu
Nowoczesne metody badań cytogenetycznych w diagnostyce prenatalnej:
FISH (fluorescencyjna hybrydyzacja In situ):
stosowana od lat 80-tych XX wieku
obok analizy chromosomów umożliwia także badanie jąder w stadium interfazy
zastosowanie sąd specyficznych dla chromosomów pary 13, 18, 21, X i Y umożliwia szybką diagnostykę najczęściej występujących aneuplodii chromosomowych
wymaga pozyskania niewielkiej ilości aminocytów bądź komórek kosmówki
wyniki badania uzyskuje się w przeciągu 24h
Array-CGH (porównawcza hybrydyzacja genomowa z wykorzystaniem mikromacierzy):
DNA pacjenta (wyizolowany z aminocytów płynu owodniowego) i DNA referencyjny (kontrolny) wyznakowane na różne kolory są hybrydyzowane do płytek mikromacierzy zawierających fragmenty genomowego DNA umożliwia detekcję niewielkich zmian ilościowych (duplikacje, delecje) w obrębie chromosomów pacjenta
wysoka rozdzielczość (1 mln -500 tys par zasad)
QF-PCR (ilościowy, fluorescencyjny PCR):
fragmenty DNA (powtórzenia mikrosatelitarne) podlegają amplifikacji, znakowaniu fluorescencyjnemu a ilość kopii mierzona jest podczas rozdziału elektroforetycznego
umożliwia szybką detekcję aneuplodii chromosomowych z wykorzystaniem DNA wyizolowanego z aminocytów lub komórek kosmówki
technika umożliwia również identyfikację przypadków disomii jednorodzicielskich (UPD)
MLPA (ang. Multiplex Ligation -dependent Probe Amplification):
metoda oparta na ligacji odpowiednych sond połączonych z reakcją amplifikacji
polega na amplifikacji nie łańcucha DNA, lecz sondy dodawanej do badanej próbki
Pojedyncza sonda zawiera dwa różne oligonukleotydy, z których każdy wiąże się ze starterem PCR.
Każda z sond wiąże się specyficznie z wybranym miejscem sekwencji.
Liczba otrzymanych w wyniku reakcji PCR sond zależy od liczby odpowiadających w badanym DNA.
równoczesna ocena ilościowa obecności kopii wieloeksonowych genów
Na podstawie zmian stosunków ilościowych poszczególnych fragmentów można wnioskować o delecjach bądź duplikacjach odpowiednich odcinków genów.
30
Typ MODY |
Lokalizacja zmiany |
Nazwa genu |
Częstość występowania |
MODY1 |
20q |
HNF - 4α (TCF4) |
rzadko 1 - 2% |
MODY2 |
7q |
GCK |
10 - 65% |
MODY3 |
12q |
HNF - 1α (TCF1) |
20 - 65% |
MODY4 |
13q |
IPF - 1 |
rzadko |
MODY5 |
17q |
HNF - 1β (TCF2) |
rzadko |
MODY6 |
2q32 |
Neurod1 |
rzadko |
MODY7 |
11q15.1 |
SUR1 E1506K |
rzadko |
Typ MODY |
Wiek ujawnienia cukrzycy |
Zmiana pierwotna |
Ciężkość cukrzycy |
Powikłania |
MODY1 |
młodzieniec, młody dorosły |
trzustka/inne |
ciężka |
często |
MODY2 |
po urodzeniu |
trzustka/inne |
przebieg łagodny |
rzadko |
MODY3 |
młodzieniec, młody dorosły |
trzustka/inne |
przebieg ciężki? |
często |
MODY4 |
młody dorosły |
trzustka/inne |
przebieg ciężki |
nieznane |
MODY5 |
? |
trzustka/inne |
przebieg ciężki |
choroby nerek |
MODY6 |
młody dorosły |
trzustka |
przebieg ciężki |
nieznane |
MODY7 |
dorośli |
trzustka |
przebieg łagodny |
nieznane |