UNIWERSYTET W BIAŁYMSTOKU
Charakterystyka pierwiastków
bloku konfiguracyjnego s i p
Wykonały:
Dorota Czajkowska
Monika Ostapkiewicz
BIAŁYSTOK 2000
SPIS TREŚCI
Wstęp........................................................................................................3
Charakterystyka pierwiastków bloku s...........................................5
1.1. Ogólna charakterystyka metali bloku s.........................................5
1.2. Charakterystyka wodoru H2..........................................................6
1.3. Charakterystyka helu He...............................................................8
1.4. Charakterystyka litowców.............................................................9
1.5. Charakterystyka berylowców.......................................................11
Charakterystyka pierwiastków bloku p.........................................15
2.1. Charakterystyka borowców.........................................................15
2.2. Charakterystyka węglowców.......................................................17
2.3. Charakterystyka azotowców........................................................20
2.4. Charakterystyka tlenowców.........................................................22
2.5. Charakterystyka fluorowców.......................................................24
2.6. Charakterystyka helowców..........................................................27
Rozpowszechnienie pierwiastków.....................................................28
3.1. Występowanie pierwiastków na Ziemi.........................................28
3.2. Występowanie pierwiastków w organizmach żywych.................29
Literatura................................................................................................30
Wstęp
W opisie makroskopowym pierwiastki chemiczne to substancje nie ulęgające reakcjom rozkładu, a więc stanowiące ostateczną granicę chemicznego rozkładu substancji. Z mikroskopowego punktu widzenia pierwiastek jest zbiorem atomów o takich samych właściwościach chemicznych, przy czym atomy mogą być połączone w cząsteczki.
Pierwiastki odkrywano stopniowo. Jedenaście było znanych jeszcze w starożytności: C, Pb, Cu, Au, Ag, Sn, Sb, Fe, Zn, Hg. Większość pierwiastków została wykryta w drugiej połowie XVIII i pierwszej połowie XIX wieku. W XX wieku poznano 39 nowych pierwiastków.
Pierwiastki chemiczne grupowano, opierając się na podobieństwach ich właściwości fizycznych i chemicznych, a w 1869r. Mendelejew uszeregował je według wzrastających mas atomowych.
Z kolei podstawą klasyfikacji pierwiastków chemicznych do czterech bloków układu okresowego - s, p, d, f było powtarzające się podobieństwo konfiguracji elektronowych pierwiastków.
Pierwiastki, których zewnętrzne powłoki składają się wyłącznie z elektronów s i p, noszą nazwę pierwiastków grup głównych. Są to pierwiastki bloku s i pierwiastki bloku p. W obrębie danego bloku pierwiastki wykazują wiele wspólnych właściwości fizycznych i chemicznych, dlatego w niniejszej pracy wykorzystano możliwość charakteryzowania całych grup bez konieczności charakterystyki poszczególnych pierwiastków.
W ramach podsumowania w ostatnim rozdziale przedstawiono udział pierwiastków w budowie skorupy ziemskiej i organizmów żywych.
Na następnej stronie znajduje się układ okresowy omawianych pierwiastków bloków s i p.
symbol pierwiastka
Okres |
1 |
2 |
13 |
14 |
15 |
16 |
17 |
18 |
||
1 |
1,007 |
|
|
|
|
|
|
2He 4,002 |
||
2 |
3Li 6,939 |
4Be 9,012 |
5B 10,81 |
6C 12,01 |
7N 14,00 |
8O 15,99 |
9F 18,99 |
10Ne 20,183 |
||
3 |
11Na 22,99 |
12Mg 24,312 |
13Al 26,98 |
14Si 28,08 |
15P 30,97 |
16S 32,06 |
17Cl 35,45 |
18Ar 39,948 |
||
4 |
19K 39,10 |
20Ca 40,08 |
31Ga 69,72 |
32Ge 72,59 |
33As 74,92 |
34Se 78,98 |
35Br 79,91 |
36Kr 83,80 |
||
5 |
37Rb 85,47 |
38Sr 87,62 |
49In 114,8 |
50Sn 118,69 |
51Sb 121,75 |
52Te 127,6 |
53I 126,9 |
54Xe 131,3 |
||
6 |
55Cs 132,9 |
56Ba 137,34 |
81Tl 204,37 |
82Pb 207,19 |
83Bi 208,98 |
84Po 210 |
85At 210 |
86Rn 222 |
||
7 |
87Fr 223 |
88Ra 226 |
||||||||
1H
liczba atomowa 1,007 masa atomowa
Rys. 1 . Układ okresowy pierwiastków bloku s i p.
1. Charakterystyka pierwiastków bloku s
Do bloku s zaliczamy metale - litowce i berylowe oraz gazy - wodór i hel. Właściwości wodoru i helu znacznie odbiegają od właściwości pierwiastków metalicznych bloku s, zatem w niniejszej pracy ich charakterystyka zostanie omówiona oddzielnie.
1.1 Ogólna charakterystyka metali bloku s
Metale bloku s są w zwykłych warunkach ciałami stałymi o charakterystycznym połysku (litowce są miękkie), mają niskie temperatury topnienia i wrzenia, małe gęstości (stąd nazwa „metale lekkie”), duże objętości molowe i promienie atomowe. Wielkość promienia atomowego jest zależna do liczby atomowej Z - im większa liczba atomowa tym większy promień atomu. Promienie kationów są mniejsze od promieni macierzystych atomów i również rosną wraz ze wzrostem liczby Z.
Litowce i berylowce barwią płomień palnika zarówno w stanie metalicznym, jak i związkach.
SYMBOL PIERWIASTKA |
BARWA PŁOMIENIA |
Na |
żółty |
K |
fioletowy |
Ca |
czerwony |
Li |
karminowy |
Sr |
karminowy |
Ba |
zielony |
Efekty te są związane ze zmianą stanu energetycznego elektronów, a więc ich przechodzeniem z powłok wyższych na niższe. W płomieniu palnika następują różne zderzenia drobin. Niektóre z nich powodują pobieranie przez elektron walencyjny kwantu energii. Powoduje to przeskok elektronu na wyższą powłokę. Następne zderzenie powoduje , że elektron oddaje porcję energii, wywołując błysk światła. Sam powraca na niższą powłokę, a światło rozchodzi się w przestrzeni i może dotrzeć do oka obserwatora.
Metale bloku s wykazują dużą reaktywność. Wynika ona z łatwości oddawania zewnętrznych elektronów i przechodzenia w kationy.
Li + hν → Li+ + e-
Be + hν → Be2+ + 2e-
Jonizacja może być wywołana zbliżeniem się atomu pierwiastka dążącego do zwiększenia liczby swych elektronów. Jonizację mogą także wywołać czynniki niemechaniczne, np. naświetlanie promieniowaniem elektromagnetycznym o odpowiedniej długości fali. Stąd zastosowanie np. cezu w fotokomórkach.
Jedną z charakterystycznych cech metali bloku s jest wyjątkowo duże podobieństwo w obrębie grupy, zaznaczone silniej niż w pozostałych grupach układu okresowego.
Reaktywność chemiczna metalu zależy przede wszystkim od liczby elektronów, które jego atom musi oddać w celu uzyskania struktury walencyjnej helowca. Im mniejsza jest ta liczba, tym większa jest reaktywność. Wyjątkowo duża reaktywność metali bloku s jest konsekwencją małej liczby elektronów w powłoce walencyjnej. Wzrost reaktywności w obrębie grupy 1. i 2. następuje w miarę wzrostu liczby powłok w rdzeniu i jest spowodowany coraz mniejszą energią potrzebną do oderwania elektronu walencyjnego.
Każdy metal bloku s tworzy związki na jednym stopniu utlenienia: litowce na stopniu +1 , a berylowce na +2. Z tlenem tworzą tlenki i nadtlenki, które mają charakter zasadowy. Jedynie BeO jest amfoteryczny.
Zarówno metale bloku s jak i ich tlenki reagują z wodą tworząc wodorotlenki. W reakcjach metali tego bloku z kwasami powstają odpowiednie sole i wodór.
1.2. Charakterystyka wodoru H2
Wodór jest pod wieloma względami pierwiastkiem wyjątkowym. Do jego unikalnych cech należy zdolność tworzenia związków przez oddawanie lub przyjmowanie jednego elektronu. Pierwiastki, które tworzą związki przez oddawanie elektronów, są uważane za elektrododatnie ; występują one w lewej części układu okresowego pierwiastków.
Natomiast pierwiastki, które przyłączają elektrony tworząc związki są określane jako elektroujemne i występują w prawej części układu okresowego. Wodór jest jedynym pierwiastkiem, który może zarówno oddawać, jak i przyłączać elektrony. Można go umieścić w grupie 1.(elektrododatniej) lub w grupie 17.(elektroujemnej). Żaden inny pierwiastek nie zajmuje dwuznacznej pozycji w układzie okresowym. Przeważnie umieszcza się wodór w grupie 1. , bardzo rzadko także w grupie 17.
Wodór wchodzi w reakcje z niemal wszystkimi pierwiastkami. Występuje przede wszystkim w wodzie i w węglowodorach, w związkach organicznych, w węglach kopalnych, ropie naftowej, gazie ziemnym oraz w tkankach roślinnych i zwierzęcych.
Wszystkie metale należące do 1. grupy mają jeden elektron walencyjny i wykazują tendencję do oddawania go, czyli przechodzenia w kation. Wodór nie posiada takiej tendencji, dąży bowiem wyraźnie do uwspólnienia tego elektronu z utworzeniem wiązania kowalencyjnego, uzyskując dublet elektronowy (zgodnie z regułą helowca).
Wodór jest mało reaktywny, w związkach występuje na +1 stopniu utlenienia (np. w HCl) lub na -1 (np. w NaH). Natomiast w warunkach naturalnych tworzy dwuatomowe cząsteczki H2.
Jak już wspomniano, wodór reaguje z wieloma pierwiastkami tworząc wodorki. W temperaturze pokojowej samorzutnie będzie reagował tylko z fluorem (dając HF), synteza innych wodorków wymaga doprowadzenia energii świetlnej w tworzeniu np. HCl, płomienia rozpoczynającego reakcję (w przypadku H2O) lub katalizatora (dla H2S i NH3).
Wodór z tlenem tworzy tzw. mieszaninę piorunującą, gdy stosunek objętościowy H2 i O2 wynosi 2:1. Zapalenie tej mieszaniny wywołuje gwałtowną reakcję syntezy, której towarzyszy eksplozja.
Wodór na skalę laboratoryjną otrzymuje się najczęściej w reakcji cynku z rozcieńczonym kwasem solnym lub siarkowym (VI):
Zn +2HCl→ZnCl2 + H2↑
Można także przeprowadzić tzw. elektrolizę wody (wodny roztwór odpowiedniego elektrolitu). W tej reakcji otrzymuje się także tlen:
2H2O
2H2 + O2
Do celów przemysłowych wodór można otrzymać trzema sposobami, mianowicie:
z metanu i pary wodnej w procesie konwersji :
CH4 + H2O→CO↑ + 3H2↑
z wody przy przepuszczaniu jej pary nad rozżarzonym koksem:
C + H2O→CO↑ + H2↑
Na obie skale wodór stosowany jest do wielu reakcji chemicznych oraz do syntezy amoniaku :
3H2 + N2→2NH3
a także do przeróbki tłuszczów ciekłych na stałe.
Wodór występuje w dwóch odmianach izomerycznych : orto- i parawodór. Różnica pomiędzy nimi polega na odmiennych spinach w cząsteczce H2.
WODORKI
typu soli kowalencyjne metaliczne
(np.CaH2) (np.CH4) (np.TiH2)
Rys 2. Schemat podziału wodorków
Najważniejsze związki wodoru to H2O, H2O2 (nadtlenek wodoru) w dwóch typowych produktach handlowych (30% perhydrolu i 3% wodzie utlenionej), HCl , H2SO4 , NH3 , węglowodory.
W normalnych warunkach wodór jest gazem złożonym z dwuatomowych cząsteczek, dającym się skroplić powyżej 20 K (-253°C), a zestalić poniżej 14 K. We wszystkich stanach skupienia pod względem elektrycznym wodór jest izolatorem, ale poddanie go ekstremalnie wysokiemu ciśnieniu może spowodować rozpad jego cząsteczek na atomy. W rezultacie stanie się on gazem i zacznie przewodzić prąd. Co więcej w latach 60. Neil W. Asheroft z Cornell University doszedł do wniosku, że zestalony metaliczny wodór będzie przewodził prąd elektryczny bez oporu.
Za pomocą działa gazowego w Livermore Laboratory zdołano poddać ciekły wodór takiej kompresji, że przekształcił się w ciekły metal. Wprawdzie pozostawał on w tym stanie krócej niż jedną milionową sekundy, ale to wystarczyło, by zmierzyć jego przewodność elektryczną.
Gdyby udało się utrzymać metaliczny wodór w temperaturze pokojowej i pod normalnym ciśnieniem atmosferycznym to miałby on niezwykłe właściwości elektryczne, magnetyczne, optyczne, termiczne i mechaniczne. Mógłby wówczas być nadprzewodnikiem w temperaturze pokojowej lub tworzyć czyste paliwo.
1.3. Charakterystyka helu He
Hel jest pierwiastkiem 17. grupy układu okresowego. Jest to lekki bezbarwny gaz, bezwonny, bez smaku i nie jest palny. Jednoatomowy, między atomami działają tylko siły van der Waalsa. Spośród wszystkich znanych substancji ma najmniejszą temperaturę wrzenia i skroplenia pod ciśnieniem normalnym. Nie rozpuszcza się w stałych i ciekłych metalach; skroplony występuje w dwóch odmianach : He I - o właściwościach normalnej cieczy, He II - o granicznie małej lepkości, granicznie małym przewodnictwie cieplnym i elektrycznym (stan „nadciekły”).
Hel jest gazem szlachetnym, chemicznie obojętnym. Nie reaguje z O2 , H2 , Mg , S , Na , nadtlenkiem sodu, wodorotlenkiem sodu ani na zimno, ani na gorąco, ani po wzbudzeniu wyładowaniami elektrycznymi czy naświetleniami. Nie tworzy klatratów.
Pierwiastek ten stosuje się w technice jądrowej jako czynnik chłodzący w technikach niskich temperatur, do napełniania balonów, do wytwarzania atmosfery obojętnej, przy produkcji neonów, w mieszaninie z tlenem - jako gaz do oddychania dla nurków.
1.4. Charakterystyka litowców
3Li, 11Na, 19K, 37Rb, 55Cs, 87Fr
Żaden z litowców nie występuje w stanie wolnym, ponieważ metale te wykazują dużą reaktywność chemiczną. Do najbardziej rozpowszechnionych w przyrodzie zaliczamy : sód i potas (po około 2,5% masowych). Sód występuje w postaci halitu (soli kuchennej) NaCl i saletry chilijskiej NaNO3 , a ponadto w wielu minerałach o złożonym składzie (np. boraks Na2B4O7 . 10 H2O). Potas występuje w postaci sylwinu KCl i saletry indyjskiej KNO3 . Pozostałe litowce występują w znikomych ilościach (około 10-3 % masowych) i w znacznym rozproszeniu.
Wszystkie litowce są srebrzystobiałe i na tyle miękkie, że można je kroić nożem. Ich twardość maleje wraz ze wzrostem liczby atomowej. Litowce mają małą gęstość : lit, sód i potas są lżejsze od wody. Temperatury topnienia i wrzenia litowców są niskie. Np. sód topi się w temperaturze 98 °C, wrze w 881°C. Prawidłowości te są konsekwencją stosunkowo dużych promieni atomowych oraz faktu, iż każdy atom dostarcza tylko jednego elektronu do wiązania metalicznego.
Reaktywność litowców jest największa wśród metali. Dlatego istnieje konieczność przetrzymywania ich w cieczy, zwykle w nafcie, która chroni metal przed kontaktem ze składnikami powietrza i równocześnie sama z nim nie reaguje. Im większa liczba atomowa tym reaktywniejszy litowiec. Najbardziej długożywotny izotop 223Fr ma okres półtrwania 21,8 min., który przekształcając się w izotop 223Ra, emituje promieniowanie β−.
Litowce we wszystkich związkach występują na stopniu utlenienia +1 w postaci jednododatnich kationów.
Litowce ulegają wielu reakcjom :
Reakcje z tlenem
Znane są tlenki Me2O, nadtlenki Me2O2 (zawierający w krysztale jon nadtlenkowy O22-) i ponadtlenki MeO2 (zawierający jon ponadtlenkowy O2−). W reakcji z tlenem atmosferycznym jedynie lit tworzy tlenek, pozostałe metale tworzą nadtlenki lub mieszaniny nadtlenków i ponadtlenków. W reakcji z wodą dają odpowiednie wodorotlenki :
Li2O + H2O
2LiOH
2Na2O2 + 2H2O
4NaOH + O2
Wodorotlenki litowców dobrze rozpuszczają się w wodzie i są całkowicie zdysocjowanymi zasadami.
Reakcje z wodą
Reakcja z wodą przebiega wg równania :
2Me + 2H2O→2MeOH + H2↑
i to tym gwałtowniej, im większa jest liczba atomowa metalu. Lit reaguje spokojnie, sód energicznie, potas i rubid zapalają się, cez wybucha.
Reakcje z kwasami
Wszystkie litowce reagują z rozcieńczonymi kwasami, wypierając z nich wodór, np.:
2Na + 2HCl→2NaCl + H2↑
Reakcje z niemetalami
Litowce reagują bezpośrednio z wodorem (po ogrzaniu), dając wodorki MeH (z anionem H− w krysztale). Z siarką tworzą siarczki Me2S, wodorosiarczki MeHS i wielosiarczki MeSn (2≤n≤6), a z azotem azotki Me3N. Znanych jest wiele innych związków z niemetalami np. halogenki
Najważniejsze związki litowców
Do najważniejszych związków metali lekkich możemy zaliczyć sole i wodorotlenki, jest to np. NaCl (chlorek sodu, sól kuchenna), NaOH (wodorotlenek sodu, soda żrąca, soda kaustyczna), Na2CO3 (węglan sodu, soda amoniakalna, soda kalcynowana) reagujący z kwasami wg schematu :
Na2CO3 + 2HCl
2NaCl + CO2 + H2O
CO32- + 2H+
CO2 + H2O
NaHCO3 (wodorowęglan sodu, soda oczyszczona) - podczas ogrzewania wydziela CO2 :
2NaHCO3(s)→Na2CO3(s) + CO2↑ + H2O↑
1.5. Charakterystyka berylowców
4Be, 12Mg, 20Ca, 38Sr, 56Ba, 88Ra
Z powodu znacznej reaktywności żaden z berylowców nie występuje w stanie wolnym. Najbardziej rozpowszechnionym pierwiastkiem tej grupy jest wapń (5. miejsce w szeregu rozpowszechnienia). Do najważniejszych minerałów wapnia i magnezu należą : magnezyt MgCO3, węglan wapnia CaCO3 (wapień, marmur, kalcyt bądź kreda, w zależności od postaci krystalograficznej), anhydryt CaSO4 i gips CaSO4⋅2H2O. Stront i bar występuje w postaci węglanów i siarczanów (np. baryt BaSO4), rad towarzyszy złożom uranu (jako kolejny produkt jego rozpadu). To właśnie w nich został odkryty przez Marię Skłodowską - Curie (1898).
Berylowce to srebrzystobiałe metale. Beryl jest kruchy i twardy, a wraz z magnezem w powietrzu ulegają pasywacji (pokrywają się warstewką tlenku). Magnez i kolejne metale można kroić nożem, przy czym ich twardość maleje wraz ze wzrostem liczby atomowej. Wzrost promieni atomowych w przypadku berylowców powoduje wzrost gęstości, temperatur topnienia i wrzenia. Wprawdzie są on wyższe od litowców, ale niższe niż metali ciężkich.
Reaktywność berylowców wyraźnie wzrasta w miarę powiększania się liczby atomowej. Prawidłowości można zaobserwować w reakcjach z tlenem i wodą. Wynika to ze wzrostu promienia atomowego i zmniejszania energii jonizacji.
Berylowce we wszystkich związkach występują na +2 stopniu utlenienia.
Do charakterystycznych reakcji berylowców możemy zaliczyć :
Utlenianie
Berylowce utleniają się w powietrzu, tworząc tlenki MeO, tylko bar przechodzi w nadtlenek BaO2.
Tlenek berylu BeO jest amfoteryczny, nie rozpuszcza się w H2O, reaguje zaś z kwasami i przechodzi w kation :
BeO +2H+
Be2+ + H2O
oraz z zasadami - tworząc w roztworze wodnym anion tetrahydrokso berylanu (II) [Be(OH)4]2- i w niewielkich ilościach BeO22- :
BeO + 2OH− + H2O
[Be(OH)4]2-
BeO + 2OH−
BeO22- + H2O
w podwyższonej temperaturze tlenek berylu w reakcji z NaOH tworzy berylan sodu :
BeO(s) + 2NaOH
Na2BeO2(s) + H2O
Pozostałe tlenki berylowców są zasadowe i reagują z wodą, np.:
MgO(s) + H2O(c)→Mg(OH)2(s)
Wodorotlenek berylu jest amfoteryczny, wodorotlenek magnezu to słaba zasada, a wodorotlenki pozostałych metali są mocnymi zasadami.
Reakcje z wodą
Berylowce mniej energicznie reagują z wodą (beryl i magnez dopiero po ogrzaniu); produkty reakcji to wodorotlenek i wodór :
Me + 2H2O→Me(OH)2 + H2↑
Reakcje z wodorotlenkami
Spośród berylowców jedynie beryl (może tworzyć aniony) roztwarza się w stężonych zasadach :
Be + 2NaOH + 2H2O→Na2[Be(OH)4] + H2↑
Na2[Be(OH)4](s)→ Na2BeO2(s) + 2H2O↑
Reakcje z kwasami
Berylowce reagują z większością kwasów, wypierając z nich wodór :
Me + 2H+→Me2+ + H2↑
Sole berylowców : węglany, siarczany(VI), fosforany(V), fluorki, szczawiany są słabo rozpuszczalne w wodzie, a ich rozpuszczalność maleje wraz ze wzrostem liczby atomowej. Pozostałe sole są rozpuszczalne.
Najważniejsze związki berylowcow
Najważniejsze związki berylowców to np. CaCO3 (węglan wapnia, wapień, marmur, kreda). W przemyśle chemicznym jest surowcem do otrzymywania wapna palonego i CO2 :
CaCO3→CaO + CO2↑
Węglan wapnia pochłaniając wodę z dwutlenkiem węgla przechodzi w łatwiej rozpuszczalny wodorowęglan wapnia :
CaCO3(s) + H2O + CO2(aq)
Ca(HCO3)2(aq)
Podczas, gdy następuje wzrost temperatury lub obniżenie ciśnienia, wówczas maleje rozpuszczalność dwutlenku węgla i następuje proces odwrotny :
Ca(HCO3)2(aq)
CaCO3(s) + CO2 + H2O
Taki proces przekształcania wodorowęglanów w węglany przebiega również podczas gotowania wody, powodując usunięcie niektórych przyczyn twardości wody. Zjawisko to utrudnia pienienie się mydła i innych środków piorących, w wyniku obecności różnych soli, głównie wodorowęglanów, chlorków oraz siarczanów wapnia i magnezu. Gotując bowiem wodę gwałtownie maleje rozpuszczalność dwutlenku węgla i obecne wodorowęglany osadzają się na ścianach naczynia w postaci tzw. kamienia kotłowego. Można też w inny sposób usunąć twardość wody np. dodanie substancji zasadowych :
Ca(HCO3)2 + Ca (OH)2→2CaCO3↓ + 2H2O
czyli
HCO3- + OH-
CO32- + H2O
Ca2+ + CO32-→CaCO3↓
CaO (tlenek wapnia, wapno palone); proces gaszenia wapna, czyli przeprowadzenie wapna palonego CaO w gaszone Ca(OH)2 przebiega następująco:
Ca(OH)2(s) + CO2(g)→CaCO3↓ + H2O↑
Ca(OH)2 (wodorotlenek wapnia, wapno gaszone) - nasycony jego roztwór służy do wykrywania dwutlenku węgla :
Ca(OH)2(aq) + CO2(g)→CaCO3↓ + H2O
Jeżeli dwutlenek węgla jest nadal do roztworu doprowadzany, to osad węglanu wapnia zaczyna się rozpuszczać przechodząc w wodorowęglan :
CaCO3(s) + CO2(g) + H2O
Ca(HCO3)2(aq)
CaSO4.2H2O (dwuhydrat siarczanu wapnia, gips, selenit) - gips podczas prażenia traci część wody krystalicznej i przechodzi w półhydrat tzw. gips palony :
2(CaSO4. 2H2O)→(CaSO4)2. H2O + 3H2O↑
2. Charakterystyka pierwiastków bloku p
Blok p obejmuje pierwiastki grup głównych od 13. do17. oraz grupę 18. bez helu. Pierwiastki kolejnych grup różnią się od siebie liczbą elektronów walencyjnych: od 3 (w grupie 13.) do 8 (w grupie 18.). Powoduje to bardzo duże zróżnicowanie właściwości w obrębie bloku p.
Przy przejściu od jednej grupy do drugiej obserwuje się znaczną zmianę właściwości. Po kilku takich przejściach obraz cech chemicznych zmienia się całkowicie, dlatego też poniżej omówiono poszczególne grupy pierwiastków z uwzględnieniem stopni utlenienia, reakcji z tlenem, wodorem, metalami i niemetalami. Nieco uwagi poświecono również na przedstawienie alotropii pierwiastków i praktycznemu wykorzystaniu ich związków.
2.1. Charakterystyka borowców
5B, 13Al, 31Ga, 49In, 81Tl
Pierwszy pierwiastek z grupy 13- bor jest pólmetalem, a pozostałe pierwiastki tej grupy są metalami.
W normalnych warunkach ciśnienia i temperatury wszystkie borowce są ciałami stałymi.
Bor występuje najczęściej w postaci ciemnego proszku, natomiast metale: glin, gal, ind, tal mają zabarwienie srebrzystobiałe.
Stopnie utlenienia
Trójelektronowa powłoka walencyjna (s2p1) determinuje maksymalny stopień utlenienia +3. Znane są jednak związki borowców na niższych stopniach utlenienia, np. tal na +1 w tlenku talu Tl2O.
Reaktywność borowców jest umiarkowana, wyraźnie mniejsza od reaktywności metali grupy 2.
Reakcje z tlenem
W podwyższonej temp. borowce łączą się z tlenem, dając tlenki o ogólnym wzorze: E2O3 , np.
4Al + 3O2 → 2Al2O3
B2O3 - kwasowy
Al2O3 - amfoteryczny
Ga2O3 - amfoteryczny
In2O3 - amfoteryczny
Tl2O3 - zasadowy
Tl2O - zasadowy
Reakcje z kwasami
Borowce reagują z kwasami tworząc sól i wodór, np.:
2Al + 6HCl → 2AlCl3 + 3H2↑
Reakcje z fluorowcami
Wszystkie borowce reagują bezpośrednio z fluorowcami dając halogenki,
2Al + 3Cl2 → 2AlCl3
Reakcje z wodorem
Pierwiastki 13. grupy nie reagują bezpośrednio z wodorem. Metodami pośrednimi otrzymano szereg bromowodorów: B2H6 , B4H10 , B10H16 oraz wodorki typu EH3 pozostałych borowców.
W podwyższonej temp. wodorki borowców reagują z wodą:
B2H6(g) + 6H2O → 2H3BO3(aq) + 6H2↑
AlH3(s) + 3H2O → Al(OH)3(s) + 3H2↑
Na szczególną uwagę wśród borowców zasługuje glin ze względu na liczne zastosowania.
Glin jest srebrzystobiałym metalem, dającym się łatwo walcować i wyciągać w druty. Dobrze przewodzi ciepło i elektryczność.
Stanowi główny składnik cennych stopów lekkich, np. duraluminium (glin + miedź + magnez + mangan), stosowanych w przemyśle lotniczym i samochodowym. Glin używany jest do produkcji przewodów elektrycznych, folii do opakowań, naczyń kuchennych, cystern do przewozu kwasu azotowego oraz do budowy aparatury chemicznej.
2.2. Charakterystyka węglowców
6C, 14Si, 32Ge, 50Sn, 82Pb
W grupie węglowców w miarę wzrostu liczby atomowej następuje zmiana właściwości pierwiastków od niemetalicznych do metalicznych. Węgiel jest niemetalem, krzem i german mają właściwości półmetaliczne, natomiast cyna i ołów są metalami.
Wszystkie węglowce są ciałami stałymi.
Stopnie utlenienia
Typowym stopniem utlenienia węglowców jest +4. Ponadto węgiel w związkach z metalami (węglikach) i w metanie występuje na stopniu utlenienia -4. Wszystkie węglowce mogą występować na +2 stopniu utlenienia.
Reaktywność węglowców jest niewielka.
Reakcje z tlenem
Spalanie węgla w powietrzu lub w tlenie prowadzi do dwutlenku węgla(CO2) lub przy niedostatecznej ilości tlenu - do tlenku węgla (CO).
Dwutlenek węgla CO2 ma charakter kwasowy. Tlenek węgla CO jest zaliczany do grupy tlenków obojętnych, chociaż w podwyższonej temp. reaguje z wodorotlenkiem sodu NaOH:
CO(g) + NaOH(aq)
HCOONa(aq)
Analogiczne tlenki tworzą pozostałe pierwiastki:
SiO2 - kwasowy SnO2 - amfoteryczny
SiO - obojętny SnO - amfoteryczny
GeO2 - amfoteryczny PbO2 - amfoteryczny
GeO - kwasowy PbO - amfoteryczny
Reakcje z metalami
Niemetale 14. grupy tworzą połączenia z metalami, tzw. węgliki i krzemki. Węgliki otrzymuje się przez ogrzewanie odpowiedniego metalu lub jego tlenku z węglem lub węglowodorami:
CaO + 3C
CaC2 + CO
Węgliki łatwo reagują z wodą, tworząc różne węglowodory:
CaC2 + 2H2O → C2H2 + Ca(OH)2
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
Reakcje z niemetalami
Znane są związki węglowców z wieloma niemetalami,np. CX4, gdzie X - fluorowiec; CS2.
Azotek krzemu Si4N3 należy do materiałów o twardości diamentu i znacznej odporności chemicznej.
Reakcje z wodorem
Wszystkie węglowce tworzą kowalencyjne wodorki o wzorze ogólnym: EH3.
Węgiel daje ogromna liczbę łańcuchowych i pierścieniowych węglowodorów stanowiących przedmiot chemii organicznej.
Istnieją również liczne krzemowodory i germanowodory - analogi łańcuchowych węglowodorów,np.Si2H6 , Ge2H6 , Si3H8 , Si4H10 i wiele innych.
Natomiast cynowodór SnH4 i ołowiowodór PbH4 są jedynymi znanymi wodorkami tych pierwiastków.
Metan jako wodorek węgla CH4 zachowuje się obojętnie względem wody, podczas gdy wodorek krzemu reaguje energicznie z uwolnieniem wodoru:
SiH4 + 3H2O → H2SiO3 + 4H2
Podobnie zachowują się germanowodór i nietrwale cynowodór i ołowiowodór.
Alotropia pierwiastków
Krzem i german występują w jednej odmianie krystalicznej, której odpowiada sieć przestrzenna typu diamentu. Znane są również odmiany bezpostaciowe - ciemne proszki.
Ołów ma sieć przestrzenną typową dla metali.
Cyna tworzy trzy odmiany alotropowe, z których dwie, cyna α i cyna β zasługują na komentarz. W zwykłych warunkach cyna występuje w srebrzystobiałej, typowo metalicznej postaci β. Gdy temperatura spada poniżej 13°C, wowoczas cyna przechodzi w odmianę α, rozsypuje się w szary proszek, ogarnia ja tzw. „trąd cynowy”.
Do niedawna pewne było, iż węgiel występuje w dwóch odmianach alotropowych - jako diament i grafit. Warto wspomnieć również o strukturach drobnokrystalicznych węgla, bezpostaciowych, nie będących jego odmianą alotropową w ścisłym tego słowa znaczeniu, są to różne sadze, węgiel szklisty, grafit turbostratyczny.
Wydawało by się, ze węgiel to jeden z najbardziej poznanych elementów tablicy układu okresowego Mendelejewa. W 1985r miało jednak miejsce wydarzenie, które zrewolucjonizowało dotychczasowa wiedzę o węglu: Kresto, Smalley i Curl odkryli nowa odmianę alotropową węgla - fulereny. Struktura krystaliczna fulerenów jest całkowicie różna od diamentu, czy grafitu - tworzą ją cząsteczki węgla o liczbie atomów począwszy od sześćdziesięciu i unikatowej strukturze przestrzennej.
Fulereny stanowią jedyną formę cząsteczkową węgla.
Odkrycie fulerenow, uhonorowane Nagroda Nobla miało charakter niemalże przypadkowy, było wynikiem badań mających ma celu poznanie struktury Wszechświata.
Zakres tematyk związanych z obszarami perspektywicznych zastosowań fulerenow jest niezwykle szeroki; mamy tu m.in. inżynierię materiałową, fizykę ciała stałego, biochemie i chemie medyczna, fizykochemie polimerów, chemie paliw, nadprzewodnictwo.
Rzeczywisty zakres aktualnych badań dotyczących zastosowań fulerenów jest jednakże właściwie nieznany.
Zainteresowanie ludzkości życiem przodków w odległych epokach sprawiło, że zaczęto szukać nowych metod pozwalających poznać wiek wykopalisk.
Począwszy od 1955r. do określania wieku szczątków organicznych takich jak kości, muszle i rośliny służy głównie węgiel promieniotwórczy 14C. Metoda została rozwinięta przez amerykańskiego fizyka Willarda Libby z uniwersytetu w Chicago, który w 1960r otrzymał Nagrodę Nobla w dziedzinie chemii.
Rośliny oraz zwierzęta absorbują dwutlenek węgla CO2 z powietrza przez całe swoje życie, wdychając jeden atom 14C na każde 1012 atomów 12C. Po śmierci organizmu jego atomy 14C zaczynają się rozpadać, atomy 12C rozkładowi nie ulęgają. Ponieważ znana jest prędkość rozpadu 14C , która jest niezależna od czynników zewnętrznych, można obliczyć wiek znaleziska licząc całkowita liczbę atomów węgla i porównując liczbę atomów 14C i 12C. Okres połowicznego rozpadu 14C wynosi około 5700lat.
2.3. Charakterystyka azotowców
7N, 15P, 33As, 51Sb, 83Bi
W grupie azotowców, podobnie jak w grupie węglowców wraz ze wzrostem liczby atomowej maleje niemetaliczny charakter pierwiastków, a równocześnie wzrasta charakter metaliczny.
Azot i fosfor są niemetalami, arsen i antymon - półmetalami, a bizmut jest typowym metalem.
W normalnych warunkach azot jest gazem o bardzo trwałych cząsteczkach dwuatomowych N2. Pozostałe azotowce są ciałami stałymi, występującymi w wielu odmianach alotropowych.
Stopnie utlenienia
Azotowce występują na stopniu utlenienia -3 w związkach z wodorem i metalami oraz na stopniach +3 i +5 w związkach z niemetalami. W przypadku azotu możliwe są wszystkie stopnie utlenienia od -3 do +5.
Reaktywność azotowcow jest umiarkowana.
Reakcje z tlenem
Z tlenem azot łączy się bardzo opornie. Spośród 6 znanych tlenków azotu: N2O, NO, NO2, N2O4, N2O5, N2O3 , tylko tlenek azotu NO można otrzymać przez bezpośrednią syntezę w temperaturze łuku elektrycznego:
N2 + O2 → 2NO
Temperatury tego rzędu wytwarzają się w przyrodzie podczas wyładowań atmosferycznych, dlatego powietrze po burzy zawiera nieznaczne ilości tlenku azotu.
Inne tlenki azotu otrzymuje się metoda pośrednią:
2NO + O2 → 2NO2
N2O - obojętny N2O5 - kwasowy N2O3 - kwasowy
NO - obojętny NO2 - kwasowy
Znacznie łatwiej od azotu łączy się z tlenem fosfor. Spalany w ograniczonej ilości powietrza:
4P + 3O2 → 2P2O3
i w czystym tlenie:
4P + 5O2 → 2P2O5
Oba tlenki fosforu są bezwodnikami kwasowymi. Z pięciotlenku można otrzymać wiele kwasów:
P2O5 + H2O → 2HPO3 (kwas metafosforowy V)
P2O5 + 2H2O → H4P2O7 (kwas pirofosforowy V)
P2O5 + 3H2O → 2H3PO4 (kwas ortofosforowy V)
Dalsze azotowce również tworzą po dwa tlenki: E2O3 i E2O5 .
Moc kwasów tlenowych utworzonych z tych tlenków maleje w szeregu:
HNO3 > H3PO4 > H3AsO4
Kwas antymonowy i bizmutowy nie są znane.
Reakcje z metalami
Azot i fosfor reagują bezpośrednio z metalami, najczęściej po ogrzaniu i dają odpowiednio azotki bądź fosforki:
3Mg + N2 → Mg3N2
Reakcje z niemetalami
Znane są związki azotowcow z fluorowcami i siarkowcami.
Na uwagę zasługuje fakt, że azot tworzy tylko związki typu NX3(X - fluorowiec), nie są jednak znane połączenia NX5. Natomiast fosfor i kolejne pierwiastki oprócz drobin PX3, AsX3 itd., tworzą również PX5, AsX5 itd..
Reakcje z wodorem
Wszystkie azotowce tworzą wodorki typu: EH3.
Synteza amoniaku zachodzi w wysokiej temp. i w obecności katalizatora:
3H2 + N2 → 2NH3
W miarę wzrostu liczby atomowej azotowca syntezy wodorków stają się coraz trudniejsze. W odróżnieniu od wodorków fluorowców i tlenowców, wodorki azotowców nie wykazują cech kwasowych. Amoniak ma charakter zasadowy, pozostałe wodorki zachowują się obojętnie względem wody.
Alotropia pierwiastków
Azot nie tworzy odmian alotropowych. Każdy z pozostałych pierwiastków tej grupy występuje w kilku odmianach.
Na przykład fosfor tworzy kilka odmian, z których znaczenie praktyczne mają dwie: fosfor biały i fosfor czerwony. Różnice między nimi są znaczne. Fosfor biały jest miękką, żółtawobiałą masą o przykrym zapachu. Odmiana czerwona stanowi ciemnoczerwony proszek. Zarówno fosfor biały jak i czerwony praktycznie nie rozpuszcza się w wodzie. Fosfor czerwony nie rozpuszcza się również w większości rozpuszczalników organicznych i z tego względu nie jest szkodliwy dla organizmu ludzkiego, w odróżnieniu od silnie trującego fosforu białego, który rozpuszcza się w rozpuszczalnikach organicznych i płynach ustrojowych organizmu. Już 0,1g fosforu białego stanowi dla człowieka dawkę śmiertelną.
2.4. Charakterystyka tlenowców
8O, 16S, 34Se, 52Te, 84Po
Z 16. grupy pierwiastków: tlen, siarka i selen są niemetalami, tellur jest pólmetalem, a polon- metalem.
Tlen jest bezbarwnym i bezwonnym gazem, nieco rozpuszczalnym w wodzie. Siarka to żółte ciało stałe- praktycznie nie rozpuszcza się w wodzie. Dalsze tlenowce są również ciałami stałymi i wszystkie tworzą po kilka odmian alotropowych.
Stopnie utlenienia
Tlen różni się dość istotnie od pozostałych pierwiastków z powodu znacznie większej elektroujemnosci, dzięki czemu we wszystkich związkach, z wyjątkiem OF2 występuje na ujemnych stopniach utlenienia, z reguły -2 i w nadtlenkach na
-1. Pozostałe tlenowce oprócz stopnia utlenienia -2 wykazują w związkach dodatnie stopnie utlenienia +4 i +6.
Tlenowce wykazują znaczną reaktywność.
Reakcje z tlenem
Tlenowce spalają się dając dwutlenki: SO2, SeO2, TeO2, które można utlenić w obecności katalizatorów do odpowiednich trójtlenków, np.:
2 SO2 + O2
2SO3
Dwutlenki i trójtlenki pierwiastków 16. grupy są tlenkami kwasowymi.
Reakcje z wodorem
Powszechnie znana, wybuchowa reakcja tlenu z wodorem rozpoczyna się dopiero po zapaleniu substratów, pozostałe tlenowce łącza się bezpośrednio z wodorem, tworząc wodorki typu: H2E.
Wodne roztwory wodorków siarkowców to kwasy beztlenowe. Moc tych kwasów rośnie w szeregu:
H2O < H2S < H2Se < H2Te
Oprócz wodorków H2E istnieją również połączenia nadtlenkowe, dwusiarczkowe oraz polisiarczkowe.
Reakcje z metalami
Tlen reaguje już w temp. pokojowej z metalami lekkimi, a po ogrzaniu z większością metali ciężkich.
Siarka i pozostałe tlenowce też reagują z większością metali, tworząc siarczki, selenki, itd.
Reakcje z niemetalami
Istnieje wiele związków tlenowców z innymi niemetalami, ale tylko cześć z nich można otrzymać przez bezpośrednią syntezę.
W normalnych warunkach tlen łączy się tylko z fosforem. Reakcja z siarką wymaga ogrzania, a z azotem tlen reaguje dopiero w temp. łuku elektrycznego.
Siarka, selen i tellur łatwo łącza się z fluorem tworząc, przy nadmiarze fluoru, odpowiednie szesciofluorki, np.: SF6, z chlorem dają tylko dwu- i czterochlorki, np.: SCl2 i SCl4.
Alotropia pierwiastków
Tlen występuje w dwu odmianach: jako tlen ,,zwykły” w postaci cząsteczek dwuatomowych O2 oraz jako ozon w cząsteczkach trójatomowych O3, również gaz w normalnych warunkach.
Ozon stanowi odmianę nietrwałą: powstaje z tlenu O2 w czasie wyładowań elektrycznych sztucznych bądź atmosferycznych. Ozon pełni w stratosferze ważną funkcje, pochłania bowiem większość promieni nadfioletowych i chroni w ten sposób życie biologiczne przed skutkami nadmiernego promieniowania.
Siarka w stanie stałym występuje w dwu odmianach alotropowych, zwanych siarką rombową Sα i siarką jednoskośną Sβ. Obie odmiany tworzą kryształy zbudowane z ośmioatomowych cząsteczek S8 w kształcie pierścieni. Siarka rombowa jest trwała w temp. pokojowej, po ogrzaniu do temp. 95,5°C ulega przemianie w siarkę jednoskośną.
Szybkie chłodzenie ciekłej siarki daje odmianę bezpostaciową, zwaną siarką plastyczną.
2.5. Charakterystyka fluorowców
9F, 17Cl, 35Br, 53I, 85At
Florowce są typowymi niemetalami (jedynie astat wykazuje cechy półmetaliczne). Fluor i chlor są żółtozielonymi gazami o charakterystycznej ostrej woni, brom jest ciemnobrunatną lotną cieczą, a jod ciałem stałym o metalicznym połysku.
Astat nie występuje w przyrodzie, jest pierwiastkiem promieniotwórczym o krótkim okresie półtrwania.
Stopnie utlenienia
Fluor najbardziej elektroujemny ze wszystkich pierwiastków, występuje na stopniu utlenienia -1. Pozostałe fluorowce mogą występować na różnych stopniach utlenienia od -1 do +7.
Fluorowce są bardzo reaktywne, ich atomy łatwo pobierają elektron i przechodzą w proste aniony.
Reakcje z tlenem
Z tlenem fluorowce łącza się stosunkowo trudno. Chociaż znanych jest wiele tlenków, większość z nich to substancje nietrwale, otrzymane w sposób pośredni.
Fluor nie tworzy kwasów tlenowych. Chlor i jod tworzą po 4 kwasy tlenowe, a brom tylko 2.
Moc kwasów tlenowych rośnie ze wzrostem liczby atomów w cząsteczce, np.:
HClO < HClO2 < HClO3 < HClO4
i maleje w miarę wzrostu liczby atomowej fluorowca:
HClO > HBrO > HIO ; HclO3 > HbrO3 > HIO3
Reakcje z wodorem
Wszystkie fluorowce reagują z wodorem, tworząc wodorki typu HX, o ogólnej nazwie fluorowcowodory, np.:
H2 + F2
2HF
H2 + Cl2 → 2HCl
W miarę wzrostu liczby atomowej efekt cieplny reakcji tworzenia fluorowcowodorów ulega zmniejszeniu.
HCl, HBr, HI są gazami, a HF jest cieczą. W stanie gazowym fluorowcowodory są związkami kowalencyjnymi, jednak w roztworach wodnych ulęgają dysocjacji jonowej. Roztwory wodne HCl, HBr, HI są mocnymi kwasami. Ich moc rośnie w szeregu:
HCl < HBr < HI
Reakcje z metalami
Reakcje fluorowców z metalami lekkimi i większością metali ciężkich przebiegają najłatwiej i często gwałtownie. Produktami tych reakcji są halogenki, np.:
2Fe + 3Cl2 → 2FeCl3
Reakcje z niemetalami
Fluorowce tworzą liczne związki z niemetalami, ale tylko niektóre z nich powstają w bezpośredniej syntezie.
Reakcje z wodą
Chlor i brom rozpuszczają się w wodzie dość dobrze, dając bezbarwną wodę chlorową i brunatną wodę bromową.
Fluor gwałtownie rozkłada wodę z wytworzenie fluorku wodoru i wydzieleniem wolnego tlenu:
2F2 + 2H2O → 4HF + O2↑
Chlor i brom reagują z wodą powoli i w roztworze ustala się równowaga:
Cl2 + H2O
H+ + Cl− + HClO
Br2 + H2O
H+ + Br− + HBrO
Pod wpływem światła następuje powolny rozkład kwasów chlorowego i bromowego z wytworzeniem tlenu atomowego:
HClO → HCl + O
HBr → HBr + O
Reakcje z roztworem halogenków
Każdy chlorowiec wypiera chlorowce o większej liczbie atomowej z wodnych roztworów ich halogenków:
Cl2 + 2NaBr → 2NaCl + Br2
2.6. Charakterystyka helowców
10Ne, 18Ar, 36Kr, 54Xe, 86Rn
Wszystkie helowce są bezwonnymi i bezbarwnymi gazami. Mają niskie temperatury topnienia i wrzenia. Ich drobiny są jednoatomowe.
Helowce występują w niewielkich ilościach w powietrzu. Najwięcej jest argonu (ok. 1%).
Do połowy XX wieku nie znano żadnych związków helowców, uważano je za chemicznie bierne i nazwano gazami szlachetnymi. W dalszym ciągu nie są znane trwałe związki helu, neonu i argonu. Inne helowce tworzą nieliczne związki, trwale tylko w niskich temperaturach.
Stosunkowo najwięcej otrzymano związków ksenonu, np.: XeO3, XeO4, XeF4.
Pierwszy związek otrzymano w 1962r , był to XePtF6.
Tworzenie związków przez helowce jest możliwe tylko w stanie wzbudzonym, co uzyskuje się przez zastosowanie specjalnych warunków reakcji, tj: naświetlanie promieniami ultrafioletowymi lub promieniami γ.
Pobudzone polem elektrycznym helowce emitują światło: hel- żółte, neon- czerwonopomaranczowe, argon- czerwone lub niebieskie.
3. Rozpowszechnienie pierwiastków
Analiza spektralna układu słonecznego, gwiazd i mgławic, jak również analiza chemiczna meteorytów pozwoliła stwierdzić, że w Kosmosie i na Ziemi występują te same pierwiastki, jednak ich rozpowszechnienie jest zupełnie różne.
3.1. Występowanie pierwiastków na Ziemi
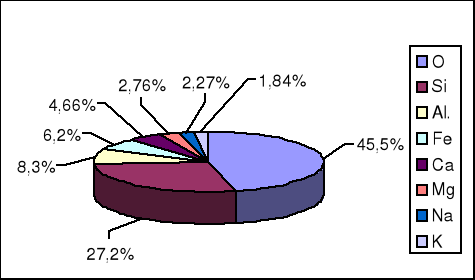
Rozpowszechnienie pierwiastków w przyrodzie jest bardzo zróżnicowane. Tylko niewielka ich liczba występuje w postaci wolnej, na przykład: azot, siarka, rtęć, platyna i złoto. Większość można uzyskać wyłącznie na drodze rozkładu odpowiednich minerałów. Procentowa zawartość pierwiastków w kuli ziemskiej stanowi stały przedmiot badań, ponieważ tylko nieznaczna część skorupy Ziemi jest bezpośrednio dostępna. Procentowy udział pierwiastków w kuli ziemskiej oszacowany na podstawie badań chemicznych i analizy rozchodzenia się fal sejsmicznych przedstawiony został graficznie na diagramie 1.
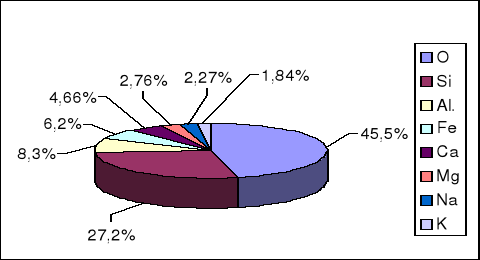
Diagram 1. Skład wagowy (w %) pierwiastków w skorupie ziemskiej
Spośród 88 pierwiastków naturalnych zaledwie 8 tworzy aż 99,3% skorupy ziemskiej.
Tlen stanowi prawie połowę jej masy , krzem jedną czwartą, a pozostałe pierwiastki tylko niewielkie ułamki.
W skorupie ziemskiej przeważają związki o charakterze kwasowym, w których dominują krzemiany. W mniejszych ilościach niż krzemiany występują węglany. Do bardziej rozpowszechnionych należą też siarczany i siarczki.
Atmosfera ziemska prawie zupełnie nie zawiera wodoru, który rozproszył się w przestrzeni międzygwiezdnej. Zawartość helu jest również niewielka.
Głównym składnikiem powietrza jest azot, a następnym tlen. Spośród helowców w największej ilości występuje argon. W ostatnich latach odkryto, że w powietrzu może występować gazowy pierwiastek promieniotwórczy - radon.
Hydrosfera składa się w 98% z wód oceanicznych i morskich, a w 2% z wód słodkich. Woda morska jest 3% roztworem różnych soli i obecnie stanowi surowiec do uzyskiwania niektórych pierwiastków, tj. chlor, sód, magnez, brom. Z roślin morskich otrzymuje się natomiast jod.
3.2. Występowanie pierwiastków w organizmach żywych
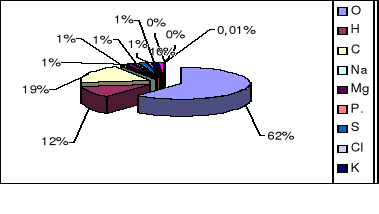
Wszystkie organizmy żywe składają się z tlenu, wodoru i węgla. W mniejszych ilościach występują: sód, magnez, potas, siarka, chlor i wapń, a jedynie w śladowych: bor, fluor, krzem, jod, mangan, żelazo, kobalt.
Skład procentowy pierwiastków występujących w organizmach żywych został przedstawiony graficznie na diagramie 2.
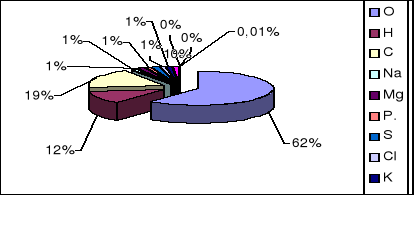
Diagram 2. Skład % pierwiastków występujących w organizmach żywych
W skład żywej komórki wchodzą: węgiel, wodór, tlen, azot, fosfor, siarka, są to tzw. pierwiastki organogenne. Inne pierwiastki, tj. żelazo, kobalt, mangan, sód, potas, magnez to pierwiastki biogenne.
Ze względu na rolę fizjologiczną pierwiastki chemiczne dzieli się na 4 grupy:
pierwiastki strukturotwórcze: C, H, O, N, P., S, Si, Ca
pierwiastki tworzące elektrolity: K, Na, Ca, Cl, Mg
pierwiastki biorące udział w procesach enzymatycznych: Cr, Mo, Mn, Fe, Co, Cu, Zn, B, Mg
pozostałe o nieznanej dotychczas aktywności
Literatura
Ciba J., TrojanowskaJ., Zolotajkin N., Mała encyklopedia pierwiastków, WNT, Warszawa 1996.
Chemia nieorganiczna, czI, pod red. Kolditza L., Wydawnictwo Naukowe PWN, Warszawa 1994.
Heiserman D. L., Księga pierwiastków chemicznych, Proszynski i s- ka. S.A., Warszawa 1997.
Huczko A., Fulereny, Wydawnictwo Naukowe PWN, Warszawa 2000.
Jak to jest?, Reader's Digest Przegląd sp. z o.o., Warszawa 1998.
Nellis W. J.(tłumaczenie Filipek St.), Świat nauki, nr 8 (108) sierpień 2000, Proszynski i s- ka. S.A., Warszawa 2000.
Pazdro K. M., Chemia dla licealistów. Chemia nieorganiczna, OE, Warszawa 1996.
Podstawy chemii, praca zbiorowa pod kierunkiem prof. dr hab.Tarasiewicza M., Wydawnictwo Uniwersytetu w Białymstoku, Białystok 1998.
30
Wyszukiwarka