Laboratorium z biofizyki
Ćwiczenie 7
Temat:
Wyznaczanie krytycznego stężenia tworzenia miceli niejonowego detergentu metodą fluorescencyjną
Data wykonania ćwiczenia: 23.04.2009 r.
Data oddania sprawozdania: ....................
1. Wstęp teoretyczny
Środki powierzchniowo czynne - związki, w cząsteczkach których występuje część hydrofilowa (wykazująca powinowactwo do wody) i hydrofobowa (nie wykazująca powinowactwa do wody). Związki te mają zatem charakter amfifilowy, związany z jednoczesną, niepełną rozpuszczalnością związku w dwóch różnych rozpuszczalnikach. Inne nazwy: detergenty, surfaktanty, tensydy.
Przykłady grup:
hydrofilowej: -COOH (karboksylowa), występująca w roztworze w postaci jonowej: -COO-, grupa hydroksylowa -OH (alkohole), grupa sulfonowa -SO3H (postać jonowa: -SO3-)
hydrofobowej: to przede wszystkim łańcuch węglowodorowy oznaczany zwykle jako -R (np. -C15H31)
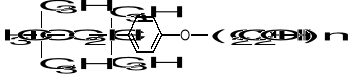
Przykładem związku posiadającego grupy hydrofilową i hydrofobową są: palmitynian sodu C15H31COONa i stearynian sodu C17H35COONa (sole będące składnikiem mydła). Niejonowe związki powierzchniowo czynne otrzymywane są np. poprzez polimeryzację tlenku etylenu (C2H4O), a następnie przyłączenie do powstałego związku alkoholu przez wiązanie eterowe, np. Triton-X 100:

(n - zwykle 9-10)
Środki powierzchniowo czynne można podzielić na grupy w zależności od ich zastosowania:
emulgatory - dodatki utrwalające emulsje
środki zwilżające
środki pianotwórcze - dodatki utrwalające pianę
detergenty - środki czyszczące
Związki powierzchniowo czynne obniżają napięcie powierzchniowe cieczy, dzięki czemu ułatwiają zwilżanie powierzchni ciał stałych przez te ciecze. Ponadto umożliwiają mieszanie dwóch niemieszających się ze sobą cieczy, np: wody i oleju, w wyniku czego zostaje wytworzony układ koloidowy - emulsja.
Wyróżnia się dwa główne typy emulsji: olej/woda (rys. A) i woda/olej (rys. B)
Micela - kulisty twór wytworzony ze związku niepolarnego i polarnego, stabilizowany obecnością zawiązku powierzchniowo czynnego, wielkość miceli jest porównywalna z typowymi rozmiarami cząstek koloidalnych.
W rozpuszczalnikach polarnych, polarny koniec każdej cząsteczki „poszukuje” polarnego środowiska, na skutek czego samorzutnie ustawia się na zewnątrz miceli. Drugi, niepolarny koniec „chowa” się we wnętrzu miceli, na skutek czego ma kontakt z niepolarnymi końcami innych cząsteczek i jest jednocześnie odseparowany od rozpuszczalnika. W rozpuszczalniku niepolarnym struktura miceli jest odwrotna - polarne końce cząsteczek znajdują się w jej wnętrzu, zaś niepolarne na zewnątrz.
Na granicy miceli i rozpuszczalnika zachodzi zjawisko solwatacji, co powoduje, że micela składa się z „kłębka” cząsteczek substancji rozpuszczonej i otoczki solwatacyjnej cząsteczek rozpuszczalnika na stałe związanych z micelą.
Krytyczne stężenie tworzenia miceli (CMC)
Warunkiem koniecznym utworzenia miceli przez surfaktant jest odpowiednio wysokie stężenie jego cząsteczek w fazie polarnej, gdyż dla niskich stężeń takie układy koloidalne się nie tworzą, a cząsteczki amfifilowe tworzą roztwór rzeczywisty. Dopiero osiągnięcie odpowiednio wysokiego stężenia surfaktantu powoduje samorzutne tworzenie fazy micelarnej. Stężenie związku amfifilowego, powyżej którego samorzutnie tworzą się micele nazywane jest krytycznym stężeniem tworzenia miceli (ang. Critical Micelle Concentration - CMC)). Wartość CMC zależna jest od wielu czynników, między innymi temperatury, rodzaju surfaktanta i fazy rozpraszającej, obecności jonów i innych cząsteczek organicznych.
Dla surfaktantów niejonowych wzrost temperatury powoduje wzrost CMC, natomiast mocne elektrolity w niewielkim stopniu obniżają CMC (następuje wysalanie hydrofobowych części cząsteczek ze środowiska wodnego). Alkohole i inne substancje organiczne posiadające zdolność wbudowywania się w micelę, silnie obniżają CMC już przy bardzo niskich stężeniach. Natomiast związki organiczne zmieniające pseudokrystaliczną strukturę wody znacząco wpływają na hydratację polarnych grup detergentu i możliwość jego asocjacji. Zatem związki niszczące strukturę wody (jak guanidyna czy mocznik) ułatwiają hydratację i wpływają na wzrost CMC, a związki utrwalające strukturę wody (jak ksyloza czy fruktoza) utrudniają hydratację i powodują obniżenie CMC. Dodatek słabo polarnych rozpuszczalników organicznych obniża stałą dielektryczną wody i także skutkuje wzrostem CMC.
W fazie micelarnej własności roztworu wyraźnie się zmieniają, co umożliwia wyznaczanie wartości CMC. Wykorzystuje się np. napięcie powierzchniowe, wielkości koligatywne, przewodnictwo, rozpraszanie światła. Prostą metodą jest pomiar fluorescencji związku, którego wydajność świecenia zależy silnie od polarności otoczenia. Do badania miceli niejonowych detergentów stosuje się np. kwas 1,8-anilinonaftalenosulfonowy (ANS), zwykle w postaci soli magnezowej.
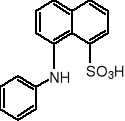
ANS
Wraz ze wzrostem stałej dielektrycznej, a więc i polarności otoczenia, wydajność fluorescencji tego związku maleje (w wodzie ANS praktycznie nie świeci). W roztworze detergentu (przy stężeniu większym od CMC), cząsteczki ANS znajdują się przede wszystkim w niepolarnym wnętrzu miceli i wydajność fluorescencji rośnie. Polarność otoczenia zmienia także położenie maksimum fluorescencji.
Istnieją dwie teorie tłumaczące powstawanie miceli przy określonym stężeniu. Pierwsza zakłada istnienie równowagi między cząsteczkami detergentu X a micelami:
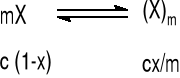
gdzie: c - stężenie detergentu
x - ułamek cząsteczek detergentu, jaki uległ micelizacji
m - liczba cząsteczek zasocjowanych w miceli
Opisuje to stała równowagi K:
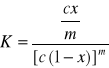
Z tego wzoru wynika, że dla dostatecznie dużego m - x pozostaje bardzo małe i niezmienne aż do przekroczenia pewnego stężenia, po czym rośnie gwałtownie. Asocjacja detergentów niejonowych wynika głównie z hydrofobowych oddziaływań łańcuchów surfaktanta we wnętrzu miceli i zmniejszenie wpływu grupy polarnej na strukturę wody po jej przejściu z roztworu do miceli. Również z tego powodu wszystkie czynniki zmieniające oddziaływanie polarnej części cząsteczki z wodą wpływają na zmianę wartości CMC.
Wg drugiej teorii powstawanie miceli to proste rozdzielanie się faz, przy czym zasocjowany detergent tworzy odrębną fazę, która powyżej CMC pozostaje w równowadze z roztworem, jeśli stężenie niezasocjowanego detergentu jest stałe.
2. Cel ćwiczenia
Ćwiczenie ma na celu zapoznanie się ze sposobem wyznaczania krytycznego stężenia tworzenia miceli (CMC) metodą fluorescencyjną na przykładzie niejonowego środka powierzchniowo czynnego Triton X-100 w wodzie, a także zbadanie wpływu różnych substancji na wartość CMC tego detergentu.
3. Tabele wyników
V Triton [ml] |
c Triton [mol/dm3] |
I fluor. [mV] woda |
I fluor. [mV] 1,5 M mocznik |
I fluor. [mV] 0,5 M KCl |
I fluor. [mV] 0,5 M glukoza |
0,5 |
0,00005 |
2,41 |
2,57 |
2,48 |
2,65 |
1 |
0,0001 |
2,43 |
2,49 |
2,68 |
2,52 |
1,5 |
0,00015 |
2,42 |
2,57 |
2,67 |
2,52 |
2 |
0,0002 |
2,46 |
2,43 |
3,26 |
2,75 |
2,5 |
0,00025 |
2,6 |
2,68 |
4,24 |
2,66 |
3 |
0,0003 |
2,59 |
2,62 |
6,14 |
2,78 |
3,5 |
0,00035 |
2,67 |
2,63 |
8,23 |
3,22 |
4 |
0,0004 |
3,06 |
2,72 |
10,28 |
3,88 |
4,5 |
0,00045 |
3,66 |
2,94 |
11,38 |
4,46 |
5 |
0,0005 |
4,16 |
3,12 |
13,86 |
5,26 |
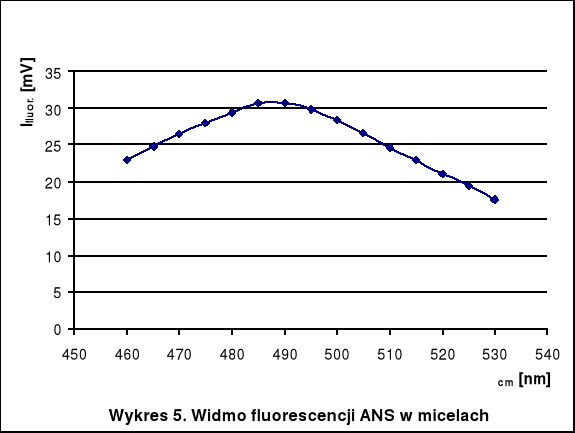
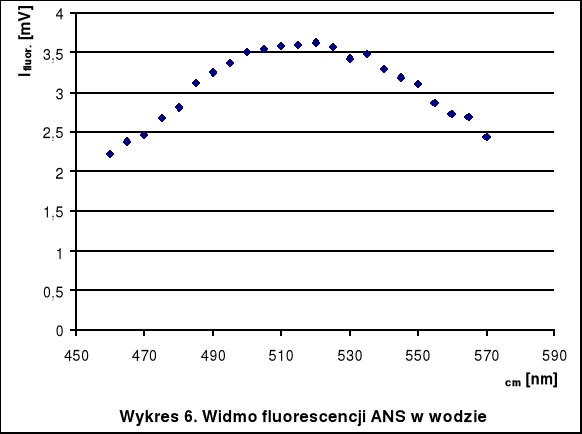
λ cm [nm] |
I fluor. [mV] 2*10-3M Triton |
Ifluor. [mV] woda |
460 |
22,87 |
2,22 |
465 |
24,72 |
2,37 |
470 |
26,46 |
2,45 |
475 |
27,9 |
2,67 |
480 |
29,42 |
2,81 |
485 |
30,74 |
3,12 |
490 |
30,71 |
3,25 |
495 |
29,79 |
3,37 |
500 |
28,43 |
3,51 |
505 |
26,67 |
3,54 |
510 |
24,7 |
3,59 |
515 |
22,91 |
3,6 |
520 |
21,03 |
3,63 |
525 |
19,42 |
3,57 |
530 |
17,56 |
3,42 |
535 |
|
3,47 |
540 |
|
3,29 |
545 |
|
3,18 |
550 |
|
3,1 |
555 |
|
2,86 |
560 |
|
2,72 |
565 |
|
2,68 |
570 |
|
2,43 |
4. Opracowanie wyników
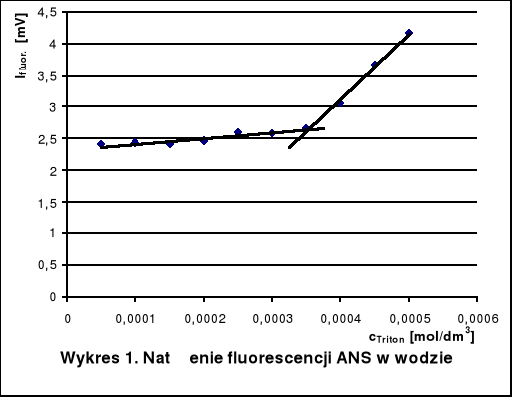
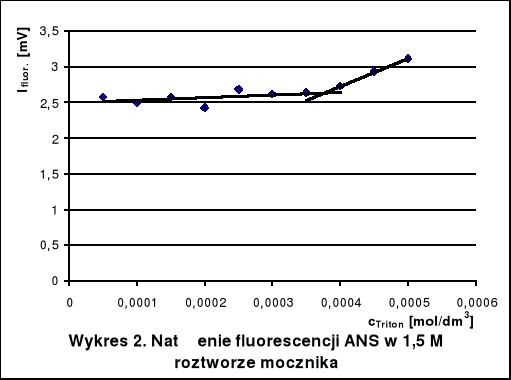
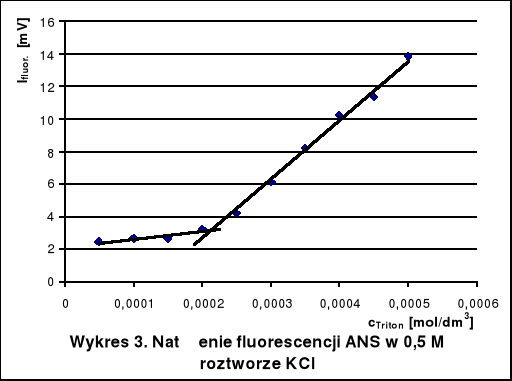
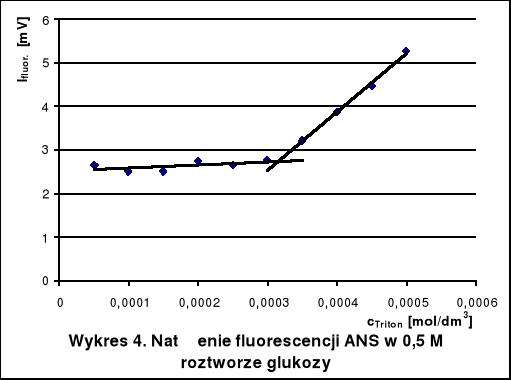
5. Wnioski
Krytyczne stężenia tworzenia miceli Tritonu X-100 w roztworach wodnych różnych substancji wyznaczone na podstawie wykresów wynoszą około:
w czystej wodzie - 3,5 · 10-4 mol/dm3
w 1,5 M roztworze mocznika - 3,75 · 10-4 mol/dm3
w 0,5 M roztworze KCl - 2,1 · 10-4 mol/dm3
w 0,5 M roztworze glukozy - 3,2 · 10-4 mol/dm3
Dodatek mocznika zwiększa CMC, gdyż niszczy on strukturę wody, ułatwiając hydratację cząsteczek Tritonu. Glukoza natomiast stabilizuje strukturę wody. Hydratacja jest wtedy utrudniona i micele powstają przy niższym stężeniu detergentu niż w czystej wodzie. W roztworze KCl również występuje spadek krytycznego stężenia tworzenia miceli. Mocne elektrolity, a takim jest KCl, powodują wysalanie hydrofobowych fragmentów cząsteczek z roztworu, co utrudnia ich agregację.
Największe natężenie świecenia ANS w wodzie obserwujemy przy długości fali 510-520 nm, natomiast w roztworze Tritonu - 485-490 nm. Widać więc, że dodatek detergentu zmienia położenie maksimum fluorescencji. Zwiększa się wtedy także wydajność świecenia (o 1 rząd wielkości).