18. ORGANICZNE POCHODNE KWASU WĘGLOWEGO
Kwas węglowy jest słabym kwasem nieorganicznym, istnieje tylko wodnych roztworach CO2, a nawet w takich warunkach równowaga jest przesunięta w kierunku wolnego bezwodnika kwasu węglowego.
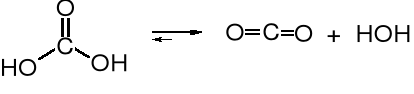
Niektóre nieorganiczne pochodne kwasu węglowego, jak np. fosgen czy mocznik służą do otrzymywania wielu organicznych pochodnych kwasu węglowego.
Fosgen powstaje pod wpływem światła z tlenku węgla i chloru; jego nazwa wywodzi się z roli światła w tej reakcji: generowany przez światło (gr. phos = światło, a łac. genere = powstawać).
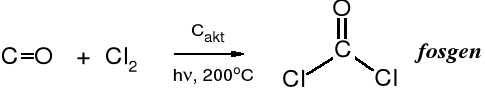
Fosgen jest gazem (tw. 8,3oC). Został on otrzymany po raz pierwszy przez J. Davy w 1812 r. Trochę ponad 100 lat później (w 1915 r.) Niemcy zastosowali fosgen jako gaz bojowy. W czasie I WŚ 80% ludzkich ofiar spowodowanych przez gazy trujące przypada na fosgen.
Fosgen jest zdradliwy w działaniu - trzeba o tym pamiętać pracując z nim jako odczynnikiem. Przy niewielkim stężeniu jest słabo wyczuwalny i przez kilka godzin po zatruciu trudno zaobserwować niepokojące objawy. W tym czasie jako bardzo reaktywny związek modyfikuje grupy funkcyjne białek (ciał czynnych), które przez to tracą swoją niezbędną do życia aktywność.
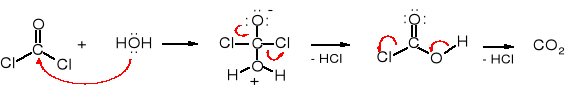
Fosgen należy do chlorków kwasowych i reaguje z wodą tak, jak inne tego typu związki. W wyniku hydrolizy fosgenu powstaje chlorowodór, który też jest bardzo szkodliwy dla organizmów żywych.
W wyniku amonolizy fosgenu tworzy się mocznik:
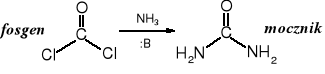
Fosgen pod wpływem aminy zostaje przekształcony w podstawiony amid, który jest już związkiem organicznym.
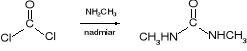
fosgen N,N'-dimetylomocznik
Mocznik odegrał znaczącą rolę w rozwoju chemii organicznej. Jego historyczna synteza z cyjanianu amonu (F. Wöhler, 1828 r.) obaliła teorię vis vitalis, wg której substancje wytwarzane przez organizmy żywe powstają jedynie przy współdziałaniu sił nadprzyrodzonych.
![]()
izocyjanian amonu mocznik
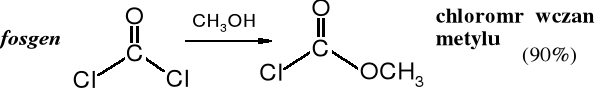
Fosgen ulega alkoholizie w wyniku, czego powstają estry kwasu węglowego. Alkoholizę można prowadzić etapowo otrzymując chlorki monoestrów, zwane chloromrówczanami.
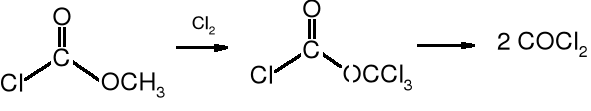
W wyniku chlorowania chloromrówczanu metylu powstaje difosgen, który rozkłada się do fosgenu.
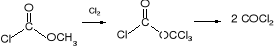
fosgen
chloromrówczan
metylu
difosgen (chloromrówczan trichlorometylu)
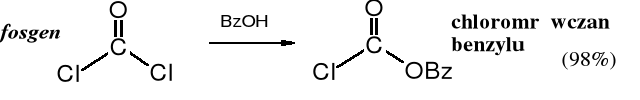
W reakcji fosgenu z alkoholem benzylowym powstaje chloromrówczan benzylu.
Chloromrówczany reagują z aminami, a produkty, które w tej reakcji powstają będące zarazem monoestryami jak i monoamidami kwasu węglowego nazywane są karbaminianami lub uretanami.
![]()
chloromrówczan metylu karbaminian metylu (uretan)
Chloromrówczan benzylu ma duże zastosowanie w chemii peptydów. Służy do czasowej osłony grupy aminowej aminokwasów w trakcie syntezy peptydów. Taka osłona zwana benzyloksykarbonylem umożliwia reakcje na grupie karboksylowej aminokwasu, w tym na wytworzenie wiązania amidowego (peptydowego), po czym może być usunięta w łagodnych warunkach.
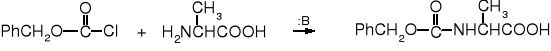
chloromrówczan benzylu alanina N-benzyloksykarbonyloalanina (Z-Ala lub Cbo-Ala)
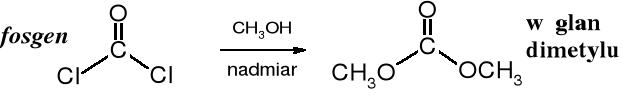
Fosgen z nadmiarem alkoholu tworzy węglany będące diestrami kwasu węglowego.
Węglany dialkilowe powstają też z chloromrówczanów w reakcji ze stechiometryczną ilością alkoholu, w obecności zasady.
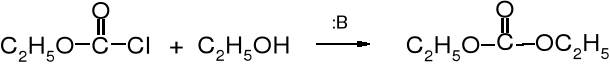
chloromrówczan etylu etanol węglan dietylu
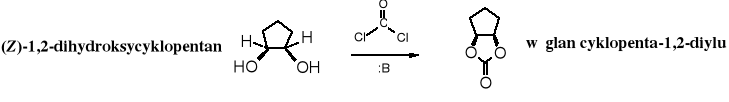
Fosgen służy do osłony wicinalnych glikoli w konformacji cis. Taki układ grup hydroksylowych występuje często w cukrach.
Węglany należą do estrów, w których nie ma atomu wodoru przy C, dlatego też są wykorzystywane, podobnie jak benzoesany i mrówczany jako akceptory w reakcjach kondensacji, np. w kondensacji Claisena.
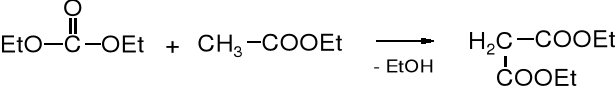
węglan dietylu octan etylu malonian dietylu
Powyższa reakcja nie jest stosowana do otrzymywania estrów malonowych, można jednak za jej pomocą syntezować bardziej skomplikowane związki.
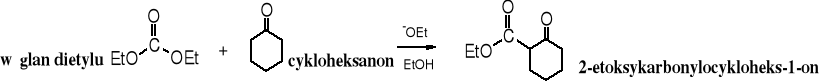
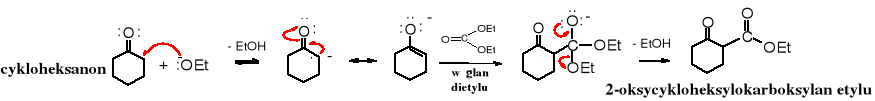
Mechanizm reakcji jest taki sam, jak typowej kondensacji Claisena.
Monochlorki monoamidów kwasu węglowego nazywane chlorkami karbamylowymi otrzymuje się z fosgenu w reakcji ze stechiometryczną ilością aminy, w obecności zasady wiążącej HCl.
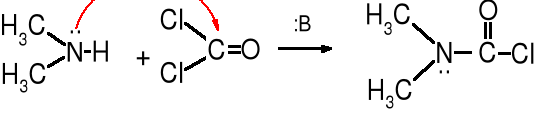
dimetyloamina fosgen chlorek dimetylokarbamylowy
Chlorki karbamylowe służą do otrzymywania izocyjanianów. Izocyjaniany są nie tylko produktami pośrednimi w reakcjach przegrupowaniach Hofmanna i Curtiusa, ale stanowią bardzo ważny surowiec przemysłowy do produkcji poliureatanów.
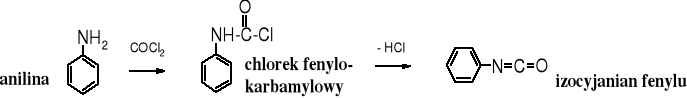
Izocyjaniany powstają z amidów pod wpływem bromu w środowisku zasadowym w reakcji zwanej przegrupowaniem Hofmanna.
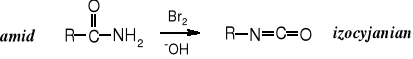
Izocyjaniany ulegają alkoholizie przechodząc w karbaminiany, czyli estry kwasu karbaminowego.
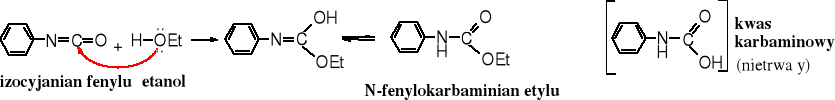
Izocyjaniany ulegają też amonolizie, przy czym powstają pochodne mocznika:
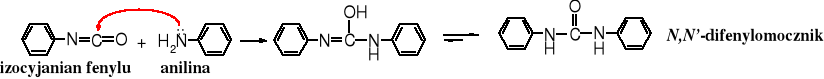
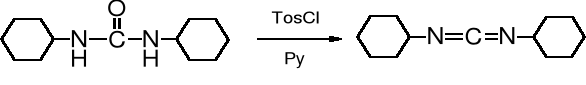
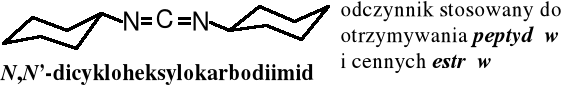
Dipodstawione moczniki służą do otrzymywania karbodiimidów, cennych odczynników kondensujących:
- HOH
N,N'-dialkilomocznik R−NH−CO−NH−R __→ R−N=C=N−R N,N'-dialkilokarbodiimid
Dehydratacja moczników zachodzi pod wpływem odczynników silnie odwaniających, np. P2O5 czy chlorku tosylu w pirydynie.
Najbardziej znanym karbodiimidem jest N,N'-dicykloheksylokarbodiimid (DCC), który powstaje w wyniku ogrzewania mocznika z cykloheksyloaminą i następczej dehydratacji dicykloheksylomocznika (DCM).
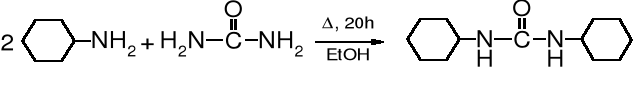
cykloheksyloamina mocznik N,N'-dicykloheksylomocznik, DCM (89%)
![]()
![]()
DCM N,N'-dicykloheksylokarbodiimid (DCC, 82%)
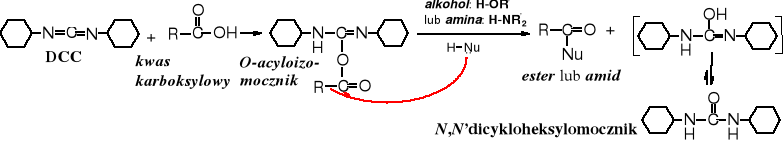
Rola DCC w reakcjach kondensacji (acylowania alkoholi lub amin) polega na uaktywnieniu grupy karboksylowej (tworzenie estrów aktywnych). Z kwasami tworzy on pochodne O-acyloizomocznika, które aktywnością acylującą dorównują bezwodnikom.
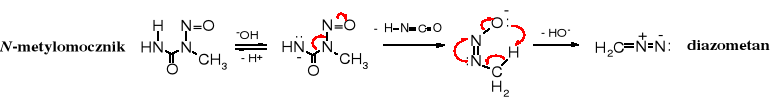
Pochodna mocznika - N-nitrozometylomocznik służy do otrzymywania diazometanu, cennego odczynnika metylującego. Substratem w tej syntezie jest acetamid.
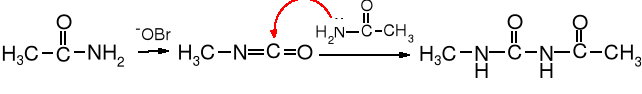
acetamid izocyjanian metylu N-acetylo-N'-metylomocznik (81%)
W kwaśnym środowisku acetylometymocznik łatwo ulega hydrolizie metylomocznika.
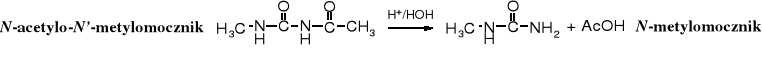
Metylomocznik powstaje również w reakcji mocznika z chlorkiem metyloamoniowym.
![]()
N-acetylo-N'-metylomocznik w kwaśnym środowisku, w obecności kwasu azotawego ulega hydrolizie do metylomocznika i równocześnie nitrozowaniu do N-metylo-N-nitrozomocznika. Traktowanie N-metylo-N-nitrozomocznika wodorotlenkiem potasu powoduje jego rozkład do diazometanu.
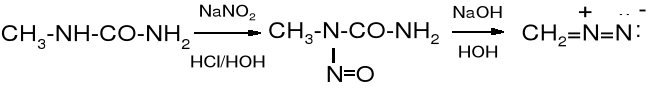
N-metylomocznik N-metylo-N-nitrozomocznik diazometan (70%)
Mechanizm rozkładu N-metylo-N-nitrozomocznika do diazometanu
Diazometan jest stabilizowany mezomerycznie:
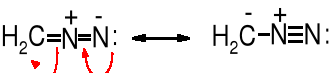
Różnice konstytucyjne związków azowych, diazowych i soli diazoniowych.
R−N=N−R związek azowy, np.:

azobenzen (dimetylodiazen) azometan (difenylodiazen)
R2C=N=N diazozwiązek, np.:
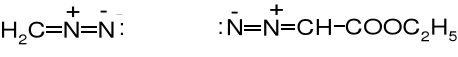
diazometan diazooctan etylu
[R-N≡N]+ X- sól diazoniowa, np. chlorek benzenodiazoniowy

Nitrozometylomocznik (NMM) nie jest bezpiecznym odczynnikiem. Zanotowano przypadki jego wybuchowego rozkładu. Zaleca się przygotowywać tę substancję bezpośrednio przed użyciem. NMM można przechowywać jedynie po zwilżeniu kwasem octowym i nigdy w słoikach zamykanych korkami szlifowymi. NMM zwilżony kwasem octowym nie nadaje się bezpośrednio do otrzymywania CH2N2. Przed rozkładem do diazometanu należy go wielokrotnie przemyć eterem w celu usunięcia AcOH. Taka procedura jest kłopotliwa.
Bezpieczniejszym, chociaż droższym substratem do otrzymywania diazometanu jest diazald, czyli N-metylo-N-nitrozo-p-toluenosulfamid. Jego mniejsza wydajność atomowa wynika z wysokiej masy cząsteczkowej tego związku, znacznie wyższej niż masa cząsteczkowa metylonitrozomocznika.
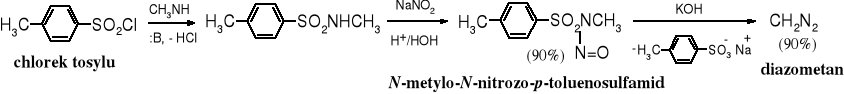
Mechanizm reakcji:
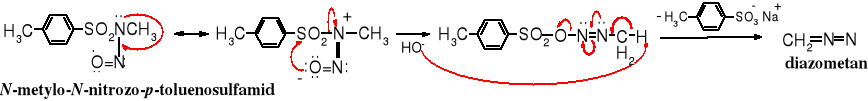
Diazometan jest bardzo aktywnym odczynnikiem metylującym, używa się go głównie do otrzymywania estrów metylowych, jest zdolny również do metylowania amin i uaktywnionych grup hydroksylowych, np. glikoli wicinalnych.
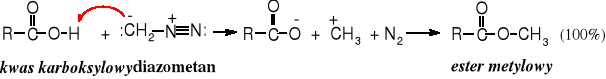
Diazometan jest bardzo toksycznym i wybuchowym gazem (tw. -24oC). W większości laboratoriów używanie go jest zabronione. Jeżeli zachodzi konieczność użycia diazometanu należy operować nim pod bardzo sprawnym wyciągiem.
Kwas barbiturowy i jego pochodne
Kwas barbiturowy powstaje w reakcji kondensacji estru malonowego z mocznikiem; jest organiczną pochodną kwasu węglowego.
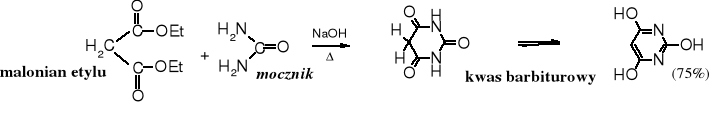
Kwas barbiturowy, zwany także 2,4,6-trihydroksypirymidyną lub cyklicznym ureidem kwasu malonowego jest kwasem pięciokrotnie mocniejszym od kwasu octowego.
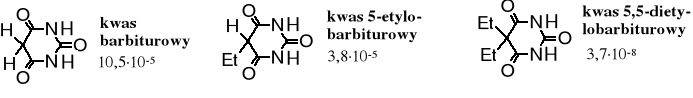
Problem: które atomy wodoru decydują o kwasowości tego związku?
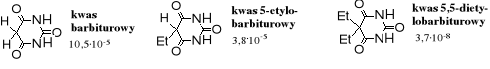
Wartości Ka:
Z porównania powyższych wartości wynika, że trzeci analog jest kwasem znacznie słabszym niż dwa pierwsze, co oznacza, że bardziej kwaśne są atomy wodoru przy atomie C niż N; kwas barbiturowy jest więc C-kwasem. Oczywiście możliwość tworzenia postaci enolowej wpływa na ruchliwość atomów H, a tym samym na kwasowość związku.
Kwas barbiturowy pod wpływem zasad ulega hydrolizie do kwasu malonowego, CO2 i NH3, co świadczy o jego niearomatycznym charakterze.
Praktyczne zastosowanie znalazły barbiturany, czyli pochodne kwasu barbiturowego. Niektóre z nich są środkami nasennymi, np. barbital i luminal, przeciwpadaczkowymi - benzobarbital czy uspakajającymi. Obecnie barbiturany nie należą do popularnych leków.

Kwas barbiturowy nie wykazuje właściwości nasennych.
Diamid kwasu imidodikarboksylowego nosi nazwę biuretu. Powstaje on w reakcji mocznika z kwasem cyjanowym.
HN=C=O + H2N−CO−NH2 _→ NH2−CO−NH−CO−NH2
kwas cyjanowy mocznik biuret
Biuret w środowisku zasadowym tworzy z siarczanem miedzi (II) kompleksy o ciemnoniebieskiej barwie. Podobną reakcję obserwuje się w wyniku oddziaływania CuSO4 z peptydami lub białkami (związkami zawierającymi kilka wiązań peptydowych). Jest to test, zwany reakcją biuretową, na obecność białek, peptydów lub biuretu.
Tiomocznik
Tiomocznik powstaje w reakcji cyjanamidu z siarkowodorem.
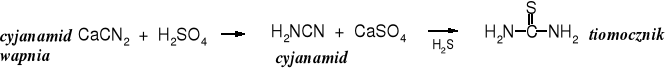
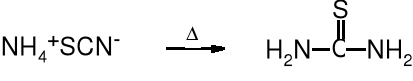
Można go też otrzymać w wyniku termicznej izomeryzacji rodanku amonu (cyjanamidu amonu).
Tiomocznik znajduje się w równowadze tautomerycznej z izotiomocznikiem:
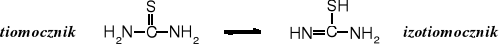
Alkilowanie tiomocznika daje pochodne S-alkilowe, które pod wpływem zasad ulegają rozkładowi do cyjamidu i tioli, jest to znana metoda otrzymywania tioli.
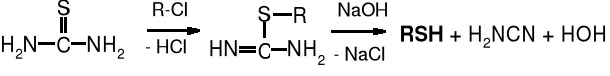
tiomocznik S-alkiloizotiomocznik tiol
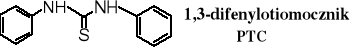
1,3-Difenylotiomocznik (fenylotiomocznik), PTC (ang. phenyltiocarbamid) jest stosowany jako marker jednogenowy do wykrywania genu odpowiedzialnego za gorzki smak tej substancji. W zależności od obecności tego genu ludzie mają różną wrażliwość na odczuwanie smaku roztworu PTC. Mogą odczuwać jego smak jako bardzo gorzki, gorzki lub bez smaku. PTC stosowany jest w badaniach populacyjno-genetycznych.
Inną cenną organiczną pochodną kwasu węglowgo jest pirowęglan di-tert-butylowy, reagent służący do wprowadzania grupy ochronnej Boc na funkcję aminową, np. w aminokwasach.
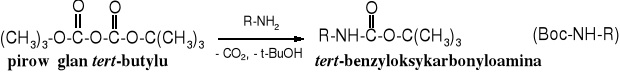
pirowęglan t-butylu (Boc)2O + Ala L-alanina _→ Boc-Ala t-butyloksykarbonylo-L-alanina
Organiczne pochodne kwasu tiowęglowego
Disiarczek węgla reaguje z alkoholanami tworząc alkiloksantogeniany, sole organicznych pochodnych kwasu ditiowęglowego.
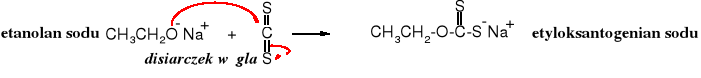
Ta reakcja służy do rozpuszczania celulozy w alkalicznych, wodnych roztworach.
Znane są też inne organiczne pochodne kwasu ditiowęglowego:
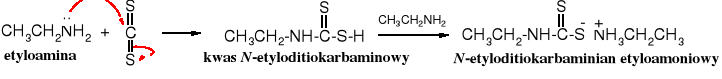
Rezonans
Jon karboksylany CO3- trudno zapisać tak, żeby wzór potwierdzał fakt wynikający ze wszystkich badań spektroskopowych, iż znajdujące się w tej cząsteczce trzy atomy tlenu są równocenne. Nawet intuicyjnie domyślamy się, że te atomy tlenu są identyczne. Natomiast trudno to przedstawić na rysunku. Najczęściej pomagamy sobie kilkoma wzorami, przy czym rzeczywista struktura jest czymś pośrednim; cząsteczka CO3- przypomina hybrydę tych wzorów, a nie jeden konkretny z nich.
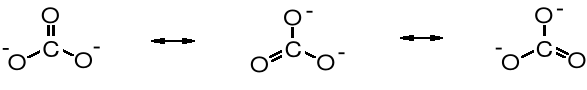
wzory graniczne jonu węglanowego
Strzałka z podwójnym grotem pomiędzy powyższymi wzorami oznacza, że są to struktury rezonansowe (mezomeryczne); różnią się one jedynie położeniem elektronów.
Podobne wzory rezonansowe można zapisać dla wielu innych związków, np. jonu azotanowego:
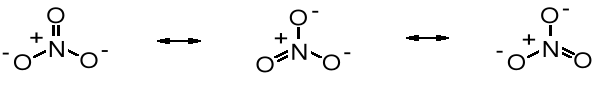
Zwykle związek, którego wzór można przedstawić za pomocą struktur rezonansowych jest stabilizowany rezonansowo, tzn. ma niższą energię potencjalną niż to wynikałoby ze struktury obrazowanej wzorem pojedynczym.
Teoria rezonansu (mezomerii)
Zjawisko rezonansu jest obserwowane w przypadku takich związków chemicznych, których konstytucję (budowę) można przedstawić za pomocą dwóch lub większej liczby wzorów cząsteczkowych, różniących się jedynie położeniem elektronów, ale nie rozmieszczeniem jąder atomowych.
Rzeczywista cząsteczka stanowi hybrydę wszystkich struktur rezonansowych, a to oznacza, że żaden pojedynczy wzór nie reprezentuje cząsteczkę rzeczywistą w sposób zadawalający.
Hybryda rezonansowa jest trwalsza od każdej z możliwych struktur rezonansowych. Energia stabilizująca związek związana ze zjawiskiem rezonansu nazywana jest energią rezonansu lub energią mezomerii.
Im bardziej poszczególne struktury rezonansowe są energetycznie zbliżone do siebie, tym większa jest energia rezonansu. Jest szczególnie wysoka, kiedy poszczególne struktury rezonansowe są jednakowe (mają taką samą energię).
Stopień udziału pojedynczej struktury w hybrydzie zależy od jej względnej trwałości w porównaniu z pozostałymi strukturami. Im trwalsza struktura, tym większy jej udział w hybrydzie.
Przykłady struktur stabilizowanych mezomerycznie:
Rodnik, kation i anion allilowy tworzą się łatwiej i są trwalsze niż odpowiednie analogi alkilowe, np. propylowe, ponieważ te pierwsze są stabilizowane mezomerycznie.
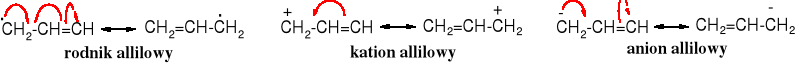
Jeszcze silniejszy efekt mezomeryczny występuje w rodnikach, kationach czy anionach trifenylometylowych; poniżej kilka z wielu jego możliwych struktur mezomerycznych.
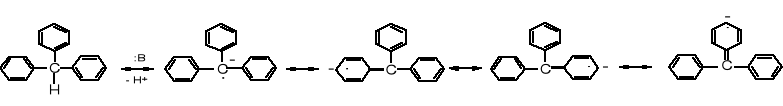
Do struktur stabilizowanych mezomerycznie należą areny, w tym fenol i fenolany.
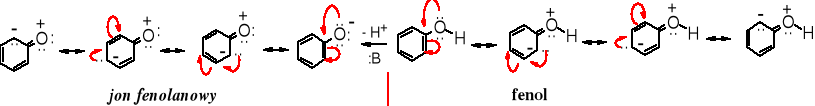
Zarówno grupa hydroksylowa w fenolach jak i -O- w fenolanach wzbogacają pierścień aromatyczny w elektrony, a tym samym aktywują go na reakcje SE; z tego względu fenolany są reaktywniejsze w reakcjach substytucji aromatycznej niż niepodstawione areny.
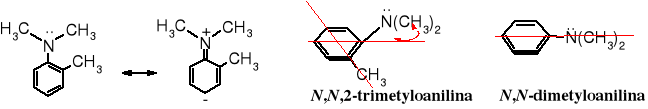
Mezomeria wpływa na właściwości wielu związków, np. na zasadowość amin aromatycznych:

Grupa metylowa w położeniu orto w N,N,2-trimetyloanilinie utrudnia sprzężenie atomu azotu z pierścieniem aromatycznym (odchyla grupę dimetyloaminową z płaszczyzny pierścienia), przez co zasadowość tego związku wzrasta kilka razy w porównaniu z zasadowością N,N-dimetyloaniliny - nie dochodzi do sprzężenia wolnej pary elektronów atomu N z pierścieniem aromatycznym.
Azulen, węglowodór zbudowany z dwóch skondensowanych pierścieni - pięcio- i siedmioczłonowego jest związkiem aromatycznym dzięki temu, że w obu pierścieniach dochodzi do jonizacji, część cyklopentadienowa staje się anionem, a część cykloheptatrienowa kationem, przez co zostaje spełniona reguła Hückla.
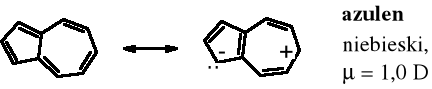
Jego bardziej znany izomer - naftalen jest bezbarwny, a moment dipolowy naftalenu = 0.
Błękit metylenowy służy do barwienia wełny zaprawionej taniną. Stosowany jest także jako tzw. barwnik witalny do zabarwiania niektórych żywych tkanek, np. nerwów obwodowych, ponieważ absorbują go one silniej niż inne tkanki. Bakteriolodzy barwią nim też preparaty drobnoustrojowe, gdyż część z nich po wybarwieniu, w tym gonokoki i prątki cholery oraz gruźlicy są dobrze widoczne pod mikroskopem. W ten sposób w 1882 r. R. Koch odkrył prątki gruźlicy.
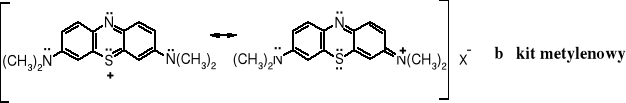
Tautomeria
Tautomeria jest to zjawisko polegające na przemieszczeniu się protonu w obrębie tej samej cząsteczki, w wyniku czego tworzy się tautomer (izomer), który zwykle jest w stanie równowagi ze strukturą wyjściową. Tautomerii towarzyszy mezomeria, czyli zmiana położenia elektronów. Najbardziej znana jest równowaga tautomeryczna ketonowo-enolowa.
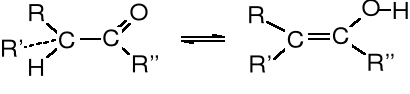
forma ketonowa forma enolowa
Przemieszczanie protonu i elektronów katalizowane jest kwasami lub zasadami, a przejściowo tworzy się jon enolanowy.
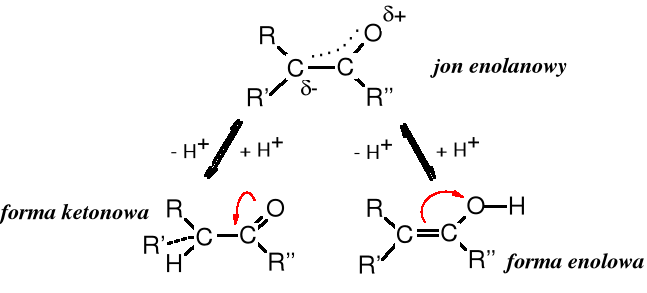
równowaga tautomeryczna keto-enolowa
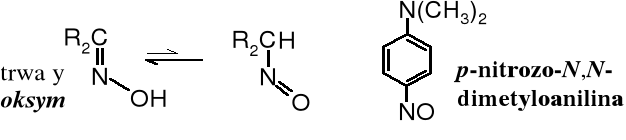
Do równowagi tautomerycznej dochodzi w wielu innych związkach, np. znane są równowagi oksymowo-nitrozowe, związków nitrowych czy tlenków fosfin:

oksym nitrozozwiązek tlenek fosfiny kwas fosfinawy
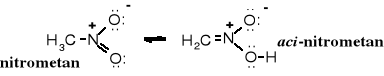
Nitrozwiązki w formie aci są stosunkowo silnymi kwasami, rozpuszczają szybko w zasadach. Nitrozwiązki też rozpuszczają się w zasadach, ale ten proces trwa długo, ponieważ najpierw muszą one ulec przemianie tautomerycznej do formy aci.
Do znanych tautomerów należą oksymy będące w równowadze tautomerycznej z nitrozozwiązkami. Najczęściej mamy do czynienia z oksymami, ponieważ nitrozozwiązki są trwałe jedynie wówczas, kiedy w położeniu do grupy -NO nie ma atomu wodoru .
Pośród enamin, tautomerów imin (obie grupy związków należą do azotowych pochodnych aldehydów i ketonów) trwałe są jedynie te, które powstają w reakcji aldehydów lub ketonów z 2o aminami.
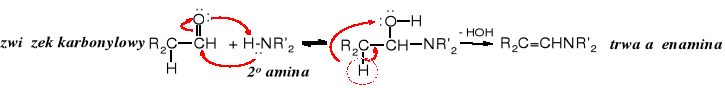
W produktach reakcji z aminami 1o mogą tworzyć się zarówno iminy, jak i enaminy, równowaga przesunięta jest jednak w kierunku imin.
![]()
Zadanie: napisz mechanizm reakcji związku karbonylowego z aminą 1o.
Tautomery są izomerami konstytucyjnymi, różnią się położeniem atomu wodoru w cząsteczce. Zaś struktury rezonansowe nie przedstawiają związku chemicznego, jedynie wzory graniczne różniące się rozkładem elektronów.
Tautomerię zaznaczamy dwiema równoległymi strzałkami o przeciwnie skierowanych grotach, zaś mezomerię strzałką o dwóch grotach:
![]()
tautomeria mezomeria (rezonans)

tautomeria
wzory tautomerów laktonu kwasu
2-alkilo-4-hydroksy-3-oksybutanowego
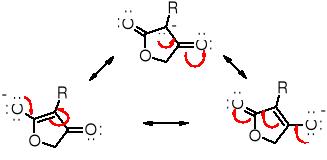
struktury rezonansowe
anionu uczestniczącego w tautomerii powyższego związku
1
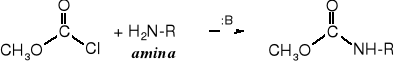
Wyszukiwarka