Biotechnologia - integracja nauk przyrodniczych i inżynieryjnych w celu zastosowania organizmów, komórek i ich części oraz molekularnych analogów do pozyskania dóbr i usług. Rozwój biotechnologii obserwuje się głównie w trzech dziedzinach:
-rolnictwie i przetwórstwie rolno spożywczym,
-ochronie środowiska
-farmacji i medycynie.
Biotechnologia tradycyjna - użycie enzymów, drobnoustrojów i komórek organizmów wyższych, bez obcego materiału genetycznego.
Biotechnologia nowoczesna - użycie szczepów drobnoustrojów, linii komórkowych skonstruowanych metodami inżynieryjnymi.
Procesy biotechnologiczne:
Biosynteza:
-drobnoustroje - biosynteza aminokwasów, antybiotyków, polisacharydów, produkcja preparatów paszowych,
-komórki zwierzęce - otrzymywanie szczepionek wirusowych, przeciwciał monoklonalnych,
-komórki roślinne - biosynteza szikoniny, kwasu rozmarynowego,
-enzymy - biosynteza dekstranu, glutationu, tryptofanu.
Biotransformacja:
-drobnoustroje - biotransformacja steroidów, otrzymywanie kwasu octowego, L-sorbozy, kwasu glukozowego,
-enzymy - konwersja glukozy do fruktozy, kwasu fumarowego do jabłkowego, oraz do L-asparaginowego.
Biohydroliza:
-enzymy - hydroliza rafinoza, laktozy, skrobi, dekstranu, ścinanie mleka, otrzymywanie kwasu 6-aminopenicylanowego.
Fermentacja:
-drobnoustroje - produkcja etanolu, mleczanowi (beztlenowe) oraz produkcja kwasu cytrynowego, octowego (tlenowe).
Bioługowanie:
-drobnoustroje - procesy ługowania minerałów, głównie uranu i miedzi.
Biodegradacja:
-drobnoustroje - oczyszczanie ścieków, produkcja biogazu z odpadów, produkcja biomasy paszowej.
Okres rzemieślniczy (do połowy XIX w.) - era spontanicznych procesów fermentacyjnych wykorzystywanych do otrzymywania produktów żywnościowych.
Kalendarium:
-3000 p.n.e. - produkcja chleba z zakwasu oraz wyrobów alkoholowych przez fermentację owoców,
-2000 p.n.e. - produkcja wina gronowego (Asyria),
-300 p.n.e. - produkcja piwa (Sumeria, Babilon, Egipt),
-XIV w. - produkcja octu (Francja) - na wiórach bukowych (prapoczątek unieruchomiania komórek).
Techniki stosowane w procesach technologicznych:
-zbiorniki drewniane,
-procesy okresowe, brak aparatury kontrolnej,
-naturalne kultury mikroorganizmów.
Robert Hooke (1635-1703) - opisał komórki (dębu korkowego).
Antonie van Leeuwenhoek (1632-1723) - skonstruował mikroskop (x270) i obserwował erytrocyty, bakterie oraz plemniki.
Okres uprzemysławiania (do lat 40. XX w.). - poznawanie w sposób naukowy biologicznej i chemicznej natury bioprocesów, zapoczątkowane przez L. Pasteura. Rozwój nowych koncepcji, biotechnologii i bioproduktów, np. produkcja kwasu mlekowego, cytrynowego, acetonu i butanolu, preparatów enzymatycznych, otrzymywanie drożdży. Zapoczątkowano stosowanie czystych kultur drobnoustrojów oraz prowadzenie bioprocesów w warunkach aseptycznych.
Kalendarium:
-1857 - opis fermentacji mlekowej (Pasteur),
-1879 - odkrycie Acetobacter (Hansen),
-1880 - zastosowanie czystych kultur drożdży w piwowarstwie,
-1881 - mikrobiologiczna produkcja kwasu mlekowego,
-1881 - szczepionka przeciwko wściekliźnie (Pasteur),
-1892 - szczepionka przeciwko cholerze (Haffkine),
-1894 - biologiczna oczyszczalnia ścieków - złoże zraszane (Wlk. Brytania),
-1913 - wytwarzanie acetonu i butanolu (Wlk. Brytania),
-1913 - biologiczna oczyszczalnia ścieków metodą osadu czynnego (Wlk. Brytania)
-1915 - produkcja drożdży piekarnianych,
-1916 - fermentacja acetonowo-butanolowa (C. Weizmann),
-1915 - wytwarzanie glicerolu,
-1920 - produkcja kwasu cytrynowego metodą powierzchniową,
-1921 - szczepionka przeciwko gruźlicy (Calmette, Guerin),
-1923 - otrzymanie anatoksyny błonniczej (Ramon),
-1931 - szczepionka przeciwko dżumie (Girard, Robiauet).
Techniki stosowane w procesach technologicznych:
-zbiorniki stalowe, napowietrzanie i mieszanie mechaniczne,
-procesy okresowe oraz ciągłe, prosta aparatura kontrolna,
-czyste kultury mikroorganizmów.
Edward Jenner (1749-1823) - wprowadził prewencyjne szczepienie przeciwko ospie.
Appert Nicolas François (1750-1841) - wprowadził technikę konserwacji żywności w zamkniętych hermetycznie naczyniach, polegająca na długotrwałym gotowaniu (apertyzacja). Wprowadził uzyskiwanie żelatyny z kości.
Jonh Tyndall (1820-1893) - wykazał istnienie przetrwalników i zaproponował metodę kilkukrotnego wyjaławiania (tyndalizacja).
Ludwik Pasteur (1822-1895) - wykazał, że drożdże wywołują fermentację (udoskonalił techniki winiarskie), dowiódł, że mikroorganizmy są czynnikiem etiologii wielu chorób zakaźnych, stworzył podstawy immunologii (szczepionki z atenuowanych szczepów cholery, wąglika i wścieklizny) oraz opracował metodę częściowego wyjaławiania w temp. 50-60°C (pasteryzacja).
Okres przemysłowy (od roku 1945) - opracowanie przemysłowej produkcji penicyliny metodą tlenowej hodowli wgłębnej prowadzonej w warunkach aseptycznych w bioreaktorach o pojemności kilkudziesięciu m3.
-Podokres 1 (do roku 1970) - integracja dyscyplin biologicznych, chemicznych, inżynieryjnych i opracowanie nowych technologii, np. biosyntezy antybiotyków, aminokwasów i biotransformacji steroidów oraz zastosowanie unieruchomionych biokatalizatory.
-Podokres 2 (od roku 1970) - praktyczne wykorzystanie genetyki i biologii molekularnej w biotechnologii. Nastąpił rozwój metod rekombinacji DNA in vitro i in vivo. Opracowano szereg nowych biotechnologii, np. mikrobiologiczną produkcję insuliny, hormonów wzrostu, interferonów, białek odpornościowych, oraz technologię wytwarzania przeciwciał monoklonalnych.
Kalendarium:
-1929 - odkrycie penicyliny (Fleming),
-1937 - odkrycie transformacji mikrobiologicznych (Marmolie, Vercellone),
-1944 - odkrycie streptomycyny (Schatz, Waksman),
-1941 - przemysłowa produkcja penicyliny,
-1948 - odkrycie chlorotetracykliny (Duggar),
-1949 - produkcja kwasu octowego w hodowli wgłębnej,
-1949 - mikrobiologiczna produkcja witaminy B12,
-1953 - mikrobiologiczna produkcja dekstranu (Gronwall, Ingelman),
-1955 - produkcja kwasu cytrynowego w hodowli wgłębnej.
Techniki stosowane w procesach technologicznych:
-bioreaktory ciśnieniowe, wieżowe, strumieniowe, mieszanie mechaniczne i napowietrzanie dużych zbiorników,
-procesy półokresowe i ciągłe, komputeryzacja sterowania bioreaktorami,
-techniki selekcjonowanie szczepów (mutacje) oraz unieruchomiania enzymów i komórek.
Johann Friedrich Miescher - odkrycie DNA (1869).
Francis Crick, James Watson,Rosalind Franklin - opis struktury DNA (1953).
Paul Berg - opis rekombinacji DNA (1970)
Okres naukowy
Na tym etapie, główną siła napędową rozwoju biotechnologii są badania naukowe, ukierunkowane przede wszystkim na modyfikację materiału biologicznego. Mają one decydujące znaczenie przy rozwoju nowych metod wytwarzania i produktów. Za najważniejsze dla tego etapu należy uznać prace JD. Watsona oraz F.H.C. Cricka. którzy w 1953 r. rozszyfrowali strukturę kwasu dezoksyrybonukleinowego DNA — podstawowego nośnika kodu genetycznego. Otrzymali za to nagrodę Nobla w 1962 r. Zrozumienie mechanizmu replikacji materiału biologicznego umożliwiło aktywne kształtowanie własności drobnoustrojów. Początki prawdziwej inżynierii genetycznej to doświadczenie Paula Berga z uniwersytetu standfordzkiego z 1970 r. z manipulowaniem DNA (nagroda Nobla w 1980 r.).
Techniki stosowane w procesach technologicznych:
- zastosowanie technik inżynierii genetycznej do otrzymywania szczepów produkcyjnych.
- biologiczne wytwarzanie składników „obcych" dla danego mikroorganizmu, np.
insulina, interferon, czyli sztuczne kreowanie przemian biologicznych.
Następuje oczywiście dalszy rozwój konstrukcji aparatury i technik produkcyjnych. Ma to szczególne znaczenie w nowych działach biotechnologii w wytwarzaniu metodami biotechnologicznymi nowych produktów, zwłaszcza o
dużym znaczeniu dla medycyny.
Zastosowanie i perspektywy metod inżynierii genetycznej:
Stosowane:
-taksonomia i klasyfikacja bakterii,
-badanie żywności, pasz i środowiska,
-produkcja probiotyków, hormonów, białek aktywnych biologicznie i enzymów (w tym paszowych),
-rozpoznawanie chorób wirusowych, bakteryjnych i pasożytniczych,
-produkcja leków, antybiotyków i szczepionek.
Nie stosowane:
-przygotowanie szczepów bakterii i grzybów, zmieniających mikroflorę endogenną przewodu pokarmowego żwacza i jelit świń.
Potencjalne zagrożenia stosowania metod inżynierii genetycznej:
Przeniesienie patogenów (np. wirusów stosowanych, jako wektory).
Wystąpienie substancji alergennych oraz nadprodukcja toksyn.
Podwyższona przeżywalność oraz rozmnażalność.
Zakłócenie równowagi ekologicznej oraz bioróżnorodności
Powstanie nowych gatunków (kontrola laboratoryjna GMO umożliwia wyeliminowanie takich sytuacji).
Krzyżowanie z istniejącymi gatunkami (takie zagrożenie jest możliwe z każdą nową odmianą).
Horyzontalny transfer genu na inne organizmy.
„Kanibalizm” (konsumpcja ludzkich genów przeniesionych do innych układów, np. roślin).
Zakres zastosowań współczesnych biotechnologii: (perspektywy zastosowań inżynierii genetycznej)
Produkcja żywności:
-tradycyjne procesy fermentacyjne - produkcja pieczywa, produktów mlecznych i roślinnych, drożdży, napojów alkoholowych,
-nowe technologie mikrobiologiczne - produkcja białka jednokomórkowców (SCP), aminokwasów, witamin, nukleotydów, kwasów organicznych i polisacharydów,
-utrwalanie żywności - produkcja oksydaza glukozowej (antyutleniacz) oraz nizyny (konserwant),
-produkcja pasz - preparaty białkowe, witaminowe, aminokwasowe, antybiotyczne, stymulatory wzrostu, kiszonki roślinne,
-ochrona roślin - antybiotyki, bioinsektecydy, biopestycydy,
-lecznictwo zwierząt - antybiotyki, szczepionki.
Ochrona zdrowia:
-produkcja szczepionek i przeciwciał (testy immunologiczne),
-biosynteza antybiotyków, aminokwasów, kwasów organicznych, witamin, enzymów, inhibitorów enzymów, dekstranu, alkaloidów,
-biosynteza hormonów peptydowych, antygenów, leków steroidowych, witaminy C, glukonianu wapnia, efedryny.
Przemysł chemiczny:
-wytwarzanie surowców - alkohole, kwasy organiczne, polimery (dekstran, ksantan, pululan, kwas poli-β-hydroksymasłowy),
-produkcja nośników energii (biopaliwa) - etanol, metan, potencjalnie wodór,
-obróbka surowców naturalnych - hydroliza skrobi w trakcie wytwarzania tkanin, wytrawianie skór, fermentacja tytoniu,
-biohydrometalurgia - ługowanie rud, biozatężanie, odzyskiwanie metali,
-bioelektronika - bioczipy.
Ochrona środowiska:
-oczyszczanie ścieków - złoża zraszane, filtry biologiczne, osad czynny,
-bioutylizacja odpadów - namnażanie biomasy, procesy biosyntezy mikrobiologicznej, produkcja biogazu.
Analiza:
-zastosowanie enzymów rozpuszczalnych, np. oksydazy glukozowej (z katalazą lub peroksydazą) lub dehydrogenazy
glukozo-6-fosforanowej (z heksokinazą),
-czujniki enzymowe i komórkowe - oksydaza glukozowa + elektroda tlenowa, ureaza + elektroda pH,
-analiza genomów - analiza restrykcyjna, sekwencjonowanie, sondy molekularne.
Charakterystyka technologii biotechnologicznej:
- W procesach biotechnologicznych wykorzystywane są surowce odnawiane. Głównymi surowcami wykorzystywanymi w technologiach biochemicznych są węglowodany: skrobia i sacharoza oraz uboczne produkty przemysłu rolno-spożywczego. np. serwatka, melasa. Coraz większym zainteresowaniem cieszy się wykorzystanie surowców celulozowych.
- Mikroorganizmy i enzymy przejawiają nieosiągalną w klasycznych procesach chemicznych wydajność i selektywność.
- Hodowle przeprowadzane są w bardzo umiarkowanych warunkach. Temperatury zbliżone są do temperatury otoczenia. Nie stosuje się wysokich ciśnień.
- Procesy biochemiczne są energooszczędne.
Biotechnologia a mikrobiologia inżynieria:
Inżynieria cytogenetyczna- czyli inżynieria na poziomie komórkowym. Równolegle do rozwoju technik rekombinowania DNA in vitro, rozwijana jest technika fuzji komórek pozwalająca na rekombinację genetyczną in vivo w takim zakresie i z taką częstością, jakie w naturze są niemożliwe. Jej praktyczne wykorzystanie w biotechnologii przyniosło wiele wymiernych efektów.
Fuzja protoplastów stosowana jest, jako metoda doskonalenia właściwości biosyntetycznych szczepów i linii komórkowych.
Fuzja nowotworowych komórek szpiczaka z immunizowanymi komórkami produkującymi przeciwciała pozwala na otrzymanie linii komórek mieszańców
Problemy biobezpieczeństwa w biotechnologii:
Potencjalne zagrożenia wynikające z rozwoju biotechnologii są przedmiotem wielu obaw. Zagrożenia te są natury:
-molekularnej i wynikają
ze złożoności materiału biologicznego,
z możliwości wzbudzenia mutacji niekontrolowanych przez zabiegi inżynierii genetycznej,
z niejednoznaczności informacji genetycznej;
- zdrowotnej i wiążą się z możliwością wystąpienia
alergenów,
toksyn.
Szczep przemysłowy - posiada znaczenie biotechnologiczne.
Muzealny (kolekcje szczepów).
Środowiskowy.
Kompozyt (muzealny i środowiskowy.
Źródła pozyskiwania drobnoustrojów:
Istnieją 2 źródła pozyskiwania mikroorganizmów:
- szczepy muzealne- czyste kultury
W Polsce istnieje wiele kolekcji czystych kultur, o różnym zakresie i wielkości.
-szczepy autochtoniczne- ze środowiska naturalnego; szczepy ze środowiska naturalnego są lepsze, ponieważ szczepy muzealne po pewnym czasie mogą traci właściwości. Bakterie uzyskiwane ze środowiska są najbardziej aktywne.
Kryteria wyboru mikroorganizmu dla danego procesu technologicznego:
Odżywianie - najlepiej substancje odpadowe (metanol, melasa, serwatka, ług posiarczynowy).
Temperatura - najlepiej 30-40˚C (wyższa temperatura stwarza problem chłodzenia, ale zmniejsza ryzyko zakażenie).
Adaptacja - zdolność mikroorganizmu do wzrostu w aparaturze przemysłowej.
Stabilność cech drobnoustrojów i odporność na manipulacje genetyczne.
Produkcyjność - zdolność przetwarzania substratu w produkt z wysoką wydajnością, liczona w jednostce czasu.
Łatwość wydzielenia produktu.
Brak toksycznych produktów metabolizmu (z wyjątkiem produkcji surowic i szczepionek).
Selekcja szczepów:
Bakterie propionowe - wykorzystanie alternatywnego źródła węgla (mleczanu sodu zamiast glukozy), w celu eliminacji innych mikroorganizmów kwasu mlekowego, mogących zakłócić wzrost żądanych bakterii.
Bakterie kwasu octowego - wykorzystanie etanolu, jako źródło węgla (do 4%), inne bakterie źle znoszą jego obecność w podłożu.
Promieniowce - dodatek antybiotyków (penicylina) lub wapnia (wzrost pH) powoduje zahamowanie wzrostu grzybów, także wprowadzenie do warstwy gleby ornej wabików (np. pałeczki parafinowe - Streptomyces; włosy - Pilimelia).
Bakterie przetrwalnikujące - podwyższenie temperatury próbki (powyżej 100°C).
Bakterie beztlenowe:
-metoda fizyczna - hodowla w anaerostacie - usunięcie powietrza pompą próżniową (może być wprowadzony gaz obojętny),
-metoda chemiczna - zastosowanie substancji redukujących tlen (pirogalol, zasada potasowa, siarczek sodu),
-metoda biologiczne (Fortnera) - hodowla tlenowców (B. subtilis) z beztlenowcami (C. sporogenes).
Doskonalenie szczepów przemysłowych:
Szczepy mikroorganizmów pochodzenia naturalnego zwykle wytwarzają produkty o znaczeniu przemysłowym w niewielkich ilościach. Opracowano więc wiele procedur mających na celu zwiększenie produkcyjności tych organizmów. Najważniejsze z nich to:
Optymalizacja składu podłoża.
Optymalizacja warunków hodowli.
Mutageneza - związana z dwustopniową procedurą (wywołanie mutacji oraz selekcja i ocena mutantów):
-fizyczna (promieniowanie UV, λ = 254-265 nm,15 W, 20 cm, 2-3 min.),
-chemiczna (etylenoimina, kwas azotawy, dimetylonitrozoamina).
Uaktywnienie szczepów poliofilacji, zamrażanie:
Dla każdej metody przechowywania mikroorganizmów istnieje stosowna technika ożywiania komórek. Duże znaczenie ma skład podłoża użytego do uaktywnienia szczepu. Dobiera się takie, które umożliwiają pełne ujawnienie cech technologicznych szczepu.
Mutacje (w obrębie danej komórki) - pojedyncze zmiany materiału genetycznego.
Tranzycja - zamiana zasad azotowych, (puryn lub pirymidyn) - adeniny na guaninę, a cytozyny na tyminę.
Transwersja - zamiana zasady purynowej na pirymidynową lub odwrotnie.
Delecja - utrata jednej lub kilku par nukleotydów (przesunięcia ramki odczytu).
Insercja - wstawienie jednego lub kilku nukleotydów (przesunięcia ramki odczytu).
Mutacje punktowe mogą być odwracalne na drodze:
-supresji - przywraca wyjściowy fenotyp na skutek mutacji w innym miejscu niż pierwotna mutacja,
-rewersji - przywraca wyjściowy fenotyp i genotyp na skutek mutacji w tym samym miejscu.
Czynniki mutagenne:
Deaminujące - usunięcie grupy aminowej z zasady (kwas azotawy, dwusiarczan sodowy):
-adenina w hypoksantynę (tworzy parę z cytozyną)
-cytozyna w uracyl (tworzy parę z adeniną).
Promieniowanie niejonizujące (UV):
-dimeryzacja zasad pirymidynowych (dimery tyminy połączone wiązaniem kowalencyjnym),
-rozerwanie podwójne nici helisy DNA,
-hydratacja cytozyny i uracylu.
Techniki wywołania mutacji:
-promieniowanie ultrafioletowe, promieniowanie X, gamma.
-mutageny fizyczne: kwas azotawy, związki alkalizujące,
np. N-metylo-N'-nitro-N-nitrozoguanidyna (MNNG - rys. 3.2)
Najbardziej jest rozpowszechnione stosowanie promieniowania ultrafioletowego
o długości fali 254-265 nm (daleki ultrafiolet). Jest to z jednej strony najbardziej zabójcze promieniowanie i jednocześnie najbardziej mutagenne.
Zalety tej metody to:
-dostępność i łatwość użycia,
-łatwość dozowania dawek,
-powtarzalność warunków mutagenizacji,
-wysoka częstotliwość powstawania mutacji,
-możliwość uzyskania wszystkich typów mutantów,
-wywoływanie mutacji zarówno w komórkach wegetatywnych, jak również w komórkach spoczynkowych, np. w sporach.
Selekcja mutantów - zespół technik, które mają zapewnić szybką i efektywną ocenę efektów mutagenezy i wyodrębnienie ewentualnych komórek o pożądanych cechach:
Wskaźniki chemiczne:
-wskaźniki pH - oznaczanie kwasów lub zasad,
-wskaźnik z jodyną - oznaczanie skrobi i ocena aktywności amylolitycznych,
-wskaźnik czerwień kongo - oznaczanie celulozy i ocena aktywności celulolitycznych,
-podłoże żelatynowe - ocena aktywności proteolitycznych.
Wskaźniki mikrobiologiczne:
-metoda tworzenia replik za pomocą welwetowego stempla - kolonie wyrosłe na replikach są stosowane do testowania, zaś wyjściowa płytka służy do izolacji wybranych kolonii,
-metoda krążków agarowych - wycięte jałowo krążki podłoża inkubuje się i przenosi na płytki z drobnoustrojem testowym. Wokół kolonii drobnoustrojów produkujących antybiotyki nie będą rozwijały się drobnoustroje testowe. Wokół kolonii produkującej aminokwasy będą się rozwijały organizmy testowe wymagające danego aminokwasu.
Adaptacja mikroorganizmów:
Modyfikacja organizmu, tak, aby kluczowy enzym kontrolujący drogę asymilacji był wydzielany poza komórkę:
-regulacja przepuszczalności błony komórkowej poprzez kontrolę stężenia biotyny (produkcja aminokwasów)
Modyfikacja organizmu, tak, aby nie wytwarzał końcowego produktu kontrolującego drogę asymilacji.
Modyfikacja organizmu, tak, aby nie rozpoznawał obecności inhibitora lub represor:
-w wyniku selekcji można znaleźć mutanty odporne na analog danego metabolitu, w efekcie dając nadprodukcję danego metabolitu
Kontrola enzymów katabolicznych:
-indukcja - enzym jest wytwarzany jedynie w obecności induktorem (zwykle substratu):
*mutanty konstytutywne produkują enzym bez obecności induktora, z zastosowaniem hodowli ciągłej z niskim stężeniem induktora,
-sprzężenie zwrotne - synteza enzymu jest represjonowana przez produkt powstający w wyniku działania enzymu,
*mutanty odporne na represor, np. Bacillus produkuje proteazy, które normalnie są represjonowane przez aminokwasy,
-represja kataboliczna - synteza enzymu jest represjonowana, gdy organizm rośnie zbyt szybko na łatwo utylizowanym substracie:
*mutanty zdolne do utylizacji substratu oraz represora katabolicznego, z zastosowanie hodowli ciągłej.
Przechowywanie szczepów:
Pasażowanie - wielokrotne przenoszenie bakterii z jednej pożywki na następną (prosta i tania, ale utrata cech biotechnologicznych).
Liofilizacja - sublimacja w stanie zamrożenia (-40/-50°C), tudzież faza stała przechodzi bezpośrednio w fazę gazową (usunięcie 70% wody), w warunkach normalnych lub pod zwiększonym ciśnieniem oraz z substancjami higroskopijnymi (chlorek wapnia):
*aktywizacja - uwodnienie (woda, mleko lub bulion), posiew (podłoże stałe, umożliwiające pełne ujawnienie cech przemysłowych),
-mikroorganizmy przetrwalnikujące - komórki z l-2-tygodniowej hodowli,
-mikroorganizmy nieprzetrwalnikujące - komórki z fazy stacjonarnej wzrostu,
-zalecane są podłoża minimalne (do namnażania przed przechowywaniem).
Zamrażanie:
-mikroorganizmy na skosach agarowych - w -20°C lub -5°C, do 6 miesięcy,
-spory grzybów strzępkowych w zawiesinie wodnej - ok. 5°C,
-przetrzymywanie w ciekłym azocie - w -196°C, do kilku miesięcy,
*aktywizacja - uwodnienie (szybkie przejście z -45°C do -5°C w łaźni wodnej), posiew (podłoże stałe lub płynne).
Metody przechowywania szczepów:
Najpowszechniejszymi metodami jest metoda przechowywania w formie bezwodnej oraz przechowywania w obniżonej temperaturze:
-Metoda przechowywania w formie bezwodnej stosuje się dla drobnoustrojów zarodnikujących i przetrwalnikujacych - najbardziej korzystnymi formami do przechowywania są spory z l-2-tygodniowej hodowli, oraz dla drobnoustrojów niewytwarzających spór.
- Przechowywanie mikroorganizmów w obniżonej temperaturze stanowi powszechnie stosowaną technikę. Okres przechowywania i zakres zastosowania zależy od temperatury przechowywania, podłoża i formy fizjologicznej drobnoustroju. Szczepy mikroorganizmów na skosach agarowych przechowuje się w temperaturze -20°C lub -5°C, do 6 miesięcy. Efektywnym, ale bardzo drogim sposobem przechowywania jest utrzymywanie próbek w mieszaninach wymrażających lub ciekłym azocie (w temperaturze -I96°C). Komórki przed zamrożeniem umieszczane są w specjalnym roztworze krioochronnym, może nim być 10% roztwór glicerolu. Okres przechowywania w ciekłym azocie wynosi do kilku miesięcy.
Klasyfikacja technik hodowlanych. (Hodowla na podłożach płynnych):
Procesy okresowe - są prowadzone w systemach zamkniętych. Mikroorganizmy wzrastają zgodnie z fazami wzrostu (adaptacji, przysposobienia, wykładnicza, hamowania, stacjonarna, liza komórek). Stężenie substratów równomiernie spada. W czasie wzrostu lub po jego zakończeniu powstaje określony produkt, który jest izolowany z całości hodowli, z komórek lub z przesączu pohodowlanego. Następnie aparatura jest przygotowywana do kolejnego cyklu produkcyjnego (produkcja biomasy):
+ łatwość utrzymywania warunków jałowych,
+ prostota prowadzenia procesu,
+ odnawialność inokulum zapobiegająca degeneracji szczepu (stabilność cech),
+ łatwo zauważalna infekcja,
+ izolacja danego metabolitu w danej fazie wzrostu (pierwotnego w fazie wykładniczego wzrostu, wtórnego w fazie stacjonarnej),
- mała wydajność,
- brak możliwości regulacji stężenia substratów.
Procesy pólokresowe - polegają na wprowadzaniu do hodowli pod koniec fazy wzrostu wykładniczego lub po jej zakończeniu, świeżej pożywki (zmienna objętość) oraz okresowe odbieranie części hodowli i izolacja produktu (produkcja drożdży piekarniczych, antybiotyków, aminokwasów, alkoholu):
+ duża elastyczność i optymalizacja procesu,
+ możliwość kontrolowania stężenia substratu,
+ możliwość automatyzacji procesu,
- konieczność jałowego dozowania pożywki,
- niebezpieczeństwo degeneracji szczepu w hodowlach wielokrotnych.
Procesy ciągłe - polegają na tym, że po wstępnym okresie namnażania mikroorganizmów rozpoczyna się stałe zasilanie hodowli strumieniem świeżego podłoża, połączone z jej ciągłym odbiorem, przy zachowaniu stałej objętości (produkcja białka paszowego, fermentacja alkoholowa, mleczanowi, octowa, oczyszczanie ścieków):
+ możliwość regulacji stanu fizjologicznego komórek przez dobór szybkości zasilania i składu podłoża,
+ możliwość automatyzacji procesu,
+ większa szybkość i wydajność wielu procesów (uzyskiwanie większych stężeń),
- degeneracja szczepów lub pojawienie się niekorzystnych mutacji,
- trudności w utrzymaniu warunków aseptycznych procesu w bioreaktorze przez dłuższy czas,
- rozwój mikroorganizmów, tworzących układy wielokomórkowe w postaci kłaczków i kuleczek.
Podział bioreaktorów ze względu na sposób prowadzenia procesu:
Bioreaktory do hodowli wgłębnej.
Bioreaktory do hodowli w podłożu stałym:
-komory powierzchniowe (5-6 cm pożywki),
-komory wgłębne (50-100 cm), w tym bębnowe (1 obrót/1 min), np. namnażanie grzybów, biokompostowanie.
Bioreaktory z unieruchomionym materiałem biologicznym:
-fermentory z obrotowymi dyskami (mikroorganizmy rosną na dyskach, częściowe zanurzanie i wynurzanie),
-fermentory membranowe, półprzepuszczalne (oddzielenia produktu od substratu lub komórek zwierzęcych od roślinnych).
Biotransformacja - jedno-, rzadziej dwuetapowe, chemiczne przekształcenie egzogennych związków w strukturalnie im podobne, dokonywane przez żywą komórkę. Produkty końcowe często nie mają znaczenia dla komórki, a niekiedy są wręcz toksyczne:
-biotransformacja nie jest celem działania komórki = to proces niezależny od funkcji jej życiowych.
Specyficzność:
-reakcyjna - enzym powoduje konkretną przemianę chemiczną,
-substratowa - enzym działa na konkretny substrat,
-stereochemiczna - enzym wytwarza produkty o konkretnej strukturze
Biotransformacje cukrów:
-hydroliza skrobi do maltozy (B. polymyxa),
-hydroliza sacharozy do glukozy i fruktozy (A. niger),
-hydroliza laktozy do glukozy i galaktozy (Kluyveromyces fragilis),
-izomeryzacja glukozy do fruktozy (B. coagulans).
Biotransformacje alkoholów:
-utlenianie etanolu do octanu (Acetobacter schuzenbachii, A. curvum)
-utlenianie D-sorbitolu do L-sorbozy w produkcji witaminy C (Gluconobacter suboxydans),
-utlenianie glicerolu do dihydroksyacetonu (Gluconobacter melanogenes).
Biotransformacje aminokwasów:
-kondensacja amoniaku z kwasem fumarowym, powstaje kwas L-asparaginowy (E. coli),
-kondensacja amoniaku z kwasem cynamonowym, powstaje L-fenyloalanina (Rhodotorula glutinis).
Biotransformacje antybiotyków:
-hydroliza penicyliny G do kwasu 6-aminopenicylanowego (B. megaterium, Proteus rettgeri),
-hydroliza penicyliny V do kwasu 6-aminopenicylanowego (Bovista plumbea),
-hydroliza cefalosporyny C do kwasu 7-aminocefalosporynowego (Pseudomonas putida).
Biotransformacje sterydów:
-hydroksylacja progesteronu w hydroksyprogesteron (Rhizopus nigricans),
-dehydrogenacja kortyzolu w prednizolon (B. lentus).
Techniki biotransformacji:
Biotransformacje przez rosnące komórki - substrat mający podlegać transformacji dodawany jest w eksperymentalnie określonym momencie fazy wzrostu. Metoda jest bardzo prosta, często używana w badaniach i selekcji szczepów. Niska wydajność.
Biotransformacja przez komórki w fazie stacjonarnej - namnożone komórki odwirowywane są z medium wzrostowego i rozpraszane w medium transformacyjnym, do którego dodawany jest substrat. Zaletami jest niezależność wzrostu i transformacji, brak efektów hamujących substratu lub produktu, możliwość regulacji stężenia biomasy, łatwiejsze oczyszczanie produktu biotransformacji.
Biotransformacja przez spory - zastosowanie spór, jako biokatalizatorów w transformacjach chemicznych ma wiele zalet, ze względu na ich stabilność, łatwość przechowywania i transportu. Dają one wysoką wydajność biotransformacji przy nieznacznym wytwarzaniu produktów ubocznych. Medium stosowane w tej technice jest proste (woda lub częściej roztwór buforowy), pienienie się roztworu jest nieznaczne, zaś wydzielenie produktów zwykle efektywne.
Biotransformacje przez unieruchomiony materiał biologiczny - unieruchamiać na lub w stałym nośniku można: komórki drobnoustrojów, komórki roślinne i zwierzęce, spory oraz enzymy. Najczęściej używaną techniką jest zamykanie komórek w żelach alginianowych, poliakryloamidowych. Umożliwia prowadzenie ciągłych procesów biotransformacji, np. penicyliny G.
Hodowla z unieruchomionym materiałem biologicznym:
Hodowle tego typu stosowane były w XVII wieku do produkcji octu. Lokalizowano bakterie Acetobacter i oblewano je etanolem.
Metody unieruchamiania tzn. immobilizacji komórek, enzymów na powierzchni różnych nośników.
Unieruchamianie stosuje się w procesach biotransformacyjnych.
Wymagania: metody te muszą byś bezpieczne, proces musi być prosty ale tez efektywny by zapewnić wysoka aktywność materiału biologicznego.
Hodowle na podłożu stałym:
Podstawowymi zaletami hodowli w podłożach stałych są:
-prostota aparatury,
-możliwość uzyskiwania wyższych stężeń produktów,
-uzyskiwanie wysokich wydajności wytwarzania metabolitów dzięki wzrostowi grzybów w warunkach zbliżonych do naturalnych,
-wykorzystywanie surowców odpadowych.
Metody unieruchamiania materiałów biologicznych:
Znanych jest wiele technik unieruchomiania komórek.
Wszystkie one muszą spełniać kilka podstawowych wymagań:
- Muszą być bezpieczne.
- Muszą być proste.
- Muszą zapewniać długotrwałe użytkowanie.
- Muszą zapewniać wysoką aktywność materiału biologicznego.
- Muszą być tanie
Techniki unieruchamiania komórek i enzymów można podzielić na:
-Metody sorpcyjne polegają na związaniu komórek lub enzymów na powierzchni materiału stałego. Należą one do najprostszych technik unieruchomiania. Stosuje się różnorodne, tanie materiały, jak np. szkło porowate, węgiel drzewny, wióry drewniane, tlenek glinu, sylikażel, pochodne celulozy. Wadą metod sorpcyjnych jest możliwość desorpcji materiału biologicznego z powierzchni nośnika.
- Metody zamykania w siatce polimeru są równie popularne jak metody sorpcyjne. Polegają one na unieruchomianiu komórek lub enzymów wewnątrz naturalnych lub syntetycznych żeli. Najczęściej stosuje się alginiany, karaganiany, agar i żel poliakrylamidowy. Stosowanie naturalnych polisacharydów ma wiele zalet. Są to materiały tanie i bezpieczne.
-Metody agregacji mniejsze cząsteczki enzymów łączą się ze sobą w większe agregaty, dzięki czemu mają możliwość działania na większe cząsteczki.
Procesy z unieruchomionym materiałem biologicznym:
Bioreaktory z unieruchomionym materiałem biologicznym stosowane są w trzech głównych grupach procesów technologicznych:
- Biokonwersja. Reaktory do prowadzenia biokonwersji wykorzystują unieruchomione enzymy, unieruchomione nieaktywne komórki lub komórki aktywne, lecz nierosnące. Zwykle w reaktorach tych nie występuje napowietrzanie, nie jest też wydzielany dwutlenek węgla.
- Wytwarzanie metabolitów niezwiązanych ze wzrostem. Procesy te czasami wymagają doprowadzenia tlenu, wydzielany jest dwutlenek węgla. Unieruchomianie są aktywne komórki bądź w fazie stacjonarnej, bądź rosnące na powierzchni lub wewnątrz nośnika.
- Wytwarzanie metabolitów pierwotnych. Komórki muszą być tak unieruchomione, aby możliwy był normalny metabolizm substratu. Często wymagane jest dobre napowietrzanie.
Rozbijanie ścian komórek - jest stosowane, gdy metabolit nie został wydzielony na zewnątrz.
Metody mechaniczne:
-w fazie ciekłej: ultradźwięki, ciśnienie, mieszanie,
-w fazie stałej: rozcieranie.
Metody niemechaniczne:
-odwadnianie: powietrzem, próżniowe, rozpuszczalnikami,
-liza: fizyczna, chemiczna, enzymatyczna, biologiczna.
Dezintegracja komórek na skale laboratoryjną:
-dezintegratory wysokoobrotowe - wytworzenie dużych naprężeń ścinających w roztworze,
-dezintegratory ultradźwiękowe - wytworzenie fal kawitacji, czyli powstawania wewnętrznych pęcherzy powietrzna w komórce,
-metody enzymatyczne - stosowanie enzymów proteolitycznch,
-zamrażanie i rozmrażanie zawiesiny komórek - powstawanie kryształów lodu,
-operacje termiczne i suszenie,
-szok osmotyczny - przetrzymywanie w roztworach hipotonicznych,
-metody chemiczne - stosowanie ługów, kwasów, detergentów, antybiotyków lub rozpuszczalników organicznych,
-metody biologiczne - zastosowanie fagów.
Dezintegracja komórek na skale przemysłową:
-metoda ciśnieniowa - zastosowanie wysokiego ciśnienia (60-100 MPa), ochłodzenie (do 4˚C) i sprężenie mieszaniny,
-mielenie w młynach kulowych - poziome bębny wypełnione kulkami szklanymi o średnicy 0,3-0,4 mm.
Oddzielnie ciał stałych i cieczy.
Filtracja:
-plackowa - zatrzymywanie cząstek stałych na placku filtracyjny (izolacja drożdży, grzybów),
-objętościowa - zatrzymywanie cząstek stałych na przegrodzie filtracyjnej, w metodzie tej chodzi o czystość filtratu (przesączu), a nie o wydzielenie osadu (izolacja etanolu),
-dynamiczna - szybkoobrotowe mieszadło lub obracający się filtr nie dopuszcza do powstawania placka, następuje zatężanie a nie osadzanie się zawiesin,
Sedymentacja - opadanie osadu prowadzone w odstojnikach, konieczna jest wstępna obróbka, w celu powstania aglomeratów.
Flokulacja - wytrącanie osadu w wyniku neutralizacji ładunków na powierzchni komórek, powodowana dodatkiem odpowiednich elektrolitów, np. sole nieorganiczne, hydrokoloidy.
*Flotacja - otaczanie zanieczyszczeń pęcherzykami powietrza i wypychanie ich na powierzchnię.
Wirowanie - zastosowanie siły odśrodkowej:
-sedymentacyjne (do zagęszczania biomasy),
-filtracyjne (do wydzielania osadu).
Zagęszczanie roztworów:
Odparowanie - sposób oddzielenia cieczy od substancji stałej, stosowane, gdy trzeba odzyskać rozpuszczalnik, wadą jest pienienie.
Ekstrakcja - mieszanie z rozpuszczalnikiem słabo rozpuszczalnym dla cieczy, ale dobrze rozpuszczalnym z żądanym składnikiem,
np. ekstrakcja penicyliny octanem butylu z płynu pofermentacyjnego (pH 2,5-3), następnie re-ekstrakcja do fazy wodnej (o pH 5-7,5).
Permeacja - przenikanie substancji przez ciekłe membrany (emulsyjna lub unieruchomiona):
-adsorpcja cząsteczek na zewnętrznej stronie membrany,
-rozpuszczanie powierzchniowe zaadsorbowanych cząsteczek i ich dyfuzja poprzez materiał membrany,
-desorpcja lub odparowanie cząsteczek z drugiej strony membrany do medium odbierającego (roztwór pochłaniający).
Filtracja membranowa - siła napędową jest różnica ciśnień hydrostatycznych po obu stronach membrany, przez którą przepływa rozpuszczalnik z roztworu bardziej stężonego do rozcieńczonego, stosowane do zagęszczania krwi, żelatyny, skrobi i enzymów:
-mikrofiltracja (>0,6 µm) - klarowanie wstępne, oczyszczanie i usuwanie bakterii,
-ultrafiltracja (0,1-001 µm) - usuwanie makromolekuł, bakterii i wirusów,
-nanofiltracja (0,01-001 µm) - usuwanie jonów jednowartościowych oraz mały cząsteczek organicznych,
-odwrócona osmoza (<0,001µm) - odsalanie wody i otrzymanie wody o wysokiej czystości.
Elektrodializa - siłą napędową jest różnica potencjału elektrycznego po obu stronach membrany, przez która transportowane są jony z roztworu o stężeniu mniejszym do roztworu o stężeniu większym
Precypitacja - wydzielania białek i cukrów, usuwanie zanieczyszczeń przy użyciu wysalania (siarczanu amonu), rozpuszczalnika (etanol, aceton), flokulacji, temperatury lub zminy pH.
Oczyszczania produktów:
Chromatografia jonowymienna - wykorzystuje różnice w ładunkach elektrycznych, stosuje się wymieniacze jonowe:
-anionity np. dietyloaminoetylocelulozie (DEAE-celuloza),
-kationity np. karboksymetylocelulozie (CM-celuloza).
Chromatografia powinowactwa - wykorzystuje wiązanie się substancji do specyficznych grup chemicznych:
-wiązanie białek, poprzez pierścienie imidazolowe (histydyna) z jonami metali (złoże Ni2+-NTA, kwas nitrylotrioctowy).
Tworzenie produktu:
Krystalizacja - wydzielanie z roztworu przez chłodzenie i odparowanie związków o małej masie (aminokwasy, antybiotyki).
Suszenie (do 10% wody) - uzyskiwanie stabilnej formy bioproduktu (łatwy transport i przechowywanie):
-suszenie próżniowe - biopreparat jest suszony w obniżonym ciśnieniu, w temperaturze pokojowej
-suszenie rozpyłowe - rozpylony biopreparat jest suszony w strumieniu gorącej pary (150˚C)
-liofilizacja.
Metody oczyszczania substancji biologicznych:
W praktyce, oczyszczenie preparatu od precypitantu polega na odsoleniu roztworu. Stosuje się głównie
techniki membranowe.
- Diafiltracja polega na zastosowaniu układu ultrafiltracyjnego z cyrkulacją roztworu oczyszczanego i sorfym uzupełnianiu tego roztworu czystą wodą. Siłą napędową procesu jest ftónica ciśnień.
- Dializa polega na wykorzystaniu przegród półprzepuszczalnych i przebiega pod wpływem różnicy stężeń między roztworem oczyszczanym a czystym rozpuszczalnikiem. Zanieczyszczenia drobnocząsteczkowe, np. sole, przenikają przez błonę do czystej wody.
-Elektrodializa polega na wykorzystaniu ruchu jonów w polu elektrycznym i przegród przepuszczalnych dla cząsteczek o określonym ładunku.
Biomasa:
Biomasa - jest to substancja organiczna, która znajduje się w komórkach roślin, zwierząt i bakterii, używana jako źródło białka.
Fermentację biomasy, w wyniku której otrzymuje się metanol, etanol i inne, które to związki mogą być następnie przetworzone na inne formy energii bądź służyć jako paliwo.
Zalety przemysłowej produkcji białek w porównaniu z metodami tradycyjnymi.
Szybki przyrost biomasy (czas podwojenie masy):
-bakterie (1-7 h), glony (6-50 h), trawy (1-2 tygodnie), świnia (4-6 tygodni).
Wyższa zawartość białek (w suchej masie):
-mikroorganizmy: bakterie (75%), drożdże (50%), grzyby (30-50%),
-rośliny: mikroalgi (50-60%), ryż (10%), kukurydza (10%),
-mięso: wołowina (80-90%).
Szerszy wachlarz utylizowanych surowców (często odpadowych):
-metan, metanol, etanol (tańsze od melasy, do produkcji formaldehydu),
-cukry proste: pentozy (cukier drzewny, ług posiarczynowy), heksozy (cukier trzcinowy, buraczany, syrop celulozowy, skrobia),
-dwucukry (melasa, sok trzcinowy, buraczany, serwatka),
-parafiny (ropa - regres po latach 60, ze względu na koszta),
-wielocukry (zboża, ziemniaki, maniok, drewno, stoma, wytłoki trzciny cukrowej).
Wysoka wydajność i najmowanie małej przestrzeni przez instalacje produkcyjne.
Niezależność od zmian pogody, klimatu oraz sezonowości.
Możliwość wzbogacania pożywienia w aminokwasy egzogenne (walina, leucyna, izoleucyna, fenyloalanina, tyrozyna, tryptofan, lizyna, metionina i treonina), które występują często w niedomiarze w produktach roślinnych.
Łatwe wydzielanie biomasy (bakterie - wirowanie, drożdże i grzyby - wirowanie, filtracja).
Substytut wobec mączki mięsno-kostnej (priony).
Metody usuwania kwasów nukleinowych z biomasy mikroorganizmów:
-zawartość kwasów nukleinowych w SCB - 8-25 g/100 g białek,
-dzienna dawka kwasów nukleinowych dla człowieka - 2 g.
Hydroliza alkaliczna - powoduje straty wartości odżywczych.
Ekstrakcja - umożliwia usunięcie RNA, powoduje straty masy i azotu, konieczne jest usuwanie resztek rozpuszczalnika.
Hydroliza enzymatyczna - kosztowna (drogie nukleazy), można wykorzystać enzymy endogenne:
-dezintegracja komórek,
-inkubacja (15-20 min.) w obecności NaCl w celu aktywacji enzymów (dodatek 0,1% soli powoduje redukcję RNA o 75%),
-precypitacja białek - schłodzenia zawiesiny do temperatury poniżej 30°C lub przez zmianę pH poniżej 5 w wyniku dodania HCl,
-uzyskany precypitat białkowy jest filtrowany, przemywany i suszony.
Surowce do produkcji biomasy:
C-1 metan gaz naturalny, węgiel kamienny, gazyfikacja drewna, proce
-sy dygestii
C-1 metanol gaz syntezowy (CO2 + H)
C-2 etanol ,kwas octowy etylen, fermentacja etanolowa
C-5 pentozy cukier drzewny, ług posiarczynowy
C-6 heksozy cukier trzcinowy, cukier buraczany, syrop glukozowy ,
Skrobia
C-2 dwusacharydy melasy, sok trzcinowy, sok buraczanym serwatka
C-10…C-23 parafiny ropa (gas-oil)
Polisacharydy:skrobia,celuloza zboża, ziemniaki, maniok, drewno, stoma,wytłoki trzciny
cukrowej
Produkty uzyskane z melasy:
1. etanol - 2. drożdże Saccharomyces cerevisiae
1. drożdże piekarskie - 2. drożdze Saccharomyces cerevisiae
1. drożdze paszowe - 2. drożdze Saccharomyces cerevisiae, Candida utilis
1. witamina B3 - 2. bakterie Bacillus sphericus
1. kwas cytrynowy - 2. pleśnie Aspergillus Niger
1. aceton - 2. bakterie Clostridurn acetobutylicum
1. dekstran - 2. bakterie Leuconostoc mesenteroides ssp. Dextranicum
Hodowle drożdzy na :
Melasa - produkt uboczny w przemyśle cukierniczym, zawiera sacharozę, rafinozę, aminokwasy (S. cerevisiae).
Ług posiarczynowy - produkt uboczny w przemyśle celulozowym, powstaje podczas usuwania ligniny oraz hemicelulozy siarczanami wapnia lub magnezu, zawiera kwasy lignosulfonowe, cukry i organiczne sole wapnia:
*C. utilis, C. tropicalis, S. cerevisiae.
Serwatka - produkt uboczny przemysłu mleczarskiego, jest pozostałością po wytrąceniu kazeiny, zawiera 5% laktozy, 1% białka, 0,5% tłuszczu oraz sole mineralne i witaminy (rocznie wytwarza się 36-45 mln ton):
-serwatka kwasowa - otrzymywana po wytrąceniu kazeiny mleka na drodze fermentacji mlekowej,
-serwatka podpuszczkowa (słodka) - otrzymywana po enzymatycznym wytrąceniu kazeiny mleka za pomocą podpuszczki,
-serwatka włókiennicza (kwasowa) - otrzymywana po wytrąceniu kazeiny za pomocą kwasów solnego lub siarkowego.
*C. kefyr, Saccharomyces fragilis, S. lactis.
Wywar gorzelniczy - produkt uboczny po fermentacji etanolowej, zawiera pentozy, heksozy i celulozę (Torula torulopsis, Candida).
Ciekłe węglodowodory (C9-C18) - C. lypolitica, C. tropicalis, C. oleophila, Saccharomyces lipolytica, Rhodotorula, Torulopsis.
Metan, metanol - Methylomonas, C. boidini, Trichoderma (odporne na stężenie metanolu 30 g/l, norma 10 g/l).
Zastosowanie hodowli mikroalg:
-Eukariota (Chlorophyta, Rhodophyta, Bacillariophyta),
-Prokariota (Anabaena, Oscillatoria, Spirulina, Corynebacterium,
Oczyszczanie ścieków - usuwanie związków biogennych (azot, fosfor).
Produkcja nawozów - stosowane jako nawóz azotowo-organiczny (1 kg alg może zastąpić 60 kg tradycyjnych nawozów azotowych).
Otrzymywanie chemikaliów - aminokwasów, lipidów, witamin, pigmentów, polisacharydów.
Białkowy komponent pasz.
Białkowa odżywka dla ludzi - białko, witaminy (dużo kwasów nukleinowych, zwiększa koszty produkcji).
Produkcja etanolu:
Schemat produkcji:
-czyszczenie surowca (woda),
-parowanie (gorąca para wodna, następuje częściowa hydroliza skrobi),
-zacieranie z zmielonym słodem (hydroliza enzymatyczna, 15-30 min.).
-fermentacja (2-3 doby),
-rektyfikacja - wielokrotna destylacja etanolu do stężenia azeotropowego (96,5%), etap najbardziej kosztowny i energochłonny.
Surowce naturalne:
-zawierające cukry proste (melasa, serwatka, sok: z trzciny cukrowej, buraków cukrowych) - można stosować bezpośrednio,
-zawierające wielocukry (skrobiowe - ziemniaki, zboża; celulozowe - słoma, drewno) - należy zastosować obróbkę wstępną.
Wykorzystanie etanolu (gęstość 789,4 g/dm3, temperatura wrzenia 78,4˚C):
-jako paliwo - tani, wygodny, powstają nietoksyczne produkty spalania (dodatek do benzyn: do 20%),
-jako rozpuszczalnik - surowiec w przemyśle chemicznym.
Metody prowadzenia fermentacji etanolowej:
Proces okresowy (bimbrownie, kadzie 50-1000m3):
-warunki: 36-48 h, temp. 30-36˚C, początkowe pH 4-5, końcowe stężenie produktu 10-16%,
-zalety: łatwość operacji, niższe wymagania dotyczące sterylności, niskie ryzyko strat, łatwość podawania surowca,
-wady: niska produkcyjność.
Proces ciągły (kaskada bioreaktorów przepływowych):
-stężenie etanolu 4-10% (przeciętna gorzelnia produkuje 60 m3 etanolu / dobę),
-zalety: pracochłonności i czasu obsługi, zwiększenie produkcyjności, możliwość ciągłej destylacji etanolu,
-wady: groźba infekcji wewnętrznej, trudność utrzymania wysokich szybkości fermentacji, niższe stężenie etanolu
Zastosowane mikroorganizmy:
-drożdże: S. cerevisiae (glu, gal, fru), K. fragilis (glu, gal, lak), C. tropicalis (glu, ksyloza, ksyluloza),
-bakterie: Zymomonas mobilis (glu, fru, sach), C. thermocellum (glu, celobioza, celuloza).
Intensyfikacja procesu - zawracanie biomasy drożdży po fermentacji do następnej szarży.
Najważniejsze drobnoustroje fermentacji etanolowej:
Bakterie: Zymomonas mobilis: glukoza, fruktoza, sacharoza
Clostridium thermocellum: glukoza, celobioza, celuloza
Thermoanaerobium brockii: glukoza, sacharoza, celobioza, skrobia
Drożdze: Sacharomyces cerevisiae: glukoza, fruktoza
Sacharomyces uwarum: glukoza, fruktoza
Czynniki wpływające na produkcję etanolu:
Kwasowość - optymalne pH 4,5-4,7:
-poniżej 4,5 pH ogranicza ryzyko infekcji bakteryjnej,
-powyżej 4,7 pH wzrasta ilość glicerolu i kwasów organicznych w produktach.
Temperatura - optymalna 30-40˚C
-w wyższych temperaturach maleje aktywność drożdży oraz maleje odporność na toksyczne działanie etanolu.
Rodzaj substratu - szczepy są D- lub L-specyficzne, większość nie fermentuje L-cukrów.
Stężenie cukru - optymalne 12-20%, wysokie stężenia hamują proces.
Tolerancja na alkohol - drożdże browarnicze do 6%, piekarnicze do 12%, winiarskie do 15%.
Pożywki - źródło azotu (sole amonowe), fosforu (nawóz fosforowy, np. superfosfat), śladowe ilości witamin.
Rozpuszczony tlen - konieczne jest minimalne napowietrzenie (wzrost biomasy, zwiększenie produkcji etanolu)
Zanieczyszczenia mikrobiologiczne - bakterie kwasu octowego (Acetobacter) oraz kwasu mlekowego (Lactobacillus, Streptococcus).
Hydroliza surowców ligninocelulozowych (celuloza 40-45%, hemiceluloza 25-35%, lignina 15-30%):
Celuloza - nierozgałęziony biopolimer, polisacharyd, o cząsteczkach złożonych z kilkuset do kilkunastu tysięcy jednostek glukozy połączonych wiązaniami β-1,4-glikozydowymi oraz β-1,6-glikozydowymi:
-endocelulaza - usuwa wiązania β-1,6-glikozydowe,
-egzocelulaza - działa na wiązania β-1,6-glikozydowe, na końcu łańcucha, powstaje celobioza lub stachioza (gal-gal-glu-fru),
-β-glukozydaza - działa na wiązania β-1,4-glikozydowe w celobiozie (glu-glu).
Hydroliza kwaśna (kwas siarkowy) - do cukrów prostych, etanolu i furfaralu:
+ działa niespecyficznie, nie wymaga wstępnej obróbki,
+ duża szybkość hydrolizy,
- powstają składniki hamujące fermentacje oraz korodujące aparaturę,
- konieczność prowadzenia procesów w podwyższonej temperaturze, pod zwiększonym ciśnieniem
- niska wydajność hydrolizy,
- duże koszty chemikaliów.
Hydroliza enzymatyczna (B. subtilis, C. cellobioparum, Trichoderma reesei) - do cukrów prostych, etanolu i krótkich węglowodorów:
-zalety: brak korozji, nie wymaga zmian temperatury oraz ciśnień:
+ umiarkowane warunki procesu,
+ wysoka wydajność hydrolizy,
+ powstaje czysty syrop cukrowy dobry do dalszej fermentacji,
- działania specyficzne, konieczność wstępnej obróbki (delignifikacja, Trichoderma viride lub mechaniczne rozdrobnienie),
- mała szybkość hydrolizy,
- kosztowne otrzymywanie enzymów.
Hydroliza skrobi.
Skrobia - zbudowana z jednostek glukozowych (300-360), w postaci dwóch różnych polisacharydów: nierozgałęzionej amylozy (20%) oraz rozgałęzionej amylopektyny (80%), dzięki wiązaniom α-1,6-glikozydowym.
Endoamylazy:
-α-amylaza - działa na wiązanie α-1,4-glikozydowych wewnątrz łańcucha, powstają oligosacharydy:
*pochodzenia bakteryjnego (termostabilna), np. B. licheniformis (powyżej 90˚C), produktem jest glukoza,
*pochodzenia grzybowego (termolabilna) - produktem jest maltoza i maltotrioza (większa odporność na pH).
Egzoamylazy:
-glukoamylaza - działa na wiązania α-1,4-glikozydowe w łańcuchach bocznych, powstaje glukoza:
*pochodzenia grzybowego, odporne na wahania pH (A. niger pH = 1,8-8,8, A. awamori pH = 1,8-10,5),
-β-amylaza - działa na wiązania α-1-4-glikozydowe między drugą a trzecią jednostką glukozową, powstaje maltoza:
*pochodzenia roślinnego (zboża, jęczmień, soja),
-pullulanaza- działa na wiązania α-1,6-glikozydowe, usuwa rozgałęzienia:
*pochodzenia bakteryjnego (B. stearothermophilus).
Wykorzystanie:
-produkcja syropu glukozowego: glukoamylaza, pulluanaza, 60°C / 72 h,
-produkcja syropu maltozowego α-amylaza pleśniowa, 55°C / 48h,
-produkcja kwasu cytrynowego (A. niger),
-produkcja kwasu mlekowego (L. thermophillus, L. amylophillus),
-produkcja biomasy(C. utillis, Endomycopsis).
Produkcja piwa - surowcami są jęczmień, chmiel, woda i drożdże (górnej fermentacji S. cerevisiae, dolnej fermentacji S. uvarum):
Otrzymanie brzeczki słodowej (cukry, dekstryny, białka, aminokwasy, substancje goryczkowe i garbnikowe oraz sole mineralne):
-zacieranie słodu → filtracja → warzenie z szyszkami chmielowymi → filtracja → chłodzenie.
Fermentowanie brzeczki przez drożdże i leżakowanie piwa:
-fermentacja → dojrzewanie → filtracja → piwo.
Gotowanie brzeczki z chmielem ma za zadanie:
-ekstrakcję i transformację związków chmielu,
-sterylizację brzeczki i inaktywację enzymów,
-nadanie brzeczce odpowiedniego smaku, zapachu i barwy,
-wytrącenie osadów (kompleksy białek z polifenolami) oraz usunięcie niepożądanych składników (siarczan dimetylu),
-zakwaszenie i zagęszczenie brzeczki.
Produkcja win:
Schemat produkcji: rozdrabnianie → wyciskanie → siarkowanie → fermentacja → dojrzewanie → wino.
Gatunki:
-początek - dzikie (Pichia fermentans, Candida crusei, Torulopsis stellata, Hansenula anomala),
-główny proces - szlachetne (S. cerevisiae, S. boyanus, S. ellipsoideus, S. rosei, S. chevalieri):
-koniec - szlachetne (Włochy, Czechy, Węgry - S. boyanus, Niemcy, Francja - S.cerevisiae).
Cechy dobrych drożdży winiarskich:
-krótki czas adaptacji do środowiska moszczu i szybkie zafermentowanie,
-intensywna fermentacja i produkcja etanolu do wymaganego poziomu,
-wytwarzanie produktów ubocznych fermentacji, decydujących o właściwym smaku i aromacie wina,
-mała wrażliwość na niskie pH środowiska fermentacyjnego i wysokie stężenie kwasów organicznych,
-oporność na podwyższone stężenie etanolu, CO2, związków siarki (do 70-200 ml/l), garbników,
-zdolność do flokulacji i szybkiego osadzania się po zakończeniu fermentacji - szybkie klarowanie wina.
Rodzaje win:
-wina czerwone - z ciemnych winogron, jego charakter zależy od garbników, głównie taniny, zawartych w skórkach i pestkach, trwająca 10-30 dni fermentacja odbywa się w wyższej temperaturze niż w przypadku win białych,
-wina białe - z białych lub czerwonych winogron (bez skórki), trwa dłuższej niż w przypadku wina czerwonego,
-wina różowe - są najczęściej produkowane tak samo, jak czerwone, ale ciemne skórki winogron usuwa się już po 12-36 godzinach
Napoje alkoholowe destylowane:
Wódka (ziemniaki, ziarno zbóż), Scotch whisky (jęczmień), Irish whisky (jęczmień, pszenica, owies).
Aquavit (ziemniaki, zboża, kminek), Tequila (sok z kaktusa), Kirshwasser (wiśnie).
Cognac (białe winogrona), Armaniak (białe winogrona), Brandy (różne owoce), Rum (trzcina cukrowa), Sake (ryż).
Enzymy - białkowe katalizatory przyspieszające specyficzne reakcje chemiczne, obniżając energię aktywacji.
Budowa enzymów:
-proste: część białkowa (apoenzym),
-złożone (holoenzym): część białkowa (apoenzym) i część niebiałkowa (koenzym, np. FAD, CoA lub grupa prostetyczna, np. Mg2+).
Klasyfikacja enzymów:
-oksydoreduktazy - katalizują reakcje utleniania i redukcji poprzez przenoszenie protonów, elektronów (dehydrogenazy, oksydazy),
-transferazy - katalizują przeniesienie grup z jednego związku na inny związek (aminotrasferazy, kinazy),
-hydrolazy - katalizują reakcję rozpadu cząsteczek pod wpływem wody (esterazy, peptydazy, glikozydazy, amidazy),
-liazy - katalizują odłączenie od substratu grup, bez udziału wody (dekarboksylazy, deaminazy),
-izomerazy - katalizują odwracalnie transformację w odmiany izomeryczne związku (izomeraza glukozowa),
-ligazy - katalizują wytwarzanie wiązań między cząsteczkami (karboksylazy).
Aktywność enzymu - zdolność do wytwarzania 1 μmola produktu w czasie 1 minuty.
Zastosowanie enzymów:
-oszczędność surowców, zwiększenie wydajności,
-przyśpieszenie dojrzewania mięsa,
-poprawa jakości wyrobów skórzanych, zwiększenie trwałości.
Rodzaje enzymów:
-konstytutywne (genetyczne, stałe) - bakterie, człowiek,
-adaptacyjne, mutacyjne - bakterie.
Inhibitory - cząsteczki zmniejszające bezpośrednio aktywność enzymów.
Inhibicja nieodwracalna - kowalencyjna modyfikacja łańcuchów bocznych aminokwasów centrum aktywnego lub katalitycznego, np. aspiryna, penicylina, DFP, jodooctan.
Inhibicja odwracalna:
-kompetencyjna - inhibitor wykazuje strukturalne podobieństwo do substratu i konkuruje, z nim o związanie się w centrum aktywnym np. leczenia ludzi zatrutych metanolem - podając etanol;
-niekompetencyjna - inhibitor nie wykazuje podobieństwa do substratu i łączy się zarówno z samym enzymem jak i z kompleksem enzym-substrat, np. jony metali ciężkich (miedzi, rtęci).
Główne źródła enzymów:
Organy zwierzęce:
-żołądki cieląt - podpuszczka (ścinanie kazeiny w serowarstwie),
-wątroba bydląt - pepsyna, trypsyna, katalaza.
Rośliny:
-zboża - preparaty amylolitycznych,
-rośliny tropikalne - lateks (papania), figi (oficyna), ananas (bromelaina).
Mikroorganizmy. Producentami enzymów mogą być bakterie, drożdże i grzyby strzępkowe. Drobnoustroje mogą wytwarzać kompleksy enzymów; znane są też szczepy wydzielające w znacznych ilościach jeden tylko enzym.
Główne enzymy produkowane na skalę przemysłową:
Proteazy bakteryjne |
B. licheniformis B. amyloliquefaciens |
Proteazy grzybowe |
Mucor pusillus, M. miehei, A. oryzae, A. niger |
Amylazy bakteryjne |
Bacillus licheniformis Bacillus amyloliquefaciens |
Amylazy grzybowe |
A. niger A. oryzae |
Glukoamylazy |
Aspergillus, Rhizopus, Endomyces |
Izomeraza glukozowa |
Streptomyces olivaceus, S. wedmorenis, S. album, B. coagulans, Arthrobacter |
Pektynazy |
A. niger, A. wentii |
Lipazy |
Aspergillus, Rhizopus, Mucor |
Oksydaza glukozowa |
Penicillium |
Katalaza |
Aspergillus, Micrococcus lysodeikticus |
Inwertaza |
Saccharomyces |
Przemysłowe wytwarzanie enzymów:
PREPARAT ENZYMATYZNY ZASTOSOWANIE
Biologiczne detergenty |
bakteryjne proteazy, amylazy
|
proszki i płyny do prania |
Przemysł spożywczy |
lipazy
|
proszki i płyny do prania
|
Piekarnictwo |
amylazy grzybowe
|
rozkład skrobi w mące do cukrów
|
Browarnictwo |
słód jęczmienny
|
rozkład skrobi do cukrów prostych
|
Mleczarstwo |
renina otrzymywana z żołądków młodych przeżuwaczy, produkcja serów
|
Produkcja serów |
Metody unieruchomiania enzymów:
Metody z wykorzystaniem oddziaływań fizycznych:
-immobilizacja oparta na adsorpcji i adhezji - drewno, celuloza, szkło porowate, jonity (DEAE-celuloza, CM-celuloza),
-pułapkowanie wewnątrz struktury naturalnych lub syntetycznych polimerów - alginian, poliakrylamid, żywice,
-immobilizacja z wykorzystaniem półprzepuszczalnych membran - zamykanie w komórkach naturalnych (erytrocyty), kapsułkowanie i mikrokapsułkowanie (liposomy, kapsułki nylonowe).
Zalety: zachowanie struktury enzymu, łatwość i niski koszt prowadzenia procesu.
Wady: wymywanie enzymu ze złoża.
Metody z wykorzystaniem oddziaływań chemicznych:
-immobilizacja poprzez tworzenie wiązań kowalencyjnych - silikażel i aldehyd glutarowy, diaminy, izomocznik.
Zalety: stabilność układu.
Wady: częściowa utrata aktywności enzymu (konformacja białka), wysokie koszty.
Zalety i wady technik immobilizacji enzymów:
Zalety:
-stabilizacja struktury białek (zwiększona termostabilność i odporność na denaturacje),
-możliwość stosowania enzymów w środowisku organicznym,
-łatwe oddzielenie od mieszaniny reakcyjnej po zakończeniu procesu (wysoka czystość produktu),
-możliwość wielokrotnego wykorzystywania enzymu,
-ograniczenie inhibicji enzymu, zarówno przez substrat jak i przez produkt (większa wydajność procesu),
-możliwość pracy w systemach ciągłych (z wykorzystaniem reaktora przepływowego).
Wady (można usunąć przez dobór prawidłowej metody immobilizacji dla potrzeb konkretnego procesu technologicznego):
-wysoki koszt, związany głównie z otrzymaniem czystego preparatu enzymatycznego,
-utrata aktywności wywołana zmianą warunków fizykochemicznych środowiska,
-utrata aktywności wskutek związanie enzymu z nośnikiem w takiej konfiguracji, że centrum aktywne jest niedostępne dla substratu.
Zalety enzymów unieruchomionych:
-są mniej wrażliwe na czynniki zewnętrzne (PH, temperatura);
-są wykorzystywane przez dłuższy okres czasu i wielokrotnie;
-są przyjazne środowisku
-prosta technologia i aparatura do procesów z ich użyciem
-obniżone koszty technologiczne procesów z ich użyciem
-możliwość pominięci kosztownych i pracochłonnych metod ich izolacji i oczyszczania
-łatwość wydzielania produktu i biokatalizatora z mieszaniny poreakcyjnej
Biologiczne testowanie enzymów:
Toksyczność doustna: 4 tygodnie
Test na karcinogenosc - rak
Test na teratogenosc - płód
Toksyczność doskórna: podrażnienie skóry i oczu
Patogeniczność szczepów produkcyjnych, inokulacja odpowiednich pożywek
Procesy z unieruchomionym materiałem biologicznym.
Immobilizacja komórek na powierzchni lub wewnątrz stałego nośnika jest stosowana wtedy, gdy celem procesu nie jest otrzymanie biomasy mikroorganizmów, lecz przeprowadzenie odpowiedniej przemiany za pomocą enzymów zawartych w komórkach.
Biokonwersja - proces jest prowadzony w warunkach niejałowych, bez napowietrzania
-materiał biologiczny: enzymy, nieaktywne komórki, aktywne komórki (nierosnące)
Wytwarzanie metabolitów niezwiązanych ze wzrostem - proces czasami wymaga napowietrzania:
-materiał biologiczny: aktywne komórki (w fazie stacjonarnej, rosnące na powierzchni lub wewnątrz nośnika).
Wytwarzanie metabolitów pierwotnych - procesy wymagają napowietrzania:
-materiał biologiczny: komórki muszą być tak unieruchomione, aby możliwy był normalny metabolizm substratu.
Rekombinacja (w obrębie dwóch komórek) - wymiana oraz łączenie materiału genetycznego między chromosomami:
-ogólna (duże odcinki DNA),
-miejscowa, nieuprawniona (małe odcinki DNA),
-plazmidowa (przenoszenie wolnego DNA).
Koniugacja - wymiana DNA poprzez połączenie dwóch komórek za pomocą mostków pilusowych:
-Staphylococcus, Pseudomonas
F+ (męska z plazmidem) → F- (żeńska bez plazmidu) F+ (męska z plazmidem) → F+ (rekombinant).
Transformacja - pobieranie DNA przez komórki, które są w stanie kompetencji (protoplastyzacji):
-Bacillus, Rhizobium, Streptococcus
Transdukcja - przenoszenie DNA przez bakteriofagi:
-ogólna - opuszczenie genomu, wniknięcie do cytoplazmy i wydostanie się na zewnątrz (brak efektu),
-specyficzna - opuszczenie genomu z częścią nowego DNA, infekcja kolejnej bakterii i wprowadzanie część nowego DNA od poprzedniego gospodarza, powstaje rekombinant (jest efekt).
Budowa RNA i DNA:
Skład chemiczny |
DNA |
RNA |
Cukier pięciowęglowy |
deoksyryboza |
ryboza |
Zasady azotowe purynowe |
adenina, guanina |
adenina, guanina |
Zasady azotowe pirymidynowe |
cytozyna, tymina |
cytozyna, uracyl |
Reszta kwasu |
fosforowego |
fosforowego |
Liczba łańcuchów |
2 |
1 |
Rodzaje kwasów nukleinowych |
Jeden rodzaj DNA |
Kilka rodzajów RNA, np. informacyjny, transportujący, rybosomalny |
Spełniane funkcje |
Źródło informacji genetycznej, synteza białek |
mRNA zawiera kopię kodu i przenosi ją na rybosomy tRNA transportuje aminokwasy do rybosomów rRNA bierze udział w biosyntezie białka |
Organizmy haploidalne i diploidalne:
Organizmy haploidalne: organizmy, które maja pojedynczą liczbę chromosomów. W haploidalnej komórce nie występują chromosomy homologiczne.
Organizmy diploidalne: to organizmy wyższe, zawierają więcej niż 1 chromosom
Pojęcie genu:
Gen: to najmniejsza jednostka dziedziczności. To ciąg nukleotydów w łańcuchu DNA genomu. Pojedynczy gen koduje za pośrednictwem mRNA pojedynczy łańcuch polipeptydowy lub inną cząsteczkę RNA.
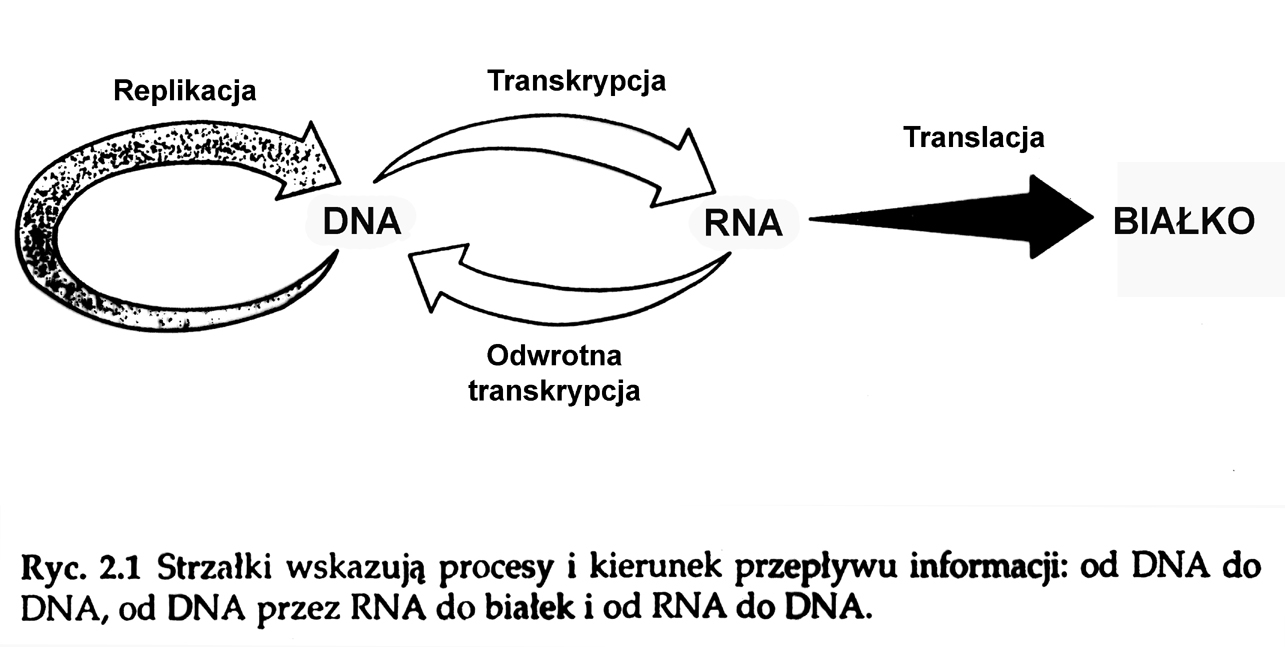
Zależność między transkrypcją, translacją i replikacją:

Replikacja: to proces w którym podwójna nic DNA ulega skopiowaniu.
Transkrypcja: to proces przepisania informacji zawartej w DNA na mRNA zachodzącym w jądrze komórkowym.
Translacja: to proces zachodzący na rybosomach, polegający na przetłumaczeniu informacji zawartej w mRNA w kolejność ułożenia nukleotydów, tworzących kodon, na kolejność ułożenia aminokwasów w białko.
Znaczenie plazmidów jako wektorów w przenoszeniu materiału genetycznego:
Plazmid: dwuniciowa, kulista, pozachromosowa cząsteczka DNA.
Dobry wektor tego typu powinien zawierać miejsca rozcinane przez enzymy restrykcyjne, przy czym z reguły dany plazmid posiada kilka takich miejsc dla kilku różnych enzymów. Miejsca te są zwykle zgromadzone w pojedynczym obszarze, zwanym polilinkerem. Żeby wprowadzić obcy DNA do wektora, należy wyciąć żądany fragment (gen) z większej cząsteczki (np. chromosomu lub innego plazmidu) za pomocą enzymu restrykcyjnego, który pozwala na uzyskanie wolnych końców, które można połączyć z wolnymi końcami przeciętego plazmidu. Mogą to być komplementarne lepkie końce lub tępe końce. Obcy DNA łączy się z plazmidem w reakcji prowadzonej przez enzym ligazę. Do wprowadzenia plazmidów do wnętrza komórki bakteryjnej przydatna jest metoda zwana transformacją.
Cechy przenoszone przez plazmidy:
- zdolność do koniugacji
- wykorzystywanie sacharozy
- oporność na antybiotyki
-oporność na jony metali ciężkich
- produkcja antybiotyków i bakteriocyn
Mutacje i rekombinacje charakterystyka i różnice:
Mutacje są to zmiany normalnej sekwencji DNA organizmu spowodowane działaniem czynników chemicznych i fizycznych lub błędami w replikacji DNA. Mutacje są utrwalane w wyniku podziałów komórkowych. Rodzaj mutacji i skutek jej działania są określone przez genotyp i fenotyp.
Rekombinacja ogólna jest procesem wymiany fragmentów DNA między chromosomami (lub dwuniciowymi helisami DNA), które mają długi wspólny, homologiczny region. Dwie homologiczne dwuniciowe helisy DNA (lub chromosomy) ustawiają się wówczas równolegle, następuje ich przerwanie i ponowne połączeni, z wymianą kodonów.
Najważniejszą różnicą między mutacjami a rekombinacją jest taka, że mutacje to proces niekontrolowany, natomiast rekombinacje z użyciem faga są bardzo precyzyjne. Ponadto mutacje są najczęściej niekorzystne, natomiast rekombinacje prowadzą najczęściej do poprawy właściwości produkcyjnych.
Genotyp: to skład genetyczny danego organizmu
Fenotyp: to ogół cech organizmu. Charakterystyka fenotypu tworzona jest przez ekspresje genów
Mutageneza: powstawanie i utrwalanie się mutacji w DNA komórek lub RNA wirusów; może być wynikiem samorzutnych błędów w procesach: replikacji DNA i reperacji DNA, a także efektem działania mutagenów uszkadzających DNA
Nukleozyd: związek zbudowany z zasady azotowej i pentozy połączonych wiązaniem N- glikozydowym
Nukleotyd: to podstawowy składnik budulcowy kwasów nukleinowych. Zbudowany jest z cukru- pentozy z 1 reszty fosforanowej i zasady azotowej.
Mechanizm działania antybiotyków- RNA, DNA, białko:
Antybiotyki działają poprzez:
1. Hamowanie syntezy kwasów nukleinowych poprzez blokowanie matrycy albo polimerazy DNA lub RNA na poziomie
-replikacji DNA - np.mitomycyna, bleomycyna
-syntezy RNA - np aktynomycyna, Ryfamycyny
2. Hamowanie syntezy białka poprzez blokowanie:
-funkcji rybosomów- np aminoglikozydy
-wiązania tRNA - np makrolidyniepolienowe, chloramfenikol, tetracykliny
3. Zakłócenie funkcji błon biologicznych poprzez
-zmiany w strukturze błony - np polimyksyny, amfoterycyny
-transport j ono w poza komórkę -np nystatyna, gramicydyna
4. Zakłócenie syntezy składników ściany komórkowej na etapie
-syntezy peptydoglikanu- np. wankomycyna
-transpeptydacji- np antybiotyki β-laktamowe
Swoista odpowiedź odpornościowa:
Odpowiedź humoralna - zależy od przeciwciał wydzielanych przez limfocyty B i jest podstawowym mechanizmem obronnym przeciw zewnątrzkomórkowym mikroorganizmom i toksynom:
-czynna: naturalna (przechorowanie) lub sztuczna (szczepienie),
-bierna: naturalna (otrzymanie przeciwciał przez łożysko lub z siarą) lub sztuczna (podanie surowicy)
Odpowiedź komórkowa - zależy od limfocytów T i pozwala zwalczać wewnątrzkomórkowe mikroorganizmy niedostępne dla przeciwciał, prowadzi do zniszczenia zainfekowanej komórki (fagocytoza, pinocytoza):
-czynna (powstanie aktywnych makrofagów stymulowanych limfokiną zdolnych do fagocytozy),
-bierna (przeniesienie komórek limfoidalnych lub ich ekstraktów).
Limfocyty B: to limfocyty szpikozależne, rodzaj limfocytów odpowiedzialnych za odpowiedź humoralna- produkcja przeciwciał niszczących antygeny. Powstają w szpiku kostnym i nigdy nie przechodzą przez grasicę.
Limfocyty T: to limfocyty grasico zależne, to rodzaj limfocytów odpowiedzialnych za odpowiedź komórkową- niszczą komórki obce dla organizmu. Powstają w szpiku kostnym, po czym wędrują do grasicy gdzie ulegają namnożeniu.
Immunizacja: polega na uodpornieniu organizmu na określony antygen:
- sposób naturalny: polega na przebyciu choroby
- sposób sztuczny- polega na otrzymaniu szczepionki
- bierna- organizm dostaje gotowe przeciwciała
Nieswoista odpowiedź odpornościowa:
Odpowiedź nieswoista- jest wrodzona, istnieje od urodzenia, nie jest skierowana na konkretny antygen
Bariery mechaniczne - skóra, błony śluzowe układu pokarmowego, oddechowego i moczowo-płciowego.
Bariery czynnościowe - kaszel, kichanie, perystaltyka jelit, aparat rzęskowy dróg oddechowych.
Bariery chemiczne - kwasy tłuszczowe na powierzchni skóry, lizozym, kwas solny żołądka.
Bariery mikrobiologiczne - flora bakteryjna organizmu.
Komórki żerne - makrofagi, neutrofile, bazofile, eozynofile, mastocyty (komórki tuczne).
Pamięć immunologiczna - skłonność do przyspieszonej i efektywnej odpowiedzi immunologicznej podczas ponownego kontaktu z antygenem, nawet po wielu latach od pierwszego kontaktu.
Immunogenność - zdolność cząsteczek do indukcji konkretnych przeciwciał.
Antygenowość - zdolność cząsteczek do reagowania z konkretnym przeciwciałem.
Epitop - fragment antygenu, zdolny do pobudzania komórki, aby produkowała konkretne przeciwciała:
Epitopy sekwencyjne - liniowe, składają się z sekwencyjnie ułożonych aminokwasów kodujących białko.
Epitopy konformacyjne - przestrzenne, zależne do struktur II-, III- i IV-rzędowych białka;
Antygen (antibody generator) - cząsteczka wywołująca odpowiedź odpornością
Immunogeny (duże cząsteczki) - wykazują antygenowość oraz immunogenność
Hapteny (małe cząsteczki) - wykazują antygenowość oraz immunogenność (w połączeniu z białkiem lub cukrem).
Immunoglobuliny - glikoproteiny wydzielane przez plazmocyty, które mają zdolność do swoistego rozpoznawania antygenów. Są to biała syntetyzowane przez komórki układu limfatycznego. Złożone z czterech glikozylowanych łańcuchów peptydowych połączonych ze sobą mostkami siarczkowymi:
-2 identyczne łańcuchy ciężkie (IgH) - wiązanie antygenu oraz funkcja efektorowa,
-2 identyczne łańcuchy lekkie (IgL) - wiązanie antygenu,
-region zawiasowy (miejsce zgięcia łańcuchów ciężkich).
Surowica: zawiera gotowe przeciwciała. Nie krzepnie, to płynna frakcja krwi, pozbawiona krwinek, płytek krwi
Szczepionka: zawiera antygen
Otrzymywanie przeciwciał monoklonalnych:
Otrzymanie komórek śledziony:
-immunizacja myszy antygenem z gęstym adwiuwantem (opóźnia metabolizm i zawiesza antygen)
-pobranie mieszaniny limfocytów i komórek plazmatycznych ze śledziony (po kilku tygodniach).
Otrzymanie komórek myeloma:
-komórki myeloma (nowotworowe), zmienione limfocyty dzielą się w niekontrolowany i nieograniczony sposób (nieśmiertelne),
-stosuje się linie z uszkodzonym genem fosforybozylotransferazy hipoksantynowo-guaninowej (HGPRT).
Fuzja komórek śledziony z komórkami myeloma = komórki hybrydoma:
-wymieszanie cytosoli oraz organelli (glikol polietylenowy rozluźnia błony),
-każda komórka hybrydoma, stale wytwarza homogenne przeciwciała o swoistości określonej przez macierzystą komórkę śledziony.
Selekcja komórek hymbrydoma, które nie uległy fuzji:
-selekcyjne podłoże HAT: pozwala na wzrost jedynie sfuzjowanym komórkom (hypoksantyna, aminopteryna - uniemożliwia zajście syntezy puryn alternatywną drogą metaboliczną, tymina, brak cytokin - limfocyty B, które nie uległy fuzji, ulegną apoptozie).
Klonowanie komórek hybrydoma przez `graniczne rozcieńczenia'.
Namnażanie komórek hybrydoma in vitro (μg/ml) lub in vivo (mg/ml).
Przeciwciała monoklonalne: to zbiór przeciwciał, które wykazują jednakową swoistośc względem danego antygenu i ewentualnie takie samo lub podobne powinowactwo. Są to przeciwciała otrzymywane z jednego klony limfocytów B.
Zastosowanie przeciwciał monoklonalnych:
- chromatografia powinowactwa: można w ten sposób oddzielić ściśle określone białko z mieszaniny różnych białek z bardzo wysoka sprawnością
-immunoterapia: zastosowanie przeciwciała jest połączone z odpowiednim lekiem, po związaniu przeciwciała z odpowiednim antygenem
-immunodiagnostyka: oznaczanie obecności określonych antygenów w badanych próbkach np. określenie zgodności lub niezgodności tkankowej
Mechanizm powstawania limfocytów plazmatycznych i pamięciowych:
Komórki plazmatyczne: powstają w wyniku pobudzenia limfocytów B i są jedynymi komórkami zdolnymi do produkcji przeciwciał
Limfocyty pamięci: rodzaj limfocytów B powstający w czasie pierwotnego zakażenia patogenem
Komórki pamięci mają zdolność przemiany w komórki plazmatyczne, wytwarzające przeciwciała niszczące te rodzaje drobnoustrojów, które zaczęły atakować organizm. Po przebytym zakażeniu w ustroju komórki pamięci pozostają i są przygotowane do wytworzenia dużej ilości przeciwciał w krótkim czasie, jeśli ponownie się pojawi w organizmie ten sam rodzaj drobnoustroju chorobotwórczego.
Komórki pamięci powstają z uaktywnionego limfocytu B. Limfocyt ten może ulec podziałowi na 4 komórki plazmatyczne bądź właśnie na 2 komórki pamięci.
Cechy nośników:
Wektorem służącym do klonowania może być taki element genetyczny, który ma zdolność do namnażania się po wprowadzeniu do komórki biorcy.
Wektory powinny:
-zawierać geny tzw. markery selekcyjne, nadające komórkom gospodarza łatwy do testowania fenotyp np. oporność na antybiotyk
-posiadać unikalne miejsca restrykcyjne rozpoznawane przez enzymy w obrębie rejonów, w które można wstawić obcy DNA bez naruszenia zdolności replikacji wektora i możliwości selekcji zrekombinowanych cząsteczek
-być niezdolne do przeżycia poza komórką gospodarza, namnażać się w niewielu szczepach oraz nie posiadać zdolności koniugacyjnych.
Organizmy transgeniczne, antygeny pełnowartościowe, hapteny- definicja:
Organizmy transgeniczne - posiadają nowe geny, które są dziedziczone.
Antygeny pełnowartościowe: to inaczej immunogenny, to substancja, która może spowodować indukcję swoistej odpowiedzi odpornościowej
Hapteny: to antygeny resztkowe, są to drobnocząsteczkowe substancje, które normalnie nie mają zdolności indukowania odpowiedzi odpornościowej, wykazują tylko antygenowość
Antybiotyki:
Substancja naturalna, pochodzenia drobnoustrojowego oraz ich półsyntetyczne modyfikaje i syntetyczne analogi.
Cechy antybiotyków:
-metabolity muszą być wytwarzane przez drobnoustroje albo rośliny i zwierzęta
- określony kierunek działania
Mają działanie wybiórcze
Oligodynamicznośc- małe dawki, wytwarzanie antybiotyków to cecha szczepowa
Szczepionka - produkt pochodzenia biologicznego zawierający substancje zdolne do indukcji określonych procesów immunologicznych warunkujących powstanie trwałem odporności bez wywołania działań toksycznych:
Podział szczepionek ze względu na antygen:
-szczepionki żywe o osłabionej zjadliwości (atenuowane) - przeciwko odrze, śwince, różyczce, wietrznej ospie, żółtej gorączce,
-szczepionki inaktywowane (zabite) - przeciwko wściekliźnie, grypie, zapaleniu wątroby typu B,
-szczepionki żywe (o pełnej wirulencji) - przeciwko ospie prawdziwej (zawiera wirus krowianki),
-anatoksyny (egzotoksyny pozbawione właściwości toksycznych) - przeciwko tężcowi, błonicy,
-autoszczepionki - sporządzana z drobnoustrojów pochodzących z organizmu chorego i tylko dla niego przeznaczona.
Podział szczepionek w zależności od swoistości:
-szczepionki monowalentne - zawierają jeden rodzaj antygeny pochodzące od jednego drobnoustroju,
-szczepionki poliwalentne - zawierają więcej niż jeden antygen pochodzące od jednego lub różnych drobnoustrojów
Podział szczepionek w zależności od postaci: szczepionki płynne lub wysuszone.
Cechy idealnej szczepionki:
-skuteczność (wywołanie swoistej trwałej odporności u 100% szczepionych już po jednorazowym podaniu);
-bezpieczeństwo (brak działań niepożądanych);
-trwałość, łatwość podawania, niska cena;
-łatwość i bezpieczeństwo produkcji.
Mianowanie - określanie ilości białka, która wywołuje odpowiedź odpornościową.
Szczepionki rybosomalne: zalety: brak toksyczności, bardziej wyrazista immunogennośc, możliwośc przeciwko większemu aspektu chorób
Antytoksyna (surowica) - preparat leczniczy zawierający swoiste przeciwciała skierowane przeciwko egzotoksynom:
Produkcja surowicy tężcowej, końskiej (dużo krwi, gruba żyła szyjna):
-wywołanie zakażenia C. tetani (małe dawki),
-po 2 tygodniach pobranie krwi,
-ekstrakcja białka,
-konfekcjowanie i mianowanie.
Autoszczepionki: to szczepionka własna, jest szczepionką przygotowana z zabitych drobnoustrojów uprzednio izolowanych z ogniska zakażenia od chorego i stanowiących odpowiedzialny za to zakażenie czynnik etiologiczny.
Szczepionka sporządzona z zabitych szczepów bakteryjnych świeżo izolowanych od chorego.
Szczepionki aktywne i nieaktywowane:
Szczepionka aktywna: żywa, to szczepionka zawiera żywe drobnoustroje, które mają znikome właściwości chorobotwórcze lub są ich pozbawione jednak zachowują swoje właściwości antygenowe.
Szczepionki inaktywowane: szczepionki te zawierają zabite drobnoustroje przy użyciu ciepła, substancji chemicznych lub promieniowania. Stosowane do zapobiegania chorobom bakteryjnym takim jak: krztusiec, dur brzuszny. Odporność po tego typu szczepionkach bywa znaczna, ale słabsza niż po szczepionkach żywych.
Produkcja antybiotyków - małocząsteczkowe substancje naturalne, pochodzenia drobnoustrojowego lub ich półsyntetyczne modyfikacje albo syntetyczne analogi, które w mały stężeniu działają wybiórczo na struktury i procesy biologiczne, hamując wzrost lub rozmnażanie komórek. W przyrodzie stanowią 10% puli metabolitów wtórnych (idiolitów).
Kryteria:
-kierunek działania: bakteriobójcze lub bakteriostatyczne (cykloseryna), synergiczne (penicylina z neomycyną) lub antagonistyczne,
-źródło biogenne,
-wybiórczość (g+/- tetracyklina, g+ penicylina, g- streptomycyna),
-oligodynamiczność (małe dawki, poniżej 1 ppm),
Producenci antybiotyków:
-promieniowce (6000): S. aureofaciens (tetracyklina), S.fradiae (neomycyna), S.erythreus (erytromycyna), S. griseus (streptomycyna),
-grzyby (2000): Tolyplocadium niveum (cyklosporyna C), A. fumigatus (fumagilina), P. chrysogenum (penicylina G),
-inne bakterie (1000): B. subtilis (bacytracyna), B. circulans (butyrozyna).
Wyodrębnianie antybiotyków:
Metody: - oddzielenie komórek od cieczy za pomocą filtracji lub wirowani
- wyodrębnienie, oczyszczenie antybiotyków; metody chromatoforowe
- zniszczenie błony cytoplazmatycznej
Działanie antybiotyków:
Zakłócenie procesów energetycznych lub oddechowych (antymycyna).
Hamowanie syntezy kwasów nukleinowych poprzez blokowanie matrycy albo polimerazy DNA lub RNA na poziomie:
-replikacji DNA (mitomycyna), -transkrypcji RNA (aktynomycyna).
Hamowanie syntezy białka poprzez blokowanie:
-funkcji rybosomów (aminoglikozydy), -wiązania tRNA (tetracykliny).
Zakłócenie funkcji błon biologicznych poprzez:
-zmiany w strukturze błony (polimyksyny), -transport jonów poza komórkę (gramicydyna).
Zakłócenie syntezy składników ściany komórkowej na etapie:
-syntezy peptydoglikan (wankomycyna), -transpeptydacji (penicylina).
Podział antybiotyków ze względu na toksyczność:
Antybiotyki nietoksyczne:
-beta-laktamowe (penicyliny, cefalosporyny).
Antybiotyki umiarkowanie toksyczne:
-aminoglikozydowe (streptomycyna, neomycyna), -makrolidowe (erytromycyna),
-tetracykliny, -chloramfenicol.
Antybiotyki bardzo tyksyczne:
-polipeptydy (bacytracyna, kolistyna), -przeciwnowotworowe
Podział antybiotyków ze względu budowę chemiczną:
Pochodne aminokwasów:
-β-laktamowe (penicylina), -polipeptydowe (cyklosporyna),
-glikopeptydowe (wankomycyna),
Pochodne cukrów:
-aminoglikozydy (streptomycyna), -glikolipidy (moenomycyna).
Antybiotyki makrocykliczne:
-makrolidy właściwe (erytromycyna), -makrolidy polienowe (nystatyna).
Chinony i ich pochodne:
-antracykliny (aklarubicyna), -tetracykliny (chlorotetracyklina),
-benzochinony (mitomycyna).
Inne antybiotyki:
-pochodne cykloalkanów (cykloheksimid), -nukleozydy (polioksyna),
-polietery (lasalocid), -związki aromatyczne (chloramfenikol).
Oporność bakterii na antybiotyki.
Przyczyny braku reakcji na antybiotyki:
-oporność naturalną (wrodzona) - stała cecha gatunku, szczepu lub całej grupy,
-oporność nabyta - w wyniku zmian w genomie na skutek mutacji (losowej) lub w wyniku nabycia od innych bakterii opornych genu,
-bezpośrednie mechaniczne rozrywanie komórek - przez ich ucieranie, rozcinanie, mielenie,
-działanie czynnikami fizycznymi - ultradźwięki, szok osmotyczny, gwałtowna dekompresja, zamrożenie i rozmrożenie,
-działanie czynnikami chemicznymi - rozpuszczalnikami organicznymi, detergentami, kwasami, które uszkadzają błonę komórkową.
Klasyfikacja wg Davisa i Maasa: MECHANIZM ZALEŻY OD:
-inaktywacja leku - zamiana na jego nieaktywna formę pochodną, z udziałem enzymów wytwarzanych przez komórki oporne.
-modyfikacja miejsca komórkowego wrażliwego na lek,
-zahamowanie transportu leku do opornej komórki,
-wytworzenie alternatywnej drogi pozwalającej ominąć etap wrażliwy na lek,
-zwiększenie poziomu enzymu, który podlega inaktywacji,
-zwiększenie poziomu metabolitu, który jest antagonistą inhibitora,
-zmniejszenie zapotrzebowania na produkt tej drogi metabolicznej, która podlega zahamowaniu.
Opracowanie nowego leku:
Pozyskiwanie szczepów - ze środowiska lub kolekcji.
Skrining wstępny - hodowla, testy in vitro.
Otrzymywanie czystego produktu - biosynteza, izolacja produktu (identyfikacja i ewentualna modyfikacja struktury chemicznej).
Badanie aktywności biologicznej produktu - opracowanie formy leku, testy na zwierzętach (myszy, szczury), badania kliniczne.
Uruchomienie produkcji nowego leku - rejestracja leku, optymalizacja technologii, ulepszenie szczepów.
Produkcja egzosacharydów:
Dekstran - substytut plazmy krwi (L. mesenteroides, Klebsiella, Acetobacter).
Alginian - lody, błyskawiczne budynie i kremy, środek powierzchniowy w produkcji papieru (Azotobacter vinelandii, P. aeruginosa).
Ksantan (celuloza z trzycukrowymi podstawnikami) - dodatek do napojów, miękkich serów, bita śmietana (Xanthomonas campestris).
Pullan - czynnik osłaniający w produktach spożywczych (Aureobasidium).
Kurdlan - czynnik żelujący w budyniach (Alcaligenes faecalis).
Produkcja hormonów.
Biotransformacja (oleje roślinne: diosgenina, stygmasterol, β-, γ-sitosterol)::
-produkcja hormonów steroidowych (kortykosteron, estrogeny, gestageny, androgeny).
Transformacja plazmidowa (E. coli):
-produkcja hormonu wzrostu - wydzielany przez przysadkę mózgową, biologiczną aktywność uzyskuje za pośrednictwem somatomedyny (wytwarzanej w wątrobie), zahamowanie następuje pod wpływem somatostatyny (wytwarzanej przez podwzgórze), która jest także antagonistą insuliny, glukagonu oraz pepsyny,
*działanie: pobudzanie wzrostu masy ciała i wzrost, zwiększenie poziomu cukru oraz wolnych kwasów tłuszczowych,
*budowa: 191 aminokwasów, zawierające dwa mostki disiarczkowe,
-produkcja insuliny - wydzielana przez trzustkę (9 l bakterii / 10 000 cieląt):
*działanie: transport glukozy do wnętrza komórek, co obniża poziom glukozy we krwi,
*budowa: 51 aminokwasów, 2 łańcuchy polipeptydowe A i B, połączone dwoma mostkami disiarczkowymi,
*analogi insuliny (modyfikacja aminokwasów): szybkodziałające i długodziałające.
Produkcja interferonu.
Induktory interferonu:
-naturalne (wirusy, bakterie, w tym endotoksyny, pierwotniaki),
-sztuczne (cykloheksimid, polifosforany, polisiarczany).
Rodzaje interferonów:
-interferon α (białko, m.cz. 16 000 - 23 000) - produkowany przez ludzkie leukocyty:
-interferon β (glikoproteina, m.cz. 20 000) - produkowany przez diploidalne fibroblasty,
-interferon γ, immunologiczny (glikoproteina, m.cz. 20 000 - 25 000) - produkowany przez ludzkie limfocyty T.
Claviceps purpurea - grzyb pasożytujący na zbożach, wytwarza przetrwalniki w postaci długich, purpurowoczarnych rożków.
Sporysz zawiera wiele alkaloidów - ergotaminę oraz aminokwasy - tyrozynę, tryptofan, histydynę, leucynę, kwas asparaginowy.
Ergotamina - alkaloid sporyszu o budowie strukturalnej zbliżonej do amin biogennych (noradrenaliny, serotoniny i dopaminy), posiadający zdolność do wiązania się z ich receptorami. Powoduje skurcz mięśni gładkich macicy i naczyń krwionośnych.Otrzymuje się z niej kwas lizergowy, którego używa się do produkcji LSD.
Leuconostoc- są to paciorkowe heterofermentatywne. Do tego rodzaju nalezą dwa przemyśle spożywczym gatunki:
Leukonostoc Citororum- występuje w mleku w którym z cukru i kwasu cytrynowego wytwarza dwuacetyl nadająy masłu charakterystyczny aromat.
Leukonoctoc Nesenteroides- paciorkowce te na podłożu z sacharozą wytwarzają bardzo dużo śluzu. Jest nie pożądany w cukiernictwie gdzie powoduje śluzowacenie słodów i zatyka przewody.
Produkcja witamin - synteza chemiczna lub biologiczna (fermentacja):
Witamina B12 - zapobiega anemii (Propionibacterium, Pseudomonas, Rhodopseudomonas):
-filtracja → ekstrakcja (etanol, KCN) → oczyszczanie
-sorpcja na węglu aktywnym → desorpcja (aceton 95%) → sorpcja na węglu aktywnym → desorpcja (woda amoniakalna)
-krystalizacja → produkt
Witamina B2 - dodatek do pasz (Clostridium acetylobutylicum, Candida, Streptomyces olivaceus, Ashbya gossypii):
-pełna synteza chemiczna,
-synteza chemiczna z D-rybozy otrzymanej z hodowli mikroorganizmów,
-synteza biologiczna.
Witamina C:
-chemiczna hydrogenacja D-glukozy w D-sorbitol,
-biologiczne utlenienie D-sorbitolu w L-sorbozę (Gluconobacter suboxydans),
-chemiczna kwaśna cyklizacja kwasu diaceto-2-keto-L-gulonowego w kwas askorbinowy.
Źródło pozyskiwania drobnoustrojów surowicy odpornościowej:
Surowica odpornościowa: surowica o dużej zawartości swoistych przeciwciał otrzymywana w wyniku naturalnego lub sztucznego uodpornienia określonym antygenem. Jest to preparat zawierający gotowe przeciwciała natychmiast niszczące wrogie dla ustroju antygeny.
Uzyskuje się z:
- najczęściej z krwi zwierząt lub ludzi, którzy przebyli zakażenie albo zostali sztucznie uodpornieni
- czasami pacjentom zamiast surowicy która zawiera konkretne przeciwciała podaje się gamma-globuliny człowieka
Gamma-globuliny: to zagęszczona surowica krwi ludzi zdrowych
Produkcja penicyliny:
Przygotowanie materiału: rozmnażanie grzybów i biosynteza penicyliny w bioreaktorach
Etapy wyodrębnienia penicyliny:
-oddzielenie od reszty komponentów przez wirowanie lub filtrację
-zniszczenie błony plazmatycznej
-zniszczenie ściany komórkowej przez środowisko chemiczne
-chromatografia jonowa lub sorpcyjna
Insulina: anaboliczny hormon peptydowy o działaniu ogólnoustrojowym, odgrywający zasadniczą rolę przede wszystkim w metabolizmie węglowodanów, lecz także białek i tłuszczów. Insulina została odkryta w 1922 przez Fredericka Bantinga. Insulina produkowana jest przez wysp trzustki. Najważniejszym bodźcem do produkcji insuliny jest poposiłkowe zwiększenie stężenia glukozy we krwi.
Produkty fermentacji mleka:
Bakterie mezofilne (L. lactis, L. casei): mleko zsiadłe, maślanka, twaróg.
Bakterie termofilne (L. delbrueckii, S. thermofilus): jogurt.
Bakterie mezofilne, termofilne oraz inne bakterie lub drożdże: kefir, kumys.
Kultury starterowe - zestaw bakterii inicjujący fermentacje mlekową:
Przetwory mleczne:
-kefir (S. lactis, S. cremoris, Kluyveromyces fragilis, Lactobacillus),
-jogurt (S. thermophilus, L. bulgaricus),
-kwaśna śmietanka (S. lactis, S. cremoris).
Sery:
-twarde typu cheddar (S. lactis, S. cremoris),
-twarde z gęstwy wysoko-dogrzewanej (S. thermophilus, L. bulgaricus, L. lactis, L. helveticus),
-półtwarde i miękkie z gęstwy nisko-dogrzewanej (Leuconostoc cremoris, S. lactis, S. cremoris),
-miękkie typu camembert i brie (P. camemberti, P. candidum),
-miękkie, maziowe (Brevibacterium linens),
-miękkie typu roquefort (P. roqueforti).
Produkcja serów:
Homogenizacja, pasteryzacja mleka.
Zaprawianie mleka - podpuszczka destabilizuje micele kazeina-fosforan wapnia, powstaje stront kazeinowy.
Krajanie i suszenie ziarna (powstaje serwatka).
Sery miękkie: formowanie, ocieranie, solenie, osuszenie i dojrzewanie.
Sery twarde i półtwarde: płukanie, dogrzewanie, dosuszanie, formowanie, osuszenie i dojrzewanie
Produkty fermentacyjne przerobów feta:
Ser feta jest produkowany z mieszanki pasteryzowanego mleka owczego z mlekiem kozim- to drugie stanowi tylko 5-10% owej mieszanki. Niedozwolone jest używanie środków konserwujących lub koloryzujących.
Należy do grupy serów miękkich o zawartości tłuszczu ok. 40%.
Jest serem kruchym, dobrze topiącym się w wysokiej temperaturze.
Hodowle komórek roślinnych.
Różnice w hodowli komórek roślinnych i bakteryjnych:
-rośliny rosną wolniej (20-40 h) niż bakterie (0,5 h),
-bakterie wykazują większe zapotrzebowanie na tlen niż rośliny,
-rośliny są bardziej wrażliwe na mieszanie niż bakterie,
-do wzrostu bakterie potrzebują energię chemiczną (cukry), natomiast rośliny słoneczną (fotosynteza),
-komórki roślinne są znacznie większe (20-100 μm ) niż bakterie (0,2-1 μm),
-lokalizacja metabolitów wtórnych u bakterii jest zewnątrzkomórkowa, u roślin wewnątrzkomórkowa.
Zastosowanie:
-badanie metabolizmu komórkowej, w tym mechanizmów biosyntezy białek,
-określanie wpływu poszczególnych substancji (inhibitorów) oraz czynników fizycznych,
-obserwacja mutacji,
-wykorzystanie metabolitów: fitohormony, alkaloidy, sterydy.
Totipotencja - zdolność do odtwarzania całego organizmu z 1 komórki somatycznej, w której zawarta jest cała informacja genetyczna.
Otrzymywanie roślin transgenicznych - pierwsze rośliny transgeniczne uzyskano w 1983 roku (tytoń, petunia).
Wybór odpowiedniego genu - izolacja i klonowanie genu do wektora.
Stworzenie konstruktu genowego:
-sekwencje regulacyjne - odpowiedzialne za funkcjonowanie genu (promotor, terminator),
-gen markerowy - odpowiedzialny za selekcje stransformowanych komórek (odporności na antybiotyki, herbicydy),
-gen reporterowy - odpowiedzialny za wczesne wykrycie stransformowanych komórek (białko zielone GFP).
Transformacja w kultur in vitro - wprowadzenie genu do protoplastów, z których łatwo jest zregenerować rośliny.
Sprawdzenie obecności wprowadzonego DNA:
-PCR (wykrycie śladowych ilości DNA),
-Southern Blot (wykrycie DNA za pomocą sondy oligonukleotydowej),
-Northern Blot (wykrycie transkrypcji genu poprzez wykrycie mRNA za pomocą sondy oligonukleotydowej).
Metody uzyskiwania nasion transgenicznych:
Metody bezpośrednie (bezwektorowe):
-mikroiniekcja - bezpośrednie wprowadzenie DNA do jąder protoplastów (wydajność 15-25%),
-elektroporacja - wprowadzenie DNA do protoplastów za pomocą krótkich impulsów elektrycznych, które powodują powstawanie porów w błonie, przez które DNA (w formie linearnej) wnika do wnętrza komórki, (wydajność 2-8%),
-metoda chemiczna - inkubacja protoplastów z plazmidowym DNA w obecności jonów magnezu i glikolu polietylenowego, który obniża napięcie powierzchniowe błony komórkowej, umożliwiając wnikniecie DNA do komórki, (wydajność 0,1-12%).
Metody pośrednie (wektorowe):
-za pomocą Agrobacterium tumefaciens oraz Agrobacterium rhizogenes (jedynie roślinny dwuliścienne).
Efekty genetycznego doskonalenia roślin:
Jabłka- odporność na insekty
Banany- odporność na wirusy i grzyby
Kawa- lepszy smak i aromat
Kukurydza- odporność na insekty
Ziemniaki- odporność na wiele zakażeń
Pomidory- odporność na zakażenia wirusowe
Pszenica- odporność na herbicydy
Wykorzystanie roślin transgenicznych.
Odporność roślin na herbicydy - stosowanie nieselektywnych, ulegających biodegradacji herbicydów do zwalczania chwastów.
Odporność roślin na choroby i szkodniki:
-jabłka, kukurydza (geny z B. thuringensis, endotoksyny) - odporność na insekty,
-banany (geny chitynaz rozkładają ścianę komórkową) - odporność na grzyby.
Tolerancja roślin na stres abiotyczny (zagospodarowanie nieużytków rolnych):
-gen tolerancji na wysokie zasolenie pochodzący z namorzynów umożliwia stworzenie roślin transgenicznych.
Podniesienie zawartości odżywczych i smakowych roślin:
-ryż (wykorzystując geny żonkila) - nadprodukcja beta-karotenu, prekursora witaminy A,
-kawa - obniżona zawartość kofeiny oraz lepszy aromat,
-winogrona - odmiany bezpestkowe,
-truskawki - odmiany mrozoodporne,
-pomidory - lepszy kolor i zapach, dłuższy czas dojrzewania i mięknięcia,
-słonecznik - zmniejszona zawartość kwasów tłuszczowych.
Powiększenie spektrum barw roślin ozdobnych:
-petunia - wprowadzenie genu dihydroflawonolu z kukurydzy znacznie poszerzyło paletę barw tych kwiatów.
Bioreaktory:
-tytoń - produkuje somatotropinę,
-lucerna (gen z B. licheniformis) - produkuje alfa-amylazę,
-rzeżucha i rzepak - produkują plastik, ulegający biodegradacji.
Nawozy bakteryjne - szczepionki zawierające bakterie wiążące azot atmosferyczny:
-azotobakteryna (Azotobacter): kapusta (o 33%), pomidory (o 28%), ziemniaki (o 30%), burak cukrowy i kukurydza (o 15%),
-nitragina (Rhizobium): lucerna (o 40%), groch i soja (o 15%), łubin i koniczyna (o 10%).
Produkcja szczepionek w roślinach transgenicznych:
-izolacja genu kodującego białko antygenowe mikroorganizmu chorobotwórczego,
-gen klonowany do wektora (A. tumefaciens) oraz transformacja genetyczna,
-roślina transgeniczna wytwarzająca białko antygenowe mikroorganizmu chorobotwórczego,
-rozmnażanie klonalne roślin transgenicznych - szczepionka roślinna,
-izolacja i oczyszczanie antygenu oraz tradycyjne szczepienie lub immunizacja poprzez bezpośrednią konsumpcję.
Argumenty za GMO:
Tworzenie nowych gatunków i odmian.
Wzbogacenie walorów smakowych, zapachowych, odżywczych.
Poprawa stanu środowiska naturalnego (transgeniczne bakterie, całkowita utylizacja odpadów).
Terapia genowa (walka z nowotworami oraz wrodzonymi anomaliami genetycznymi).
Ludzka insulina, hormon wzrostu produkowane jest na skalę przemysłową przez odpowiednio zmienione szczepy E. coli.
Drożdże produkujące szczepionki przeciw wirusom zapalenia wątroby (badania nad szczepionkami przeciwko AIDS).
Sondy genetyczne (pozwalają wcześnie wykryć szereg chorób dziedzicznych np. fenyloketonurię i anemię sierpowatą).
Produkcja ludzkich organów.
Argumenty przeciw GMO.
Nadprodukcja żywności (konkurencja cenowa, bezrobocie)
.
Przekazywanie odporności chwastom.
Niszczenie różnorodność.
Nie można zachować nasion do wysiania w następnym roku (kontrola korporacji nad rolnictwem, nasiona patent).
Problem stabilności genów, trudne do określenia skutki uboczne i zagrożenia
Zakazy prawne, moralne i kulturowe.
Hodowle komórek zwierzęcych.
Składniki pożywki:
-osocze (cielęce, 5-10%) - chroni przed uszkodzeniami, stymuluje podział komórek, dostarcza niektóre składniki, np. hormonów,
-roztwór odżywczy - zawierający glukozę, aminokwasy, witaminy i sole mineralne,
-antybiotyki - chroniące przed infekcją bakteryjną (penicylina) lub grzybową (nystatyna).
Zastosowanie:
-produkcja szczepionek wirusowych (opryszczki, polio),
-produkcja interferonów, przeciwciał monoklonalnych, hormonów (hormonu wzrostu),
-diagnostyka wirusów, badania nad rakiem.
Patent - prawo wydane osobie do zabronienia innym osobom zarobkowego bądź zawodowego korzystania z danego wynalazku
Cechy patentowalności: nowość, nieoczywistość, komercjaność, odtwarzalność opisu technologicznego
Wyłączenia z ochrony patentowej:
-odkrycia w przyrodzie - w celu uniknięcia monopolizacji dóbr natury w ich stanie naturalnym
*ochronie podlega metoda otrzymywanie danej substancji,
-metody chirurgiczne i terapeutyczne w odniesieniu do człowieka lub zwierzęcia - są pozbawione charakteru przemysłowego,
-metody otrzymywania nowych odmian roślin oraz ras zwierząt,
*ochronie podlega mikroorganizmy powstałe w wyniku modyfikacji przez zastosowanie inżynierii genetycznej,
-odkrycia sprzeczne z normami etyczno-moralnymi oraz legislacją.
Zalety ochrony patentowej:
-produkt lub proces jest chroniony przed konkurencją,
-odkrywca ma zapewnione korzyści materialne,
-opisy patentowe pozwalają uniknąć powielania badań, a jednocześnie stymulują postęp prac badawczych.
Okres ochrony patentowej: UE, w tym Polska (20 lat, od zgłoszenia), USA (17 lat, od przyznania), Japonia (15 lat, od opublikowania).
Techniki objęte patentowaniem w inżynierii genetycznej:
-izolacja i identyfikacja genów;
-modyfikacja genów,
-transfer genów,
-wprowadzania zmodyfikowanych układów (w tym genów) prowadzące do modyfikacji organizmów.
Przykłady patentowania żywych organizmów:
-bakterie degradujące olej,
-zmodyfikowane drożdże do produkcji piwa i innych alkoholi,
-zboża o zwiększonej zawartości białka,
-rośliny z wbudowaną odpornością na owady,
-zwierzęta gospodarskie o przyśpieszonym wzroście.