4
162
10,3. MITOCHONDRIA A ENERGETYKA KOMÓRKI
10*3*1. Źródła energii
-W wiązaniach chemi raźnych produktów f n.1iQF;v.rttrft-7^v^-^rnacra knowana chemi c z ni e
--^§Trerg-La może być wyk o r z y a t aną_z ar ó wno przez rośliny ,-)ak 1 zwierzęta'"(jzŁ^ET
_^energptyrynp a^P, ktQry'~od-gr_Y^q~^T»^gw^--rol_g_.we_^a?y^tklch_ _-Drocesach wy-
J^magf5ląŁ^ł> nakładu^enerąil. Dlatego też mitochondria określa się jako*1^ ^eleiidiirpwnie komórki".
10.3.2. Energia a reakcje chemiczne
Kaźd ęu-żywa--komórka obok wymiany,..materii wymienia z otoczeniem" energię. ._KomórkćL„1est wie^utoadenT]^ .^1 orgardźacji,~
swego uporządkowania f niskiei^g£mpli) wymaga, ciągłego dopływu ^ęneggii^ Ogr^nfczerd-e^^b^br'ak"’^iopływu energii prow^d^f^wj^mórce do wzrostu entropii, a więc do zakłóceń w jej organizacji_iv_.os^teciZ|^e,,^Rrz)r ich nasile-niuy dora^e~rciT~W "każdej reakcji chemicznej tylko część energii zostaje zużyta dla utrzymania stanu entropii (S). Energia ta nie może być wykorzystana w żadnych innych procesach. Natomiast energia, która może być wykorzystana do_„vvykonania-,priacy,.i czyJUy może^byp. przyporządkowana wymianie chemicznej, nazywa się energią swobodną (G). -
Zmianę,_energi-i^-swobodnej"Jwyraża sle . Zależeć onajaędzie od

-zmiany entalpii (AH) i zmiany entropii (AS) zgodnie \Z równaniem:
/ Afi =* ah _
Przez entalpię rozumiemy” energię przerdesioną^m.ędzy układem a otoczeniem (■ jęs"£~t^sumaT^ergil^ranslokacyjnej, oksydacy.inej-»^.eiektryQznej-~--~~i jądrowe jadanej - substancji). TwrównanlUjest^temperaturąbezwzględną.. Od energii swobodnej zależeć będzie przebieg: reakcji''cheńacznych.
W każdym procesie chemicznym odwracalnym .
w pewnym momencie pojawia się ~taRl'~at-ąny—gdy-nie będzie miała miejsce żadna zmiana netto, lecz gdy szybkość przechodzenia A w B będzie taka sama jak B w ,A. Stan taki określamy jako stan-równowagi chemicznej^ (K). .1 wyrażamy go:
K
IB3-
nr
względnie gdy reakcja ma więcej Składników:
A + B ^ C + ;D ;. jako- . K
[c3 - [D3
- IA] * [B];
symbole w nawiasach kwadr^tbwych oznaczają stężenia substancji występujących w reakcjach.
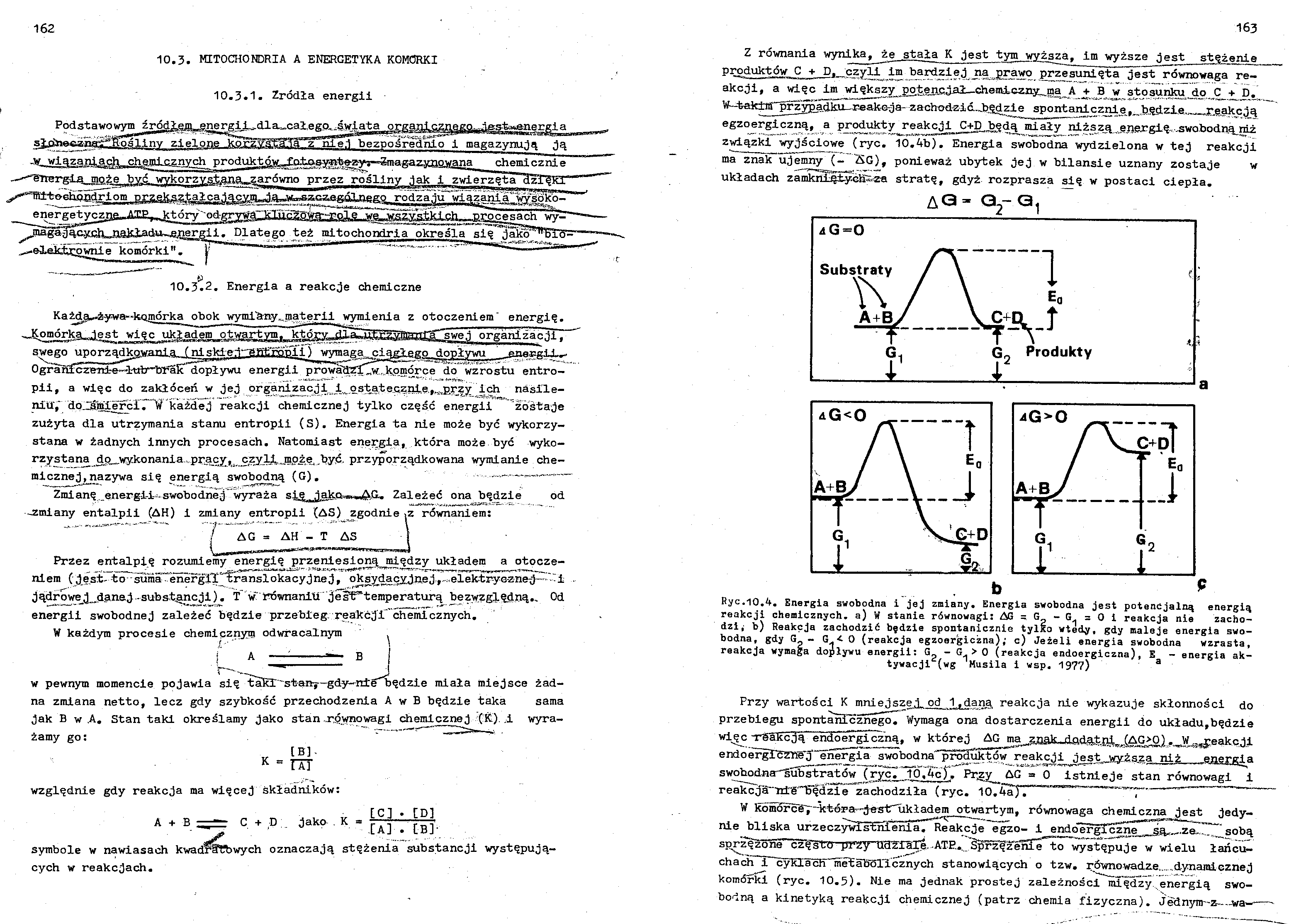
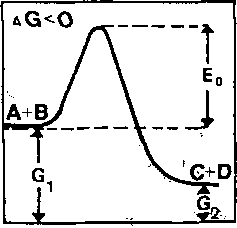
Z równania wynika, że stała K jest tym wyższa, im wyższe jest stężenie produktów C + D, czyli i® bardziej na prawo przesunięta jest równowaga reakcji, a więc im wiekszy potencjał—chemiczny, ma A +_ B w stosunku,.do. C_h^D«. ^--t^kim^^rzypadku^--- reak-c-j a- z a chodzi ć-Jjędzl e spontai^cz^e^_,b.ędzi-e,J-^,r,ę„akcją egzoergiczną, a produkty reakcji _C+D.będą miały niższ^ e.nergi% -swobodną^niż 2-wiązki wyjściowe (ryc. 10.4b). Energia swobodna wydzielona w tej reakcji ma znaiTujemny (- "AG), ponieważ ubytek jej w bilansie uznany zostaje w układach zamkniJpiiyGłi^z-a stratę, gdyż rozprasza się w postaci ciepła.
A<3 - G2- G,


b e
Ryc.10.4. Energia swobodna i jej zmiany. Energia swobodna jest potencjalną energią reakcji chemicznych, a) W stanie równowagi: AG = G ~ = 0 i reakcja nie zacho
dzi; b) Reakcja zachodzić będzie spontanicznie tylko wtedy, gdy maleje energia swobodna, gdy G« - G/0 (reakcja egzoergiczną); c) Jeżeli energia swobodna wzrasta, reakcja wymaga dopływu energii: G_ - G.> 0 (reakcja endoergiczna), E - energia ak-tywacji^(wg Musila i wsp. 197?) 3
Przy wartości K mniejszej, od 1Tdąna reakcja nie wykazuje skłonności do przebiegu spontanicznego^ Wymaga ona dostarczenia energii do układu,będzie wi^c -rSSRcją endoergiczną, w której AG ma znak»jiadaŁnin .(AG>^)..._W_M^eakc.1l endoergTcżh^j^ńergia swobodna'^pr^uktów reakcji jest wyższa niż energia swobodna^substratów (ryc. ld.4c}. Pr„zy^ AG » 0 istnieje stan równowagi i reakcj^diS^ędzie zachodziła (ryc. 10.4aj. ~
W komordg7~ictś-ra-"-jesirukładem otwartym, równowaga chemiczna jest jedynie bliska urzeczywis:6nIeniaT*Heakcje egzo- i endo^rgTczne sa^.ze-. sobą sp^z^żbne^częstrd prrży^dŻXaI$..ATH.. Śpr^^ż^enre^o występuje w wielu łańcuchach i cyklacii InetaboTićznych stanowiących o tzw. równowadze......dynamicznej
komórki (ryc. 10.5). Nie ma jednak prostej zależności między energią swobodną a kinetyką reakcji chemicznej (patrz chemia fizyczna). Jednyra^z—~wa~—■
Wyszukiwarka
Podobne podstrony:
162 10,3. MIT0CH0NORIA A ENERGETYKA KOMÓRKI 162 10.3.1. Źródła energii 10.3.2. Energia a reakcje
img065 2 1. Bieg na lOOm <10 s źródła energii: ATP
wykres 10 energia Polska Odnawialne źródła energii ■ Węgiel kamienny ■ Gaz ziemny &
10.2. Opis matematyczny prądnicy prądu stałego Najprostszym opisem każdego źródła energii elektryczn
ene w li 10 paliwa Odnawialne źródła energii ■ Węgiel kamienny ■
KONWENCJONALNE ŹRÓDŁA ENERGII- uran Jest najbardziej energetycznym pierwiastkiem Nie wydobywamy go w
rOdnawialne Źródła Energii (OZE) Kamil Łapiński Specjalista energetyczny Powiślańskiej Regionalnej
page0022 — XVII Str. Tabl. 10. Produkcja energii elektrycznej w niektórych krajach (1923, !932, 1936
page0167 128 VIII. Górnictwo i przemysł TABL. 10. PRODUKCJA ENERGII ELEKTRYCZNEJ W NIEKTÓRYCH
GOSPODARKA ODNAWIALNYMI ŹRÓDŁAMI ENERGII Energetyka słoneczna • Energetyka
3.10.2. Źródła i bilans mocy biernej 3.10.3. Kompensacja mocy
Wydział Inżynierii Produkcji i EnergetykiTekst: Maciej Kaliński, III rok Odnawialne Źródła Energii i
więcej podobnych podstron