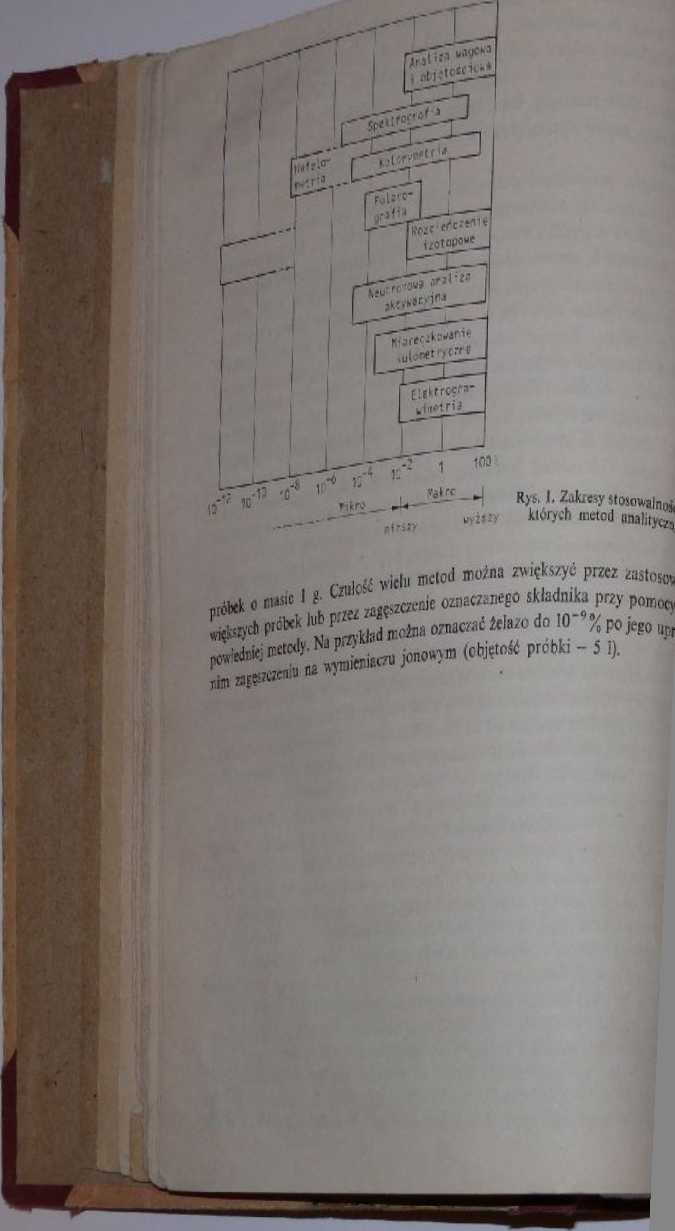
P1100075
METODY ELEKTROCHEMICZNE
1. WPROWADZENIE DO METOD ELEKTROCHEMICZNYCH
W metodach elektrochemicznych wykorzystywana jest zależność pomiędzy ro-Idzajem lub ilością badanej substancji i pewną wielkością elektryczną lub elektro-I chemiczną związaną z tą substancją. Metody elektrochemiczne dzieli się na trzy ■grupy według zjawisk, jakie zachód/4 na elektrodach:
I A. Metody, przy których nie przebiega reakcja elektrochemiczna oraz nie tworzy się warstwa podwójna, a transport dyfuzyjny można pominąć. Chodzi to przede wszystkim o migrację jonów (której miarą jest przewodność właściwa x) i o polaryzację dielektryczną (której miarą jest stalą dielektryczna e). Do grupy tej zalicza się konduktomotrię, dielektrometrię i oscylometrię.
B. Metody związane z reakcją elektrodową
1) przy zerowym prądzie faradaj owakim (po tcncjomc tri a),
2) przy niezerowym prądzie faradajowskim,
a) z niestacjonarny ni procesem elektrodowym — wykorzystuje się tu zależność mierzonych wielkości od czasu (chronoamperometria, polarografia, cbronopotencjo-metria, woltamperometria z liniowo zmieniającym się potencjałem, miareczkowanie uinperometryczne z zastosowaniem kroplowej elektrody rtęciowej),
b) ze stacjonarnym procesem elektrbdowym (woltamperometria w warunkach kontrolowanej konwekcji, miareczkowanie uinperometryczne z dwiema elektrodami wskaźnikowymi, poloncjometria z elektrodą polaryzowaną prądem stałym),
c) z wykorzystaniem zmiennego napięcia lub prądu (polarografia zmiennoprądowa sinusoidalna, polarografia pulsowa pochodna, polarografia prostokątna, polarografia przy częstościach radiowych, oscylopolarografla, polarografia Kalouska itd.).
C. Metody z elektrolizą obejmującą cały roztwór (oparte na prawie Faradaya). Do lej grupy zalicza się kulometrię potcncjostatyczną, miareczkowanie kulometrycz-ne, elektrograwimelrię i metody clektrometryczne ze wstępnym zagęszczaniem elektrolitycznym.
Wyszukiwarka