P1100078
hcierogcakaiy charakter zjawisk elektrodowych ich kinetyka określona jest prze* strukturę warstwy podwójnej, adsorpcje, skład c/ektroliłu podstawowego itd. Ną podstawie teorii absolutnych szybkości reakcji forma tne stałe szybkości heteroge. niemej reakcji elektrochemicznej można wyrazić następująco:
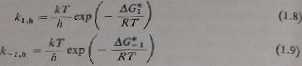
gdzie: k - siata Holtźrńar.na, h - siała Plancka, O* — energia aktywności reakcji przeniesieni*-ładunku.
Ze względu na to, że energie aktywacji reakcji elektrochemicznych zależ)) od potencjału, równania (1.8) i (1.9) woźna także napisać w postaci
M> = (1A0)
Ł-i.s - *°-i.a eap p^2^ e) (LII)
gdzie: kfih i stałe szybkości reakcji przy E = 0, x — stała empiryczna
(zwykle (z - 0,5). określana także jako współczynnik przeniesienia ładunku.
Wartości liczbowe wielkości kf k i k°.lA zależą od potencjału elektrody porównawczej. Formalne stałe szybkości reakcji zwykle określa się w odniesieniu do potencjału normalnego (£0), formalnego (E'fJ lub równowagowego (EJ. Jeśli formalne stale szybkości reakcji są określone poprzez potencja? formalny, wówczas
|
'Hi* “ ii e*p (- jlp p - £ó)j |
(1-12) |
|
ppi$F- (e-ed) |
(1.13) |
|
Jeśli E'0 wyznaczy się z równania Ncmstu | |
|
,mF RT1 B0 0 & !F 1 [Red} |
(U4) |
i podstawi to wyrażenie do równań (1.12) i (1.13), wówczas po uwzględnieniu równania (1.5) otrzymuje się zależności określające stałe szybkości reakcji w odniesieniu do potencjału równowagi
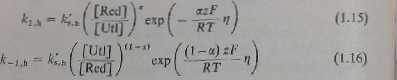
Prąd katodowy (IJ i prąd anodowy (/,) określają następujące wymienia:
hmxFAklthiUtl}0 (1.J7)
Ł^zWŁóĘRcdJo (U8)
jdiic A - wielkość powierzchni elektrody, [Utl]0i[Ked]0 - stężenia postaci utlenionej i zredukowanej substancji clektroaktywnej na powierzchni elektrody ($» x •* 0).
W elektrochemii, zgodnie z umową, prądowi katodowemu przypisuje się znak jodami a prądowi anodowemu - znak ujemny (w elektrotechnice jest odwrotnie).
Korzystając z zależności (1.15) - (1.18) dla całkowitego prądu faradajowikiego otrzymuje się następujące wyrażenie:
/ ** /*+/*
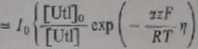
[Red],
' PST
(1.19)
jd»c
J0 = zFAk',^ [Red]* [UtI]"-‘>
(1-20)
jest prądem wymiany. Gęstość prądu wymiany zmienia się w granicach 1-10'11 mA/cm2.
Równanie (1.19) opisuje ogólną zależność pomiędzy całkowitym natężeniem prąciu i potencjałem dla przypadku, gdy stężenia reagujących substancji na powierzchni elektrody i w głębi roztworu są tóźne (w wyniku skończonej szybkości przenoszenia substancji). Przenoszenie substancji odbywa się przez dyfuzję, migrację i konwekcję. Dyfuzja wywoływaną jest gradientem stężeń, migracja oddziaływaniem pola elektrycznego na jony. Konwekcja jest przenoszeniem hydrodynamicznym, spowodowanym przez przepływ lub mieszanie roztworu. W roztworze, w którym znajduje się nadmiar elektrolitu podstawowego, prąd faradajowski określony jest tylko przez dyfuzję i konwekcję. Jeśli struktura warstwy podwójnej nic zmienia się w czasie, przy danym potencjale ustala się określony prąd faradajowski i krzywa prąd-napięcie nic zależy od czasu. Sytuacja taka występuje w polarografii, wolt-iiUperomctrii 2 wirującą elektrodą dyskową i podczas elektrolizy przebiegającej w cienkiej warstwie. Krzywą prąd-napięcie można wykreślić na podstawie krzywych /—/, biorąc pod uwagę określony punkt na osi czasu. Z tak otrzymanych krzywych prąd-napięcie widać, że dla dostatecznie ujemnych łub dodatnich wartości potencjału prąd faradajowski osiąga wartość graniczną /, (patrz rys. 1.3). W obszarze prądu granicznego szybkość reakcji elektrodowej jest określona szybkością dostarczania (dyfuzji) substancji clektroaktywnej do powierzchni elektrody. Wartość prądu granicznego nie zależy od szybkości procesu przeniesienia ładunku. Jest ona wprost proporcjonalna do stężenia substancji clektroaktywnej - zależność ta wykorzystywana jest w chemii analitycznej.
Stosunek stężeń poszczególnych składników na powierzchni elektrody i w głębi roztworu można wyrazić przy pomocy prądów granicznych
(1.21)
in _ hjcL
W '..i
[Red], /„-/
IM 'i.
29
(»2»
Wyszukiwarka