P1100090

n

Tłi>*k* 3,1. PNewieły iorm«In» I fołwnlnc dla RaliGla
/iVgH-2*'c'JF~
sA*-«r-***■
I a?***' "Go**
I neo; H M* |J r - MnO, f-211,0 {Ce*'«' ■
MnO;+*M*^'-Mn,H+4Ha0
* 2&’ł+rH,0
“3C,~
, Ł 2H»° ftJ- 42r~ - Pt
I f H*
FHrf**2#--2H#
I Fc’fłr~ - *•**
I HgjS0,+2 • 2 H*fSO;~*»«* KjSO,)
I MflOI+2 UaO+3 r - M»0,4d OB'
I nc(CN>r+*"" ft<CN>J*
I c*1'-*2*' ="
. W H&CW - H*+cr (0,1 M KCI)
I MMfcCiłr * H»40“ (IMKGJ) i m JteOt-1/- • H$ fU- («& KO)
, Agan- ■= Ag+a- (0.1 M KCD Aga+r - Aj*-a-(iMKco AfQ+<" - Ag+CI~<«ai- KO)
Cu,ł+e" =CU*
'só*ʧ:*‘WMił
I 2IT+2 *• fli
I TP'+«'-Tił4 I ł/20,«ł-H|0+2 t~ e* 2 OH'
I Cl”*e~ * Cr*~
• CH*+21' "Ce I Za,,4-2 t~ » Zn I 22fcO+2e- =■ 20H~łH|
I U*+r “ li
MMrycb układów fedokt (Icmp.
Ą.JTS, y 2,«7
2.01 I
*-*42
1.095
*,tT(
1,52 ‘
j.tó j
I.3J
1,3S
1.329
0,854
0,169
0,789
0.771
0,053«>
0,57
0,36
0.337 j 03 3S# 0.281» 0,244** 0.290*1 0.222*1 0,199*» 0.1S3 A 0.15: 0,000 -0,37 -0.401 -0,41 -0.91 -0,763 -0,828 -3,043
12. SCHEMATYCZNE PRZEDSTAWIANIE OGNIW
Sumaryczna reakcja w ogniwie chemicznym jest reakcja redoks. Na elektroda ujemnej zachodzi proces utleniania — elektroda ta zaznaczana jest po lewej stroair schematu. Po pranej stronie schematu zaznacza sio elektrodę dodatnią, na której prachjęga proces redukcji. Schemat ogniwa zapisany jest więc w taki sposób, ic jego sito ciektromoiorycm (SEM) jest równu potencjałowi elektrody umieszczonej po prawej stronie względem drugiej elektrody. Grnnicu faz oznaczana jest linią pionową,
podczas ady podwójna linia pionowa oznacza dwio granice Sto (mostek elektrolityczny). Slan fizyczny składników oznacza się w następujący sposób: substancje jialc — s, ciecze — c, gazy — g, roztwory nasycone — nas. Na rys. 3.1. przedsta
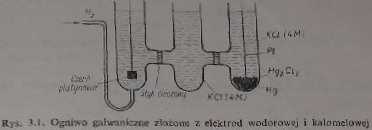
wione jest ogniwo złożone z elektrody wodorowej i elektrody kalomelowej. wykorzystywane przy pomiarach pH
Pt; Ha (g, 101 325 Pa)lroztwór XIKC1 (nas)| Hg3 Cla(s) Hg(c) (3.3)
Silit elektromotoryczna ogniwa galwanicznego
B - E„ -fi, (3.*)
Równanie (3.2) przedstawia zmianę entalpii swobodnej, związaną z reakcją chemiczną przebiegającą w ogniwie. Dla samorzutnej reakcji AG < 0, a zatem £ > 0. Wartości potencjałów normalnych, podane w tab. 3.1, określone są względem elektrody wodorowej, którą umieszcza się po lewej stronie schematu ogniwa pomiarowego. Każda reakcja przebiegająca w ogniwie — ze względu na to, że związana jest 7. elektrodą umieszczoną po prawej stronie schematu (elektroda dodatnia) - pisana jest jako proces redukcji (potencjał redukcyjny). W przypadku gdy E0 < 0, AC > 0, tzn. na elektrodzie, która jest ujemna względem elektrody wodorowej, wspomniana wyżej reakcja w rzeczywistości biegnie w przeciwnym kierunku1'. Jeśli £0 > 0, AG jest ujemne, tzn. reakcja elektrodowa biegnie zgodnie z podanym równaniem. Potencjały normalne, odpowiadające reakcjom pisanym jako procesy utleniania, stanowią potencjały utleniająco i mają przeciwny znak.
Wszystkie przytoczono reguły są streszczeniem konwencji sztokholmskiej (1953) uchwalonej przez Unię Międzynarodową Chemii Czystej i Stosowanej — UJ PAC (International Union of Purc and Applied Chemistry) na konferencji w Sztokholmie.
3.3. POTENCJAŁ MIESZANY
Jeśli do roztworu, w którym znajduje się kilka układów redoks nie reagujących chemicznie ze sobą (lub gdy szybkość reakcji jest znikomo mała), zanurzy się elektrodę obojętną, wówczas na elektrodzie tej zachodzi wymiana elektronów dla
Chodzi tu o reakcję przedstawioną równaniem (3.2) — przyp. tłum.
Wyszukiwarka