P1100091
wszystkich nkłuddw*. Potencjał elektrody w takim przypadku jest potencjałem n,^ sranym Vr» rys. 3.2. przedstawi ono krzywe prąd-nnpięcic <łla substancji A i j znajdujących się równocześnie w roztworze.
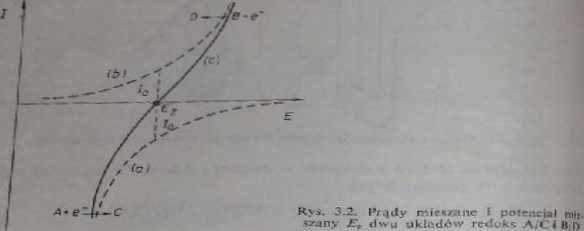
Krzywe u, b są cząstkowymi krzywymi prąd-napięcic. Krzywa #* przedstawj* sumę krzywych a-rb. Prąd wymiany /0 przy potencjale mieszanym ZT* jest po stronic uifcacania określony równaniem fl-c *> D, a po stronic redukcji — równa, fliwn A+*~ C.
Potencjał mieszany wykorzystuje się w miareczkowaniach potencjomclrycznycb w przypadku, gdy jeden ze składników roztworu miareczkowanego tworzy układ nicodwracaIny. Na przykład w manganometrii po punkcie równowainilcowyrn wy. korzystuic się potencjał mieszany układu MnO* /H20. Potencjał w punkcie pne-gięcia krzywej miareczkowania stanowi najczęściej potencjał mieszany układu ti> f rantu i układu miareczkowanego. Z wykresu nu rys- 9.7 widać, te przy miareczko* waniu żelaza dwuwartościowego solą cerową potencjał mieszany w punkcie pne-gięciu krzywej miareczkowania (patrz krzywa prąd-napięcic dla x — 1) określony Jest przez okład Fes^/Ce3#_ Z krzywych prąd-nnpięcie wynika, te omawiany przypadek jest analogiczny do przypadku powolnej reakcji elektrochemicznej; wówczas £, (punkt przecięcia krzywej prąd-napięcic z osią E) jest niestały i łatwo ulegs zmianie.
3.4. POTENCJAŁ DYFUZYJNY
Po połączeniu dwóch półogntw za pośrednictwem membrany półprzepuszc rataj na granicy roztworów powstaje warstwa podwójna jako wynik dyfuzji prszczególnych składników roztworów. Przyczyną powstania warstwy podwójnej jest różnica ruchliwości anionów i kationów'. W ten sposób na granicy elektrolitów powsuje spadek potencjału określany mianem potencjału dyfuzyjnego Ed. Potencjał dyfuzyjny ma największą wartość w pobliżu rzeczywistej granicy pomiędzy obydwoma
roztworami i zmniejsza się w kierunku do wnętrza roztworów. Całkowity potencjał dyfuzyjny otrzymuje się po wałkowaniu spadku potencjału wzdłuż całej granicy pomiędzy roztworami. Nie jest to potencjał równowagowy, ale ponieważ dyfuzja jest powolnym procesem, można przy jego wyprowadzaniu stosować te same zależności, co dla potencjału równowagi. Wartości potencjałów dyfuzyjnych na granicy faz
roztwór X|KCU,
obliczone dla niektórych roztworów z równania Hendersona (dla temp. 25°C) przedstawiono w tabl. 3.2.
tablice 3.2. Wartości potentatów dyfuzyjnych na grasic? Uz rezlnór X |KCI (mu.), obflruec t iłnnb Hendersona (irmp. 25*0
|
Roztwór |
£*inV |
|
HCI O.l M |
4,6 |
|
HO 0,01 M |
3,0 |
|
KO 0,1 M |
1.8 |
|
Wodoroftahn potasowy 0,05 M |
2.6 |
|
NajCO, 0,01 M |
2.4 |
|
NaOH 0,01 M |
V |
|
NaOH 0,1 M |
-M |

Ogniwa, dla których trzeba uwzględniać potencjał dyfuzyjny, nazywane są ogniwami z przenoszenieml). SEM takich ogniw jest mniejsza lub większa (zależnie od kierunku wzrostu potencjału w warstwie podwójnej) niż w przypadku gdyby ogniwa to były ogniwami bez przenoszenia. Ponieważ potencjał dyfuzyjny jest nic pożądanym zjawiskiem, należy go przy pomiarach potencjometrycznych (przynajm-


|
B. l| |
e | |
|
Rys. 3.3. Styki cieczowe: a) styk jedno- |
lii | |
|
rodny, b) styk z dyfuzją wymuszoną, |
fla | |
|
e) tryk z płynącą cieczą, d) swobodny |
[B | |
|
Styk dyfuzyjny |
4* |
4 |

niej częściowo) wyeliminować; w razie konieczności styk cieczowy realizuje się w taki sposób, żeby potencjał dyfuzyjny był stały i odtwarzalny. Rozróżnia się cztery rodzaje styków cieczowych (rys. 3.3).
“ Podana definicja jeu bardzo ogólna. Ogniwem stężeniowym z prreuoszcaka nazywamy ogniwo, które zbudowane jest z pufognfw różniących się jedynie stężeniem roztworów - przyp. tłum.

Wyszukiwarka