P1100095

3.7.4. Elektroda szklana
Elektroda szklarz jest elektrodą membranową i v, r.wyklywi wykonaniu Lt selektywna względem jonów wodorowych w szerokim przedziale pH. W *'ależnc*j od składu szkła może być selektywna także w stosunku do jonów sodu, potasu ini amonu.
Najbardziej użyteczna jest elektroda szklana odwracalna względem jonów *©. dorowych, którą można stosować niemal dla wszystkich roztworów'— wcrdityci, i nic wodnych. Obecność utleniaczy i reduktorów w roztworze nie przeszkadza pr* pomiarach pil, ponieważ potencja! elektrody szklanej nie zależy od procesów m|e". niania — redukcji- Nic przeszkadza również obecność substancji organicznych, białek koloidów, .alkaloidów, szlamów, substancji powierzchniowo czynnych itp. Elektn*j| szklana stanowi niemal uniwersalną elektrodę do pomiaru pH. Wykorzyslywana je*t zarówno do pomiarów laboratoryjnych jak i do ciągłych i nieciągłych pomiar6* v* przemyśle chemicznym, a także d«> pomiarów wykonywanych w wysokiej terope?*. turze i pod wysokimi ciśnieniami. Specjalnie wykonano elektrody >/klane mogą p»*. cowąć w icmp. 130-150 °C (zwykłe elektrody wytrzymują temperaturę do 40- 50*Ci Przy ciśnieniu wyższym niż 600 kPa ogniwo pomiarowe musi być tak skonstruowane, żeby boi dany roztwór nic wnikał do elektrody porównawczej. Elektrody s/klan: o specjalnej konstrukcji wy korzys ty wen e są w mikrobiologii, fizjologii, medycy ni; om/ przy pomiarach pil wewnątrz substancji stałych i na ich powierzchni. Możni |K>wiedzicć. Ze mierzenie pH zai pomocą elektrody szklanej jest najbardziej rozpowszechnioną r najdokładniejszą metodą pehametryczną.
Zwykła elektroda szklana zbudowana jest z bardzo cienkiej membrany szkte-nej (0.01-0.1 mai) najczęściej w kształcie bańki o średnicy JO—I 5 min. ze specjalnego szkła o określonej przewodności elektrycznej (np. szkło sodowe Corning 015 o składzie: 22% NaaO. 6% C&O i 72% SiO,). Schemat ogniwa galwanicznego z elektrodą szklaną przedstawiono nu rys. 3.6.

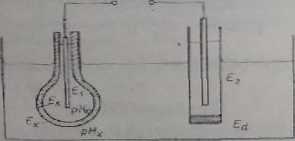
R>». 3.6. OsnŁwo ąalwuniczno 7 elektrodą szklaną . £Tj •• potencjały elektrod porównawczych. £■». ~ potencjały na zewnętrznej i wewnętrznej ściance membrany. £j — potencjał uyuiaęyjny,
£* — sumaiTuna siła elektromotoryczna ogniwn
62
Jeśli no obydwu stronach membrany znajdują się roztwory o różnej wartości pH, pomiędzy obydwiema stronami membrany powstaje różnica potencjałów ł\. proporcjonalna do różnicy pH. Jeśli wartość pH roztworu wewnętrznego utrzymuje aę na stałym poziomie i zmienia się pH zewnętrznego roztworu, można stwierdzić, te elektroda szklana w przedziale pH l-l 1 zachowuje się jak elektroda wodorowa.

Różnica potencjałów pomiędzy szkłem i roztworem wewnętrznym w myśl równania Nemstii wyraża się akżnotóą analogiczną dla elektrody wodorowe]
|
RT E* - y- te aM-.i |
(333) |
|
Podobnie dla roztworu zewnętrznego | |
|
r RT u |
(IM) |
|
Różnica potencjałów F.,-Ex. czyli potencjał membrano wy | |
|
r pc E7* l?H‘. Ł * |
<3-35) |
|
względnie w temp. 25 JC t, m 0,0591 (pH,-pH*) |
(336) |
Powitanie potencjału membranowego wyjaśnia się na podstawie teon* granicy faz, izn., wykorzystując teorię wymieniaczy jonowych. Szkło ma trójwymiarowy szkielet krzcmiuuowy, składający się i atomów krzemu i tlenu, w którym znajdują się dosyć ruchliwe kationy metali alkalicznych. Elektroda szklana imm być przed użyciem namoczona w wodzie. Podc/is tej operacji cząsteczki wody do membrany i wytwarzają warstwę uwodnioną o grubości 20-ICfl nm. Powstawać tej warstwy jest warunkiem sprawnego funkcjonowania elektrody >zkJancj. Przekrój takiej membrany przedstawiono na rys. 3.7. W warstwie uwodnionej znacznie więks/a

_.h*
Jmkt
to
R>«. 3.7. Przekrój poprzeczny iriirincy szklanej
jest (ok. 1000-krotnk) ruchliwość kationów w porównaniu z wewnętrznym „suchym** szkłem. Sumaryczną reakcję przebiegającą na granicy faz można opisać równaniem Nał(s/Wo)+H+(roztwór) = H+(szkto) Na'(roztwór) (3.37)
Dla elektrody szklanej do pomiaru pH współczynnik selektywności ma małą wartość i elektroda w przedziale pH 2-11 jest selektywna jedynie względem jonów H‘. W środowisku silnie alkalicznym nic można już pomijać wyrazu Kjjg, *Wom w równaniu (3.10) i zaczyna przejawiać sie zależność potencjału elektrody od aktywności jonów sodowych. W związku z tym powstaje błąd dodatni (alkaliczny) (wartości pH, otrzymywane w wyniku pomiaru, są mniejsze niż wartości
Wyszukiwarka