P1100098
w którym pmbiegn reakcja
*2' H*(fi)-ł-AgCI(s) = Ag(*) + a’ + Hf
RT ,
■Sr- In Oh- aci
0.52) 0 53)
Przypadku nie występuje, pozostaje jednak nie. zonna aktywność jonów chlorkowych. W związku z tym dla celów praktycznych wprowadzono urnowe skale pH w oparciu o odpowiednie wzorcowe roztwory buforowe. Przy sporządzaniu takich skal współczynnik aktywności ym oblicza M podstawie teorii Dcbyc «-Hflełcia. przy czym jako parametr wielkości jonu przyj, muje sie umownie wartość 0.456 na. Uproszczenie to wprowadza błąd ±0,01 pH. chociaż dokładność (odtwarzalność) pomiaru pH może wynosić do ±0,005 jednostki pH. Nieznane pH" wyznacza się na podstawie wzorcowych roztworów bufa. rowych zgodnie z równaniem
054)
pH « pH(S)+ —
2.3026
gdzie ft — SEM ogniwa pomiarowego (które składa się z elektrody odwracalnej względem jonów wodorowych i z elektrody porównawczej) w środowisk u badanego roztworu. Kierunek E jest określony znakiem elektrody wskaźnikowej. E(S) przed-
Tablica 3.4. Wzorcowe roalirory buforowe
|
1 Roztwór buforowy |
pH (S) temp. 25 "C |
Od ważka na roztworu. |
|
1 Szczawian (0.05 M) |
1,679 |
12,61 |
|
1 KHj (CiOJj *2 EĆsO | ||
|
[ Winian (0,0341 M) |
3.S57 |
nasycony w temp |
|
1 FCH^PH«0,t |
(6.40 g) | |
|
| Cytrynian (0,05 M) |
3.776 |
11.41 |
|
i KHXC4H,0; |
10.12 | |
|
FtaJati (0.05 M) |
4,008 | |
|
KBC1H4O4 |
3,388 | |
|
Fosforan (1 ;l> |
6,865 | |
|
KHaP04 (0,025 M) |
3,533 | |
|
Na,HPO« (0,025 M) | ||
|
Fosforan ( l :3.5> |
1.179 | |
|
1 KUjPO* (0,006695 M) | ||
|
Na ,1*1*0* (0,03032 M) |
7,413 |
4,302 |
|
Boraks (0.01 M) |
9,180 |
3,80 |
|
Na,B*O7-I0 H,0 Węglan (1:1) |
2,092 2.640 | |
|
NtHCO, (0,025 M) |
10.012 | |
|
Na, CO, (0.025 M) | ||
|
Wodorotlenek wapnia |
12,454 |
nasycony w temp |
|
Ot (OH), (0.0203 M) |
A |
stawia SF.M w środowisku wzorcowego roztworu buforowego pH(S). Podstawowe wzorcowe roztwory buforowe wykor/ystywune w umownej skali pH /cnUiwiono w tabl. 3.4.
3.9. MIARECZKOWANIE POTENCJOMETRYCZNE
W miareczkowaniu potencjometry ornym bada się zależność potencjału odpowiedniej elektrody wskaźnikowej od objętości dodawanego mianowanego roztworu.
W rozdziale omówiono jedynie miareczkowanie potencjometry c/nc przy prądzie zerowym. Miareczkowanie z polaryzowanymi elektrodami opisano w rozdz. &. Krzywa miareczkowania polencjomctrycznego składa się z dwu części, z których każdu jckI funkcją logarytmiczną.
Przy alkaoymctrycznym miareczkowaniu mocnego kwasu mocną zasadą
H*+OH- - H20 (3.55)
potencjał równowagowy wskaźnikowej elektrody wodorowej określony jest do punktu równoważnikowego przez reakcję (3.13), a poza punktem równoważnikowym przez reakcję (3.19). Krzywe prąd-na pięcie w poszczególnych punktach krzywej miareczkowania przedstawiono na rys. 3.10.
I t
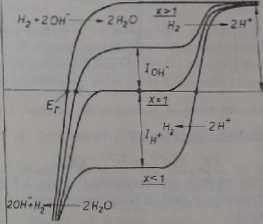
Rys. 3.10. Krzywo prąd-na pięcie dla elektrody wodorowej podczas miareczkowania mocnego
kwasu nocną zasadą
Jeśli pominie się zmiany objętości roztworu miareczkowanego w czasie miareczkowania oraz dysocjację cząsteczek rozpuszczalnika, wówczas
[Hf] = co0-x) dla x < 1
68
Wyszukiwarka