P1100100
Sofcią wymieniacza jonowego. W wielu przypadkach elektrody joooselckty^ noina stosować v przędzinie stężeń I0~*-1 M. '’"c
Miawcikontoie potfocjomrtrjanc jest jedną / najbardziej rozpowszccfcfe nych metod elektromctryeaiych. Potcnejoinctryćzna metoda wyznaczania końcowego miareczkowania je?i dogodna dU wszystkich typów miareczkowań j ^ nie tylko wówczas, gdy roztwory są zabarwione, ale również i w takich przypndkacń gdy można zastosować wizualną metodę mdykacji - metoda potencjornctryczm upewnia uzyskanie dokładniejszych i bardziej powtarzalnych wyników oznace Dokładność oznaczeń wykonanych metodą miareczkowaniu potcncjometiycznego wynosi zwykle 0,1%. Przeprowadzając miareczkowanie w atmosferze obojęt^j można osiągnąć dokładność do 0,01 %.
Potenejomctry czna metoda wyznaczania punktu końcowego ma dnie znaczenie dla miareczkowań prowadzonych w środowisku niewodnym przy oznaczaniu nr*, szaniu kwasów lub znsad niewiele różniących się mocą; mieszanin takich nie u<Ją* się oznaczać w środowisku wodnym. Potcncjomctryczna metoda wyznaczania punkt* końcowego znalazła zastosowanie również w miareczkowaniach strąccuiowych, słówn e w argentometni i merkurometrii, a także w miareczkowaniach kompleks metrycznych. Jednak najszerszezastosowanie metoda ta znalazła w miareczkowaniach redoks, dla których żadna inna metoda nic daje lepszych wyników.
Badanie równowag chemicznych I elektrochemicznych. Do badania równowag reakcji ptotółitycznych i reakcji tworzeniu kompleksów można wykorzystać pomiar SEM zarówno ogniw bez przenoszenia jak i ogniw z przenoszeniem. W niektórych przypadkach stale równowagi można wyznaczyć za pomocą krzywych minet/, kowania. Suk dysocjacji kwasów i zasad w przypadku dostatecznie rozcieńczonych roztworów są określone punktem połowicznego zobojętnienia kwasu lub zasady, Dokładniej«/e metody wymagają ekstrapolacji do zerowej mocy jonowej.
Przy badaniu równowag elektrochemicznych często stosuje się diagramy, które przedstawiają zależność potencjału układu redoks ud stężeń poszczególnych składników układu i od innego parametru, np. od pH.
Kinetykę i mechanizm reakcji chemicznych można badać, śledząc zmiany potencjału elektrody umieszczonej w środowisku reakcyjnym w czasie. Za pomocą krzywych £■/. uzyskanych dla różnych wartości stosunku reagujących substancji, można ustalić mechanizm reakcji. Przy stosowaniu tej techniki, dynamika obwodu wskaźnikowego musi być dostatecznie duża w porównaniu z szybkością badanej trakcji.
Automatyzacja kontroli laboratoryjnej i przemysłowej. Miareczkowanie potencje metryczne oraz pomiar pH lub pX można łatwo zautomatyzować. Titratory laboratoryjne oprócz rejestrowania krzywej miareczkowania śledzą równocześnie szybkość zmiany potendiłu i automatycznie dostosowują do tej szybkości dawkowanie odczynniku miareczkującego. Miareczkowanie można przeprowadzać również w uli sposób, żeby dodawanie odczynnika zostało automatycznie przerwane po osiągnięciu wybranej wartości potencjału. Nowoczesne titratory z wyjściem cyfrowym drukują dane pomiarowe albo wprowadzają jc do pamięci maszyny liczącej: dla dokonania dalszej obróbki.
W pł«m>4le potencjomctria wykcrzy^ywna jest do auiwnaiyczncj regulacji pH w kickach, auwwatywiKl regulacji pH w procesie koagulacji kauczuku nymetynnego, do kontroli pH w procesie fermentacji, w kąpielach elektrolitycznych, w procesie produkcji criule/y. kontroli potencjału redoks w przemyśle tekstylnym itp.
4. POLAROGRAFIA 4.1. WSTĘP
Polarografia jest melodii elektrochemiczną opartą na badaniu zależności natężenia prądu od zmiennego napięcia podczas elektrolizy badanego roztworu w warunkach pomiaru woltamperometryczncgo (elektroliza obejmuje jedynie cienką warstwę roztworu w pobliżu elektrody; dokładniej zagadnienie to omówiono po* niżej) przy zastosowaniu dwu elektrod; wskaźnikowej (mikioclektroda rtęciowa -najczęściej kroplowa) oraz porównawczej (odpowiednia elektroda nicpolary/owalna).
Wspomniana zależność nulężenia prądu cd napięcia nazywana jest krzywą polarograficzną /•£, która zwykle ma postać fali (rys. 4.1). Jeśli w roztworze nic ma substancji, która przy przyłożonym napięciu redukowałaby się tub utleniała na rtęciowej elektrodzie kroplowej, przez roztwór prąd nie płynie (jeśli pominie się stosunkowo mały prąd potrzebny do lądowania warstwy podwójnej w pobliżu elektrody kroplowej). W obecności substancji podlegających elektrolizie substancje elcktroaktywne - prąd wzrasta przy określonej wartości napięcia, które charakteryzuje jakościowo substancję ciektroaktywną. Wysokość fali polarograficznej jest miarą ilości, tj. stężenia substancji elektroaktywncj w badanym roztworze.
Rozprawę na temat badania substancji za pomocą rtęciowej elektrody kroplowej opublikował Hcyrowky w 1922 r. Wkrótce potem skonstruował on przyrząd do automatycznej rejestracji zależności średniego prądu od przyłożonego napięcia i nazwał stosowaną przez siebie metodę polarografią. W 1959 r Hcyrovsky otrzymał nagrodę Nobla 7 dziedziny chemii za odkrycie i opracowanie metedy polarograficznej.
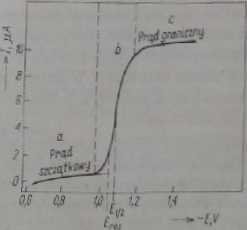
Rys. 4.1. Krzywa polarograficzna dla 1*10° M ZnJ * w 0,1 M KC1 « - obszar polaryzacji chemicznej, b - obszar depolaryzacji, c — obszar polaryzacji stężeniowi ,£ru - potencjał rozkładu, £,»i - potencjał półfah
Wyszukiwarka