P1100107

«IfC

wwtojci i polojicja» p'»łf«li bTAl^o i urlcuioncj <=>ręslo maj, podoba*
ci.-« iloicno^^so 5 *ym *»<MT»,i
n*3*-ZCZl ł<r u*a II0M710\VCCXł
\%-«rto^ć porcac/ał4»w pórt*r!i pociarc «■-. _______. .. . * —--i* . t -o-.«
iowej. ' C W sto’“"ku dł> nasyconej deki rody kelomc-
•o^cjo)
ol rzym uje
■• ^1° temp. 200c
S ^nowi podstawę eZw. «««/«,>&//
*C*1> kr^w, poJacog.afic^ W.. *.*. po odj^u p^du pojcmn^l^ pr«tm»«ronnu ;e i»kł»<iw W5P6łr/ędnych J5T. Ig sj<, ^
pro>f4 ^ fef<wcj wspó.teynni Jc kicrimkowy równy je^t _^
2.3 i?7l
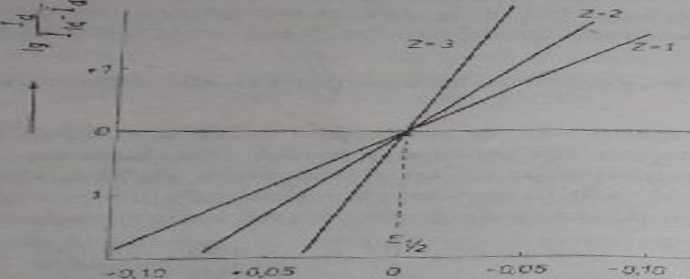
fali p<»laro^rafleukładów odwracalnych
i<>*. 4.<5. Aa3li22i logaf y t yruc^na
Jiczby clekCrortów biorących udział w reakcji elektrochemicznej
I współczyn-
X* tSwny jes t
dla
3,
V“a
D.054T ’ ' 0,029 0,019
Je^li stwierdzono^ 2e fula polarograliczna j^&t odwracalna, z wartości współ-c-wzywLnflca kierunkowego pro^tej olrzytnancj w wyniku analizy logarytmicznej można w> vrł^ii<rzły^ eJeklrojiów r uczrcstniczącycłi w rcakc/i clektrocłicmiczncj.Zgodność rco^ej w.spólczynnika »cicrunkowego, otrzymanego Jako wy»ifc analizy foguyt. *”icxfiejp zr warfoicią obliczony 2 wartoici ar, okrcślonsi z porównania granicz-
oegro /jr^c/o dyfuzyjnego badanej substancji elektroaktywnej z prądem granicznym .scfbsra/ic/7 o znanej Ucziyic elelctronów biorących ******** w reakcji chemicz-

ply przynajmniej reakcja przeoksienia ładunku |t dotlateezme szybka W podaniu i szybkością dyfuzji i cm trwania kropli. Dla stosowanych w praktyce


(Izie kJŁ - stała szybkoki procesu redoks (4.2) przy potencjale równym potencja*
iwi normalnemu,
Równania analogiczne do równania ||| można wyprowadzić dla przypadku utleniania anodowego oraz dla anodcwo-btodowej fali polarograficznej, gdy n roztworze obecna jest zarówno postać utleniona jak i postać zredukowana sub-

dukowanej I1|||
Nieodwracalne reakcje elektrodowe
1 przypadku gdy warunek (4.40) nic jest spełniony, układ redoks nic jest odwracalny polarograficznie i nie możną stosować wyprowadzonych uprzednio równań. Reakcja elektrochemiczni przebiega z dostatecznie dużą szybkością dopiero przy potencjałach znacznie oddalonych od potencjału równowagi. Fala polarograficzna jest mniej stroma i potencjał pólfali znacznie różni się od potencjału
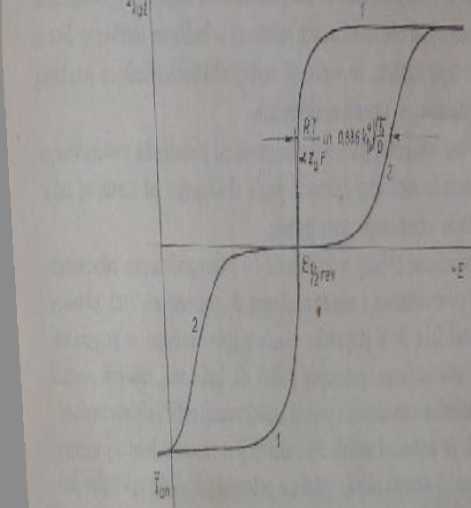
Rys. 4.1 Krzywe poluojrafbto
! - otaalnego układu redoks. Z - nieodwracalnego układu redoks; iiy-iftii postaci uilcniooej i zredukowane] w roztworze są jednakowe
formalnego (rys, 4.7), Stosunkowo skomplikowane przekształcenia prowadzą do następującego równania krzywej l-E dla układu nieodwracalnego:
(4.41)
Wyszukiwarka