P1100108
gdzie: ; * liczbą elektronów uczestniczących w reakcji o najmniejszej szybką. Iszybkuść często równa jest l), a - współczynnik przeniesienia ładunku (pr/v tr^l wancie 0,3-0,7; najczęściej 0,5), a /nac/cnie)^ wynika / równań (4.2) i (4.10); potencjałów wystarczająco odległych od £'0 równe jest /,d.
Równanie to stosuje się do redukcji katodowej w przypadku, gdy dla poten. cjałów, przy których występuje fula redukcji mota pominąć szybkość odwrotny ptoetsu - procesu utleniania (duża wartość nadnapięcia).
Z równania (4.41) wynika, żc
I. Potencja! półfali dla fali odpowiadającej układowi nieodwracalnemu {fenv jest równaniem
DT /"j
(4.42)
zatem Eilt zależy od czasu trwania kropli /,.
2' Analiza logarytn ic/na fali odpowiadającej układowi nieodwracalnemu pro. wadzi do zależności prostoliniowej, której współczynnik kierunkowy dla temp. 20*C
równy jest -rjjr* V*1. Z jego wartości, znając zv można obliczyć wartość a.
(\Q58
3. Dla potencjałów znacznie bardziej ujemnych niż El;2 prąd 1 - Iś*)lb tj. w obszarze platcau fali prąd jest określony przez dyfuzję.
Ma lo szczególnie doniosłe znaczenie analityczne, ponieważ prąd graniczny dla fal odpowiadających układom nieodwracalnym ma wymagane w analizie ilościowej własności granicznego prądu dyfuzyjnego, tj. liniową zależność od stężenia substancji elektroaktywnej, stosunkowo małą zależność od temperatury, niezależność (w określonej mierze) od obecności innych substancji w badanym roztworze. Jest to bardzo ważne z tego względu, że większość reakcji elektrochemicznych przebiega na elektrodzie rtęciowej w sposób nieodwracalny.
Również i inne wfesności, jak liniowa zależność od pierwiastka kwadratowego z wysokości zbiornika rtęci oraz zależność prądu chwilowego od czasu, są takie same jak dla prądu określonego przez dyfuzję.
Oprócz wspomnianej różnicy w nachyleniu fal polarograficznych odpowiadających układom odwracalnemu i nieodwracalnemu do rozróżnienia tych układów można wykorzystać fakt, że w przypadku układu nieodwracalnego, w przeciwieństwie do układu odwracalnego, potencjały półfali (Ha katodowej redukcji postaci utlenionej i dla utleniania anodowego postaci zredukowanej różnią się wartościami.
7 rys. 4.7 widać, że potencjał półfali dla redukcji jest znacznie bardziej ujemny niż potencjał formalny danego układu redoks, a potencjał półfali dla utleniania jest znacznie bardziej dodatni niż potencjał formalny. Często zdarza się, że jeden ze wspomnianych procesów przebiega dopiero przy potencjałach, które są nieosiągalne w polarografii.
Przełącznik Kalouska
Wspomnianą prostą metodę rozróżniania zjawisk odwracalny ch i nieodwracalnych można stosować wtedy, gdy obie postacie - zredukowana i utleniona - dają «ę spreparować i przechowywać w roztworze. Jeśli jedna z nich, np. postać zredu
kowana, jest w roztworze nietrwała, można do badania jej zastosować proste a rządzenie. lew. przełącznik Kalouska. Jeden z możliwych układów pokazany jest na rys. 4.8.
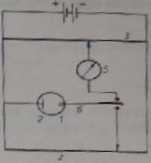
Rys. 4.8. Układ przełącznika Kalouska / — rt«viw« elektroda kroplowa. 2 — elektroda porównawcza. J — polarograf, 4 — potencjometr ponaoenfczy, 5 — rcfcstraiur prądu. 6 — przełącznik Kalouska
—1 Zj pomocą przełącznika mechanicznego 6 wskaźnikowa rtęciowa elektroda kroplowa jest przyłączona na zmianę do obwodu polarografu i do obwodu potencjometru. utrzymującego na elektrodzie taki potencjał, który zapewnia elektrolityczne wytwarzanie brakującego składnika. W naszym przypadku potencjał ten jest tak wybierany, żeby diu redukcji został osiągnięty graniczny prąd dyfuzyjny. Potencja polarografu zmienia się w laki sam sposób jak w zwykłej polarografii. Zależność potencjału rtęciowej elektrody kroplowej od czasu przedstawiono na rys. 4.9. Czę-
E
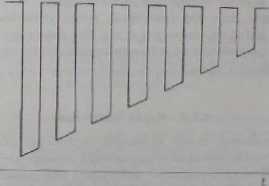
Ry«. 4.9. Przebieg napięcia polaryzacyjnego w metodzie przełącznika Kalouska
slu£ć przełączania elektrody wynosi często 50 Hz, natomiast zmiana potencjału elektrody odbywa się z szybkością ok. 0,2 V/min. Zatem występuje tu polaryzacja napięciom praktycznie prostokątnym. Do zarejestrowania elektrolitycznie wytwarzanej substancji w pólokrcsic następującym po pólokrcsic wytwarzania (półokres rejestracji) wystarczy, żeby była ona trwała w ciągu 1/50 s. Jeśli substancja ta podlega szybkim reakcjom chemicznym z wytworzeniem substancji nicelekt rouktywne j (np. z rozpuszczalnikiem lub jakimkolwiek nicelektronktywnym składnikiem rzo-
Wyszukiwarka