P1100131
une Jest wjtranic potencjału, leżącego w Śrędku przedziału b punkt a na
ry>«
*
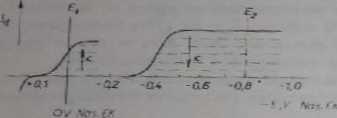
Na rysunku 8.2 przedstawiona jcsl krzywa prąd-naplęcie dla miareczkowi, jonów ołowiowych dwuchromianem. Można tu stosować dwie różne wartości po-tcncjolu. Przy potcncjulc Ex redukują się badane jony Pb2 ' oraz odczynnik miarce?, kujący OaOj~. Wysokość foli odpowiadającej redukcji jonów Pb2 + zmniejszaj aż do PJL Następnie prąd zaczyna wyrastać w wyniku redukcji nadmiaru jonów dwuchromianowych. Krzywa ma postać litery V. Jeśli do elektrody wskaźnikowe] przyłoży się potencjał £, (można to zrealizować przez spięcie kroplowej elektrod*
$
w
*

R>«. 8.2. Krzywe IE w przypadku miarcc2kou*aniz ołowiu dwuchromianem <a>: przebieg krzywej unpcioiDetryczoigo miareczkowania jonów ołowiu dwuchromianem (b) przy potencjale A, »£,; przebieg krzywej a mpcromei tycznego miareczkowania jonów ołowiu dwuchromianem przy potencjale ł:\ ■» £, (c)
f
)
rtęciowej i NEK), natężenie prądu wskaźnikowego będzie stałe do PR (rys. 8.2c), ponieważ E% < £(M n>.. Wartość prądu zacznie się zwiększać po przejściu przezPK na skutek redukcji nadmiaru jonów CraO|”.
W metodzie miareczkowania anpcroincir>'caiC80 wystarczy, żeby jedna substancja była aktywna elektrochemicznie w stosunku do elektrody wskaźnikowej (substancja badana lub czynnik miareczkujący). Jeśli substancje (substancja badani i czynnik miareczkujący) są clcktroaklywnc, a produkt reakcji jest niccleki reaktywny, uzyskuje się korzystny kształt krzywej miareczkowania (typ V). Metodę ampero-metrycznego wyznaczania punktu końcowego stosuje się w miareczkowaniu strą* centowym, kompleksometrycznym, redoks i rzadziej w miareczkowaniu nlkacy-metrycznym
Zależnie od elektrochemicznych własności reagujących substancji dla danej wartości potencjału otrzymuje się krzywe o różnych kształtach:
1. Substancja miareczkowana redukuje się na katodzie, czynnik miareczkujący jest /licclektroaktywny, a produkt reakcji jest trudno rozpuszczalny Przykłady: miareczkowanie jonów Pb3* jonami SOj", jonów Cu3* kupfeccnan rtd. Uzyskujo się krzywą typu \ (patrz rys. 8. Ib).
2. Substancja miareczkowana jest nieelektroaktywna, czynnik miareczkujący redukuje się na katodzie, a produkt jest trudno rozpuszczalny. Uzyskuje się krzywą typu Przykłady: miareczkowanie jonów SOJ" jonami Pb1* lob jonów Pb1* jonami CrjOj”, jedli Ek «* fc', (patrz rys. 8.2c).
3. Zarówno substancja miareczkowana jak i odczynnik miareczkujący rtdir kują się na katodzie, podczas gdy produkt reakcji jest nieelcktroaktywny. Uzyskuje się krzywą typu V. Przykłady: miareczkowanie jonów Pb2* jenami CfjOj" przy potencjale Ą » Ą (patrz rys. S.2b) jonów Cr202" jonami Pb2', jonów Si** dwuractylogłioksymem przy E -1,85 V.
4. Substancja miareczkowana utlenia się na anodzie, a czynnik miareczkujący redukuje się na katodzie. Krzywa ma kształt pokazany na rys. 8.3a. Przykład: miareczkowanie jonów W* jonami Fe2*.
Ml Ptomi
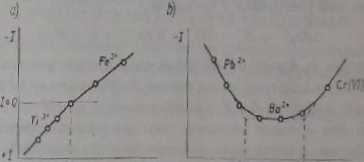
Ryl 9.3. Knrjrua miareczkowania Ti* * jonami żelazowymi ta): krzywa ouareczkowanu dwóch składników występujących obok siebie (Pb2' i Bu2*) duonnjnciD potasu (b)
5. Na rysunku 8.3b pokazany jest przykład miareczkowania dwóch składników obok siebie. Jest to mieszanina jonów Pba+ i Ba2*, które miareczkowane są roztworem chromianu potasu przy stałym napięciu 1,0 V. Oznaczenie oparte jest na niejednakowej rozpuszczalności chromianu ołowiawego i chromianu baru. Jako pierwsze miareczkowane są jony ołowiawe; w wyniku czego natężenie prądu zmniejsza się. Następnie miareczkowane są jony baru i natężenie prądu zachowuje sutą wartość, ponieważ wybrany potencjał elektrody wskaźnikowej jest niższy niż potencjał1} edpowiudujący prądowi granicznemu jonów Ba2t (jony Ba2* nic redukują się przy tym potencjale). Po PR wzrasta natężenie prądu dyfuzyjnego jonów chromianowych.
6. Substancja miareczkowana przy wybranej wartości potencjału jest nieaktywna elektrochemicznie w stosunku do elektrody Pt, a czynnik miareczkujący utlenia się na elektrodzie. Do PR natężenie prądu pozostaje niezmienne a następnie
“ Chodzi io o wartość bemckdną pouiujata - przyp ihim.
Wyszukiwarka