P1100136
9. ELEKTROANALIZA I KULOMETRIA
9.1. WSTĘP
Pod.4law^ obu metod j«*r proces elektrolizy. Przez elektrolizę rozumie się ■‘‘ózfćłąd elektrolitu poci wpływem prjjdu stciego przepływającego przez cieki roli zer Pojęcie efektroliza obejmuje:
1) wloidwjł reakcję cfcktrochemicnuł związani^ z przeniesieniem ładunku,
2) reakcje cBemiczne przebiegające w pobliżu elektrody,
3) transport substancji do i od powierzchni elektrody.
Prawa Faradaya (ł£34 r.) wyraiają następujące zalcżnoki pomiędzy dostarczonym ładunkiem elektrycznym i ilością substancji, która uległa przekształceniu efekt rochc miczocm u :
J) Jiotó substancji, która uczestniczyła w reakcji elektrochemicznej jest propor-c/onalna do wielkości iadunku przepływającego przez roztwór.
2) ilości równych substancji. kf óre uległy elcktracbemiczncmu przekształceniu pod wpływem ładunku są jednakowe; do elektrocłiemiczitcso przcksztnłce-
o»a I mol substancji potrzebny jest ładunek
z (96486, 70=fc 0,5) A - s
Z połączenia obydwu praw otrzymuje się ogólne prawo Faradaya
lub
m
M
zF
A/
(9,2)
®dzier ^ = f Jdt — ładunek, który przepłynął przez elekt rolizer, A -s, m — masa, 4/ | Mife-
masa molowa, współczynnik proporcjonalności
F «= 96486.70^0,5
21 równania (9.1) można określić natężenie prądu
drt
(9.3)
y
df
zF
d/
(9.4)
—- strumień elektroaktylnej substancji lub rzeerywista szybkość elektrolity.
M*rzy elektrolizie stosuje się takie warlośd potencjału, dla których szybkość reakcji przeniesienia ładunku ma dużą wartość. Szybkość elektrolizy określona jest zatem jedynie szybkością dyfuzji, migracji i konwekcji.
9.2. ELEKTROLIZA PRZY STAŁYM PRĄDZIE I ELEKTROLIZA PRZY STAŁYM POTENCJALE
Przebieg procesu elektrolizy mołaa obrazowo przedstawić /a pomocą Krzywych prąd-napięcie. Na rys. 9.1 przedstawiono krzywe prąd-napięcic dla poszczególnych siadióy. elektrolizy. Podczas elekt roi izy zmniejsza się natężenie prądu granicznego i zmienia się potencjał £,0* (podczas procesu elektro redukcji potencja! przesuwa się w kierunku bardziej ujemnych wnTtołci, natomiast podczas procesu elektrouilcnia-uia — w kierunku wartości bardziej dodatnich). Zmiana potencjału pracy jest wyraźna wówczas, gdy elektrolizę prowadzi się prądem o stałym natężeniu lc. Jak widać z rys. 9.1. potencjał elektrody pracującej zmienia się wówczas cd wartości £,
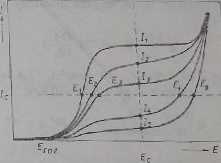
Rys. 9.1. Wykres potencjału (£,-£,) elektrody pracującej podczas elektrolizy prowadzonej prądem stałym /c oraz wykres zmian prądu elektrolizy (/, — /») podczas elektrolizy przy stałym
potencjale £«
do E2, E3 ilU. Gdy natężenie prądu granicznego spadnie poniżej wartości potencjał elektrody pracującej zmieni się skokowo, osiągając wartość E4 i na elektrodzie zacznie przebiegać inna reakcja elektrochemiczna (na przykład elektroliza rozpuszczalnika). Ta zmiana potencjału pracy elektrody utrudnia rozdzielenie kationów ze zbliżonymi potencjałami rozkładu. Jednym ze sposobów zapobiegania jednoczesnej elekiroredukcji lub jednoczesnego elcktrcutlcr i iia kilku pierwiastków jest utrzymywanie podczas elektrolizy stałego potencjału elektrody pracującej. Z ryś, 9.1 widać, że w czasie elektrolizy prąd elektrolityczny po pewnym czasie osiąga bardzo małą wartość. Dla liniowej dyfuzji i stałej grubości warstwy dyfuzyjnej 50 można na podstawie równania (9.4) wyprowadzić następującą zależność dla granicznego prądu elektrolitycznego:
gdzie: I0 =* - prąd w czasie ł «* O, k = ,
A — powierzchnia elektrody, V — objętość roztworu, c — stężenie w czasie t — 0.
Zatem wartość prądu zmniejsza się ckspotencjalnie z entsetn. Szybkość elektrolizy można zwiększyć, zwiększając powierzchnię elektrody A i energicznie miewając
145
Wyszukiwarka