P1100137
roztwór (*mufeisai się wartość ó0) Całkowity ładunek zużyty podczas elektrolizy
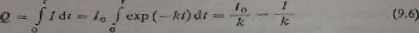
X>3a r - oc

Parametry /„ i Ar można wyznaczyć przy pomocy analizy logarytmicznej rów-

Czas trwania elektrolizy oblicza się z równania (9.8), które można napisać także w innej postaci (z uwagi na to, że prąd graniczny jest proporcjonalny do stężenia)

(9.9)
Dla V * 2U0 c:n\ 60 - 2 10"J cm, D = lO
rym proces elektrolizy przebiegnie w 99,9% (ar ■ 0.999)
— 100 cmł, czas, w któ-

= 2,8-10* s
47 min
i
Na elektrodzie pracującej oprócz głównej reakcji elektrochemicznej przebiegają często inne reakcje uboczne. Całkowity ładunek elektryczny /użyty w czasie elektrolizy odpowiada zatem sumarycznej ilości wszystkich składników roztworu przekształcanych elektrochemicznie. Prąd związany zc śladowymi ilościami zunic-czyszczeń, występujących w elektrolicie podstawowym, nazywany jest prądem
szczątkowym łub prądem łfa (np. redukcja tlenu rozpuszczonego w roztworze).
Oprócz zanieczyszczeń mogą utleniać się lub redukować niektóre spośród głównych składników roztworu, jak np. H*, OH", cząsteczki wody, składniki układu buforowego Jub inne substancje, w obecności których oznacza się badaną substancję. Na podstawie diagramu obszaru występowania dla wody i jej jonów (rys. 9.2) można określić obszar termodynamicznej trwałości wody. W rzeczywistości obszar ten jest większy w wyniku nodnapięda wodoru i tlenu. Warunki prowadzenia elektrolizy należy wybierać tak, żeby potencjał pracy leża! w obszarze trwałości wody, a elektrody powinny charakteryzować się wysokim nadnapięcicm dla reakcji przeszkadzających.
Pr/y wystatczająco dużych wartościach potencjału, zwłaszcza w obecności substancji kompleksu twórczych, elektrody przestają być obojętne i same się ullo-nrftfą.
Szczególny przypadek stanowią reakcje przeszkadzające, indukowane produktem elektrolizy, który wchodzi w reakcje chemiczne, tworząc nowe substancje
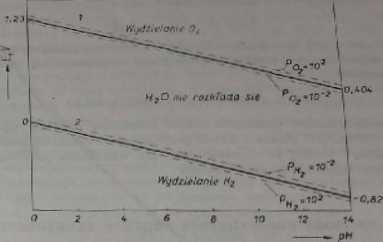
Rys, 9.2. Diagram obszarów występowania dla wody / — Ł\ — 1^3-0,059 pH (KORlycniy potencial utleniania HsO i Dli"), 2 - B, - — O.OS9 pH (teoretyczny potencjał redukcji
H,0 I H*>
elekłroaktywne. Ze zjawiskiem tym związany jest kinetyczny prąd szczątkowy i indukowany prąd szczątkowy.
Do grupy reakcji przeszkadzających można zaliczyć niektóre reakcje przebiegające na elektrodzie pomocniczej. Powstające produkty mogą dyfunować do elektrody pracującej, zakłócając proces elektrolizy. Na przykład w obecności chlorków elektroda platynowa rozpuszcza się, produkty rozpuszczania dyfundują do katody i na katodzie może wydzielać się platyna. Reakcje przeszkadzające tego typu można wyeliminować w dwojaki sposób:
1. Przez oddzielenie elektrody pomocniczej od elektrody pracującej /a pomocą odpowiedniej diafragmy lub styku cieczowego (elektro! i zer z przenoszeniem).
2. Przez dodatek odpowiedniej substancji elektroaktywnej (dcpohuyzatora). która łatwiej ulega reakcji na elektrodzie pomocniczej niż składnik przeszkadzający.
Ta pomocnicza substancja clcktroaktywnu utrzymuje zatem potencjał elektrody pomocniczej na żądanej wartości (elektrolizcr bez przenoszenia). W charakterze depolaryzatorów anodowych stosuje się substancje redukujące (odwrotnie) np. hydrazynę i hydroksyloaminę, zwłaszcza w środowisku kwasu solnego, w który™ w?~ mienione depotaryzatory uniemożliwiają wydzielanie wodoru na anodzie platynowej. Utlenianie jonu hydrazoniowego przebiega z wydajnością 100%
N*Ha* - 4«“ = N* + 5H* (9.I0>
Anodowemu wydzielaniu tlenu oraz powstawaniu kwasu na anodzie platynowej
2H*0 - 4#- = Oa + 4H* (9.11)
przy kułometrycznym miareczkowaniu alkac> metrycznym można zapobiec przez zastosowanie elektrody srebrnej i środowiska bromkowego.
14T
Wyszukiwarka