P1100138
W wynikli anodowego utleniania srebra
AS + Br~ -e“ - Ag Br (9.12)
powstaje AgBr, który tworzy rfa elektrodzie trudno rozpuszczalną powłokę.
Jako depoJar>’2oJor katodowy wpobiegąją^ wydzielaniu się wodoru stosuje się kwas azotowy
NOr -*■ lOH* f 8ff
NTr; 3H20
<9.13)
W grawimetrycznym oznaczaniu miedzi metaliczna powłoka, wydzielona z« środowiska HN03, jest gładka i dobrze przylegająca. Powłoki wydzielone ze ir«>-dowiska HzS04 i HCIOj są szorstkie w wyniku wydzielania gazowego wodoru, który pogarsza fiz>C7iie własności powłoki.
9.4. SPOSOBY PROWADZENIA PROCESL' O.EKTROI.IZY
Biorąc pod uwagę technikę pracy rozróżnia się
1) elektrolizę przy stałym (kontrolowanym) potencjale,
2) elektrolizę przy starym prądzie.
3) elektrolizę wewnętrzną.
Podstawowe obwody dla pierwszy ch dwu technik przedstawiono n« rys. 9.3 i 9.4.
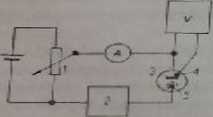
Rys. 9.3. Elektroliza przy stałym potencjale i — potencjometr, 2 — Jtulomccr, 3 — elektroda pracująca, 4 — elektroda porównawcza, 5 — elektroda pomocnicza A — amperomierz, V — woltomierz
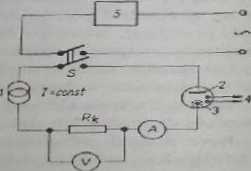
Ryz. 9.4. Elektroliza przy stałym natężaniu prądu
1 — źródło prądu stałego. 2 — elektroda pracująca, 3 — elektroda pomocnicza,
4 — obwód wskaźnikowy, 5 — czasomierz, /Iz — opornik wzorcowy
W przypadku elektrolizy* przy stałym potencjale (rys. 9.3), potencjał elektrody pracującej kontrolowany jest względem elektrody porównawczej za pomocą woltomierza i regulowany potencjometrem. Elektroda pomocnicza zwykle oddzielona jest od badanego roztworu za pomocą diMfntgmy. W pomiarach kulometrycznych nie waży się wydzielonych produktów elektrolizy, lecz do obwodu przyłącza się kulo-metr, za pomocą którego określa się całkowity ładunek potrzebny do elektrochemia eznego przekształcenia substancji badanej.
W przypadku elektrolizy prowadzonej prądem o Małym natężeniu (rys. 9.4). do naczyńka elektrolitycznego przyłącza się źródło prądu stałego. Prąd płynący w obwodzie mierzy się amperomierzem lub (dokładniej) określa się ze spadku napięcia nu wzorcowym oporniku. Dokładną wartość natężenia prądu trzeba znać jedynie w przypudku pomiarów kulometrycznych. Ponieważ przy oznaczeniach kulo-metrycznych niezbędna jest również dokładna znajomość czasu, do obwodu pomiarowego przyłącza się zegar elektryczny. W miareczkowaniu kulornctrycznym oprócz elektrod pracującej i pomocniczej wymagany jest obwód wskaźnikowy.
Oprócz wspomnianych sposobów prowadzenia procesu elektrolizy stosowana jest również elektroliza wewnętrzna, przy której właściwy proces elektrolityczny przebiega bez pomocy zewnętrznego napięcia. Do badanego elektrolitu wprowadza się odpowiednie elektrody, w wyniku czego powstaje ogniwo galwaniczne. Po spięciu elektrod (ewentualnie przez odpowiedni opornik) ogniwo wyładowuje się, tj. przebiega elektroliza wewnętrzna aż do momentu wytworzenia się stanu równowagi, w którym £, - E2. Na przykład po spięciu elektrod ogniwa
Zn | ZnSOJjCu*ł i Pt (9.14)
na katodzie platynowej wydziela się miedź zgodnie z reakcją
Zn + Cu2+ - Zn** + Cu (9.15)
95. ELEKTROGRAWIMETRIA
Elektrograwimetria stosowana jest w analizie różnych stopów metalicznych, jak brąz, mosiądz, stopy łożyskowe itp. Metodą elektrolizy przy kontrolowanym potencjale elektrody pracującej można oznaczać obok siebie Cu, Bi, Pb, Sn łub Pb, Cd, Zn, itp.
95.1. Strefa wydzielania
Przy wydzielaniu i oddzielaniu metali bierze się pod uwagę nie tylko ich początkowy, ale także i końcowy potencjał wydzielania. Różnica pomiędzy potencjałami rozkłada - początkowym Ł\ i końcowym Fk - nazywana jest strefy wydzielania Z, przy czym
z-vĄ--jjrbJ. M
Dla 99,99% wydzielenia i z - I, i - 25°C
Z = 0,24 V i dla z =» 2 Z * 0,12 V
Dla ilościowej elekt roredukcji jcdnowartościowego jonu metalu, który tworzy układ odwracalny, wystarczy zatem, żeby potencjał pracy był co najmniej o 0.2 V bardziej ujemny niż potencjał rozkładu.
Wyszukiwarka