P1100141
>waov

Kył. 9.6. Kułomeiria potem^osiAlycxna C — kuJwnctr, v — woltomierz. — amperomierz / — elektroda pracitf^ca. 2 — elektroda porAwnawcu’
J — dek troci u pomocnicza
oznaczanie Kompleksem* na anodzie rtęciowej
Hg -r YAT — HgY2“ <9 18)
o/Tuc^jnic kationów metali Ma go Hg/HgY*-
HgYa " + M3 f + 2r
w obecności układu clcktrouktywne-
(9.19)
Hg + MYł" -
9.7-2- Koloarlria przy stałym prądzie
Kulcmctria przy stałym prądzie I realizowana jest w taki sam sposób jak elektroliza przy stałym prądzie.
Równanie (9.6) przyjmuje w tym przypadku prostszą postać
(9.20)
Q - //
Zastosowanie procesu elektrolizy prowadzonego prądem o stałym należeniu do oznaczania badanej substancji uwarunkowane jest obecnością tzw. układu pomocniczego w postaci substancji znajdującej się w roztworze w doslatccznio dużym stężeniu, która biorąc udział w reakcji elektrodowej, wytwarza produkt — czynnik miareczkujący. Czynnik ten, reaguje z oznaczaną substancją stechiometrycznie i ilościowo 11. Potencjał elektrody pracującej stabilizowany jest reakcją elektrochemiczną. W reakcji tej powstaje czynnik miareczkujący. W porównaniu z kulometrią przy stałym potencjale omawiana metoda ma tę zaletę, 2e stosunkowo łatwo jest znaleźć dla niej optymalne warunki, w których otrzymuje się wydajność prądową 100% lab wydajność miareczkowania 100%,
Zasadę miareczkowania kulomctrycznego możno wyjaśnić korzystając z krzywych prąd-napięcic. Na rys. 9.7 przedstawione są krzywe prąd-napięcic dla poszczególnych stadiów miareczkowania kulometrycznego jonów Fc2+ jonami Cc4*, wytwarzanymi elektrolitycznie z soli cerawcj (układ pomocniczy). Nu początku elektrolizy, tj. dla x == O, przebieg krzywej prąd-napięcie określony jest tylko przez
*> Metodę fculometrii przy stałym prądzie można wykorzystywać także do bezpośredniego oznaczania substancji dckrro&ktywaych. W cen sposób można oznaczać np. chlorek srebra. ciekzrol:żując roztwór, który jest w równowadze z osadem AgCI oraz metale i tlenki metali, osadzone na elektrodzie pracującej — przyp. dum.
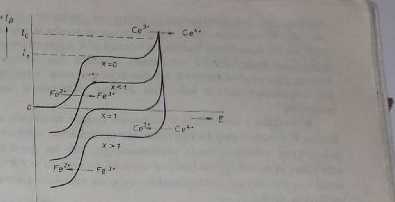
Rył. 9.7. Krzywo dla kulomctrycznego miareczkowania stelaża dwuwanokiowogo solą cerową
utlenianie Żelazn dwuwartościowcgo i układu pomocniczego (Cest). Na rysunku widać, Że dla / " /, przebiegają dwie reakcje elektrochemiczne
1. Fe2+ - e~ -> Fea+ (prąd /i)1 Q2X)
2. Cc3* — tt~ -* Ce** (prąd•"/*—/4) (9.22)
Ce4+ + Fe*+ ^Fc3+ + Cea* P23)
Jony cerowe, powstające w wyniku reakcji elektrochemicznej, są zużywane w następczej reakcji chemicznej (9.23) i w związku z tym wypadkowa reakcja clck-t rodowa przebiega zgodnie z równaniem (9.21). Pcdczas elektrolizy* anodowa fala żelaza przechodzi w falę katodową — przejściowo występuje fala anodowo-kato-dowa. Udział procesu utleniania soli cerawej do cerowej w sumarycznym procesie elekt rodowym stale zwiększa się. przy czym powstające jony Ce*’ utleniają Fc2* do Fe3+, zgodnie z równaniem (9.23) (składowa prądu /, zmniejsza się). Tak więc W obecności soli cerawej, utlenianie dwuwartościowego żelaza przebiega z wydajnością 100%. W PR („y — 1) przebieg krzywej prąd-napięcie określony jest przez fale redukcji żelaza, podczas gdy odcinek anodowy krzywej nie zmienia się już i odzwierciedla utlenianie Ce31 do Ce*'. Po przejściu PR (x > 1) w roztworze znajduje się nadmiar odczynnika miareczkującego, tj. soli cerowej.
Na przykład olefiny można oznaczać tylko pośrednio, ponieważ są nieelcktro-nktywne.
Olefiny miareczkuje się bromem wytwarzanym elektrolitycznie
2Br" - ir -* Bra WM.
Następcza reakcja chemiczna przebiega zgodnie z równaniem
R2Cr-CRa + Bra -* RaBrC-CBrRa l9-25^
Sumaryczna reakcja elektrodowa ma następujący przebieg:
RaC«CR2 + 2Br“ - 2e" -» RaBrC-CBrRa (9.26)
Podstawowy obwód, stosowany w pomiarach kulomctrycznych przy stałym prądzie przedstawiono na rys. 9.4. Źródłem prądu stałego może być amperostat
15S
Wyszukiwarka