P1100169
i
i
P
O
H
«
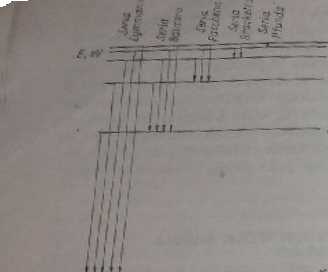
Rys. 16.2. Schemat powstawania serii linii
--r ----- ^ v w
K spektralnych atomu wodoru
chodzi. Różnym przejściom m -* n odpowiadają więc różne częstości, które razem tworzą widmo atomowe danego pierwiastka. Wszystkie przejścia elektronów z różnych wyższych poziomów m na jeden i ten sam poziom n dają różne linie jednej serii.
Podobną budowę widma do widma wodoru mają również, liiowce i jednowar-tościowe jony wapniowców (Mg*, Ca+).
W rzeczywistości budowa poziomów elektronowych jest bardziej złożona nil to wynika z teorii Bohra. Według teorii kwantowej energetyczny stan cieklionu na różnych poziomach można sebarokteryzow ać czterema następującymi liczbami kwantowymi:
n — główną liczbą kwantową (zmienia się w zakresie 1- oo),
/ — poboczną liczbą kwantową (może przyjmować wartości 0, 1, 2,.... «-l, które oznacza się symbolami s. p, d,fy...), m — magnetyczną liczbą kwantową (m ■ -1 do +1),

niekiedy stosuje się jeszcze wewnętrzną liczbę kwantową J, która charakteryzuje całkowity moment pędu elektronu
J -
(16.3)
Według zasady wyłączności Pa uli ego w atomie nie może być jednocześnie dwóch elektronów, które miałyby wszystkie liczby kwantowe jednakowe, a tym samym jednakową energię. A więc w atoniach o większej liczbie elektronów każdy orbilal może być obsadzony maksymalnie przez dwa elektrony o przeciwnych spinach, czym się tłumaczy tak dużą różnorodność energetycznych poziomów i podpozjomów.
Tej dużej liczbie energetycznych poziomów musiałaby odpowiadać równic ogromna liczba linii spektralnych. W rzeczywistości ich liczba jest ograniczona, ponieważ elektronowe przejścia nie mogą przebiegać samorzutnie z dowolnego
poziomu wyższego na niższy poziom wolny. Dozwolone są tylko niektóre przejścia okolone uw. regułą wyboru.
A więc przcjśdc elektronu jest możliwe, kiedy są spełnione następujące wanmki:
1. Główna liczba kwantowa może się zmieniać dowolnie.
2. Poboczna (orbitalna) liczba kwantowa może się zmieniać o jeduostkę, M = ±\, Nu przykład są dozwolone tylko przejścia s -* p. p -* s. p -* d, p i tym podobne.
3. Wewnętrzna liczba kwantowa może się zmieniać o jednostkę, albo może pozostać niezmieniona, A/ » ±1,0 (niedozwoicnc są przejścia joO-jtO).
Zc zwiększeniem liczby elektronów walencyjnych zwiększa się również wzajemny wpływ elektrycznych i magnetycznych pól elektronów oraz jądra atomowego, zwiększa się także liczba przejść i widma stają się bardziej złożone. Dlatego dla pierwiastków uporządkowanych w wkładzie okresowym złożoność widma zwiększa się z lewej strony do prawej. |
Do przejścia elektronu na pewien wyższy poziom jest potrzebo określona energia zwana energią wzbudzenia, albo potencjałem wzbudzenia, wyrażona najczęściej w cV. Jest także oczywiste, że im wyższe są wzbudzone poziomy energetycenc. rym większa energia jest potrzebna do przeskoku elektronu. Tym setnym prawdopodobieństwo takiego przejścia jest mniejsze i spada także intensywność odpowiadających mu linii spektralnych.
Najintensywniejsze linie powstają więc przy przejściach między poziomami energetycznymi z najmniejszą różnicą energii, zwłaszcza między podstawowym poziomem i najbliższym wyższym, z którego elektron może przy emisji jednoznacznie przejść tylko na poziom podstawowy. Linie spektralne odpowiadające takim przejściom nazywają się rezonansowymi albo ostatnimi. Są to zwykle linie charakterystyczne, które są używane w emisyjnej analizie spektralnej do wykrywania pierwiastków.
Jeżeli energia wzbudzenia jest tak duża, żc elektron opuści atom, zachodzi jonizacja, a powstający jon będzie sic zachowywał optycznie jak a:om z liczbą atomową o jednostkę mniejszą. Również widmo takiego jonu będzie podobne do widma obojętnego atomu o liczbie atomowej Z-l z tą tylko różnicą, że jego liniowe widmo będzie przesunięte w kierunku fal krótszych, ponieważ energia wiązania elektronu optycznego z jądrem jest większa.
Linie spektralne, które odpowiadają wzbudzonym atomom obojętnym nazywa się liniami atomowymi (przeważają szczególnie przy wzbudzeniu w luku elektrycznym), a linie odpowiadające atomom zjonizowanym nazywa się Umiani jonowym. Występują one głównie w źródłach ze wzbudzeniem iskrowym, ponieważ takie źródła w porównaniu / lukiem elektrycznym są energetycznie bogatsze.
16.3. WZBUDZENIE EMISYJNYCH WIDM ATOMOWYCH Wzbudzenie atomowych widm emisyjnych, jak już wykazano, zachodzi w środowisku gazowym, które musi być doprowadzone co najmniej do takiej temperatury, aby średnia energia kinetyczna cząstek osiągała minimalne poziomy energii wzbu-
209
M nijmM metody
Wyszukiwarka