P1100184
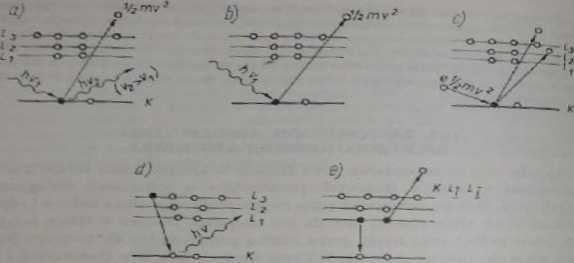
Rys. 19.1. Schcinac wzbudzenia atomu;a. b) fotonem, c) elektronem, d) atom wzbudzony pn*. caod/i aa niłszy poziom energetyczny, wypromieniowując kwant y (charakterystyczne promie* niowanic). e) lab wskutek przejścia Augera

Podczas jonizacji atomu w powłoce wewnętrznej przejściu elektronu do niższe. 80 sianu energetycznego towarzyszy bądź emisja charakterystycznego promieniu-wonią rentgenowskiego {rys. 19.Id), bądź przejście bezrudiacyjnc (rys. 19.1c) w procesie którego jest emitowany elektron z powstaniem atomu dwukrotnie zjo* nizowanego. Tak powstające elektrony nazywamy elektronami Augera od franctu-kiego fizyka Augera. który je odkrył w 1925 r.
Na procesach przedstawionych na rys. 19.1 opiera się kilka metod eksperymentalnych. Najważniejsze z nich są:
1. Rentgenowska spektrometria fluorescencyjna (schematy a, b, d). Do wzbudzenia stosuje się promieniowanie rentgenowskie i mierzy się widmo elektronowe.
2. Spektrometria Augera (schematy a. b. e). Nu próbkę działa się promieniowaniem rentgenowskim i mierzy się widmo elektronowe.
3. Mikroanaliza rentgenowska lub inaczej mikrosonda elektronowa (schematy c. d). Do wzbudzenia stosuje się strumień wysokoenergetycznych elektronów, mierzy się głównie widmo emitowanego promieniowania rentgenowskiego.
4. Spektrometria rentgenoelektronowa (czyli fotoc lek tronowa) (schemat b. niekiedy też c). Próbka wzbudzona promieniowaniem rentgenowskim wydziela elektrony o różnej energii, które są rejestrowane.
5. Rentgenowska spektrometria absorpcyjna. Mierzy się widmo niezaabsorbo-wanego promieniowania rentgenowskiego.
6. Na zupełnie innych zasadach opiera się grupa metod dyfrakcyjnych, w których wykorzystuje się zjawisko dyfrakcji promieniowania elektromagnetycznego na krysztale. Jeżeli takim promieniowaniem są promienie rentgenowskie, będą to rentgenowskie metody dyfrakcyjne. Jeżeli na kryształ <l/i:ila się wiązką elektronów, będzie to dyfrakcja elektronów. Analityczne zastosowanie dyfrakcji elektronów jest małe, dlatego w dalszym tekście omawiana jest tylko dyfrakcja rentgenowska.
19.2. PROMIENIOWANIE RENTGENOWSKIE 1 JEGO WŁASNOŚCI
Promieniowanie rentgenowskie tq to fale elektromagnetyczne o dtugcici 10"*--10' nm. Do celów anali/.y chemicznej stosuje się promieniowanie o długości fal 0,01 nm i powyżej.
W starszej literaturze długości fal promieniowania rrclgenówtkiego podaje tą w jednostkach X (definiowanych jako I/2S1400 sBędzypłauczymowcj odległości (200) NaCl w temp. !8fQ.
Zależność między nm i X jest następująca:
2*x- 1,00202 Aa - 0,100202 *«, (19.1)
Energia £ jest zależna od X, ewentualnie od v (str. 180). Do celów praktycznych do przeliczenia A na cV stosuje się zależność
A-1240IE (19 J)
przy czym X jest w nm, a £ w clcktronowoltach.
Zastosowanie promieniowania rentgenowskiego do celów chemicznych, ewentualnie analitycznych, jest związane z tym, te
1) energia emitowanego promieniowania rentgenowskiego zalety przede wszystkim od liczby protonów,
2) na energię emitowanego promieniowania ma wpływ stopień utlenienia atomu i jego stan fizykochemiczny,
3) promieniowanie rentgenowskie ulega dyfrakcji na kryształach.
19.2.1. Powstawanie promieniowania rentgenowskiego
Widmo rentgenowskie zawiera dwa składniki — widmo charakterystyczne i ciągłe. Ciągła część widma powstaje w wyniku hamowania elektronów na atoniach. Rozpędzony elektron traci całą albo część energii kinetycznej w wyniku oddziaływania z jądrami atomów. Najmniejsza, tzw. progowa energia widma ciągłego (rys. 19.2), nie zalety od rodzaju atomu. Odpowiada to sytuacji, kiedy cała energia kinetyczna, którą elektron otrzymał przy przejściu w polu elektrycznym o napięciu V (w woltach) została użyta na powstanie fotonu
(19.3)
przy czym E wyrażone jest w elektronowoltach.
Intensywność widma ciągłego przy określonej długości fali lA wyraża równanie
. oZ ( 1 1 \
*/+
(19.4)
bZ*
A*“ gdzie: Z — liczba atomowa pierwiastka, — progowa długość fali promieni© Wania rentgenowskiego, a i b - stałe.
Charakterystyczne promieniowanie powstaje w dwóch stadiach. Najpierw wzbudza się elektron, a bezpośrednio potem (za 10~U-10~14 s) następuje rekom binacja elektronów. W pierwszym stadium energia jest absorbowana, a w drugim -
Wyszukiwarka