P1100203
okresowa może być opisana za pośrednictwem szeregów Fouriera. Dla VQ«to4d elektronowej Q (jr, y, z) można napisać
ł"« »■« l"«B
f ^ F (ft, k, i) cxp [ — 2icf {hx + ky -|- fc)J
»*-«• !»-««
(1«5)
Można również wykazać, źc trójwymiarowe sumowanie obejmuję wskabald Millera od — co do =o praktycznie od maksymalnych do minimalnych wartości A, k, /. Człony F{h. Ar,/) w równaniu są wartościami otrzymanymi eksperymentalnie (proporcjonalnymi do zaczernienia refleksów na zdjęciach Wić&senbcrg*. rys. 19.27). Jednak z doświadczeń otrzymuje się tylko absolutne wartości F(h,*, ty Symbole x,y, r są wspótrzędnynii punktu, w którym jest obliczana gęstość elek. ironown.
W ostatnim czasie, kiedy do dyspozycji są maszyny ma tematyczne* rozwiązanie równania (19.25) nie jest trudne. Bez maszyn matematycznych obliczenia dla ogólnego przypadku są zbyt uciążliwe. Trzeba obliczyć wartość funkcji aż w 10* punktach, a samo sumowanie dotyczy kilku tysięcy F(/t, k, /).
Cały problem wyznaczenia struktury* krystalicznej polega jednak na tym, te do gumowania trzeba włączyć człony F(h. k, /), tzw. współczynniki strukturalne z określonym oznakowaniem i w ogólnym przypadku z tzw. fazą.
Wyznaczenie struktury krystalicznej trwa na stanowiskach pracy z techniką nowoczesną kilka miesięcy, analiza strukturalna staje się powszechną metodą w laboratoriach chemicznych.
Wyniki tej metody (odległości międzyatomowc uzyskuje się ze średnimi odchyleniami rzędu 10“J -I0”4 mm) służą jako kryterium prawdziwości pojęć chemii kwantowej, są podstawą dla badań wiązań chemicznych w substancjach i dla poszerzenia znajomości danych strukturalnych.
Jednocześnie osiągana dokładność w wyznaczonej gęstości elektronów między atomami jest na granicy tych wartości, które są wynikiem wiązania chcraiczacge, ij. dotyczących elektronów walencyjnych.
Analiza strukturalna daje informacje o liczbie elektronów w tych cząstkach, które tworzą kryształ. Przy jej pomocy można oznaczyć względną masę cząsteczkową, wnioskować o jakości atomów w krysztale, o izomorficznie związanych n-nicczyszczeniach i jest (z wyjątkiem pozostałych metod dyfrakcyjnych) jedyną metodą, która daje pełne informacje o strukturze krystalicznej substancji.
20. ABSORPCYJNA ANALIZA SPEKTRALNA W ZAKRESIE NADFIOLETOWYM I WIDZIALNYM
20.1. ZASADA
Podstawą absorpcyjnych metod spektralnych jest absorpcja promieniowania przez próbkę. Ponieważ chodzi o absorpcję promieniowania przez cząsteczki, rozważana metoda nazywa się spektroskopią cząsteczkową (molekularną). W zakresie
podczerwieni promieniowanie jc« absorbowane przez «wągte»lti przy przejściu z nituego stanu oscylacyjnego lub oscylncyjno-rutacyjcego na wyższy. W zakresie nadfioletowym i widzialnym absorpcja promieniowania jest związana z przejściem z nitucco stanu elektronowego na wyhzy (r>i. 20.1). W rozdziale tym będą omó-
2
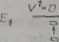
t
1 ~T
T
Pojiou/u
osryiacyjn*
t

s Pojtcmy refoą|i*W
fnrrę»i wibudtemo ' sta/nt e/t)<trcnc<*tqo
1
3
2

etanu a sktronc&ep
Ry». 20.1. Oscylacyjne I rptacyjne stany odpowiadające stanom elektronowym £j» i E9 trzy wykazane przejścia 0 -* 0, 0 -• 1.0-4 2 wyjaśniają oscylacyjna strukturą pasma. V - oscylacyjne liczby kwantowe, J — rotacyjne liczby kwantowe
wionę zagadnienia dotyczące absorpcyjnej analizy spektralnej w u idfiolecic i części widzialnej.
Oprócz zastosowania analitycznego omawiana metoda może służyć również do
Absorpcyjną analizę spektralną można uważać za jedną z najczęściej używanych metod analitycznych ze względu na jej dokładność, szybkość i prostotę aparatury.
badania struktury związków organicznych lub nieorganicznych.
Widma promieniowania nadfioletowego i widzialnego nazywają się widmami elektronowymi, ponieważ wskutek absorpcji promieniowania przez badimą próbkę dochodzi do przemieszczenia elektronów w cząsteczce. Na widmo elektronowe w mniejszym stopniu wpływają zmiany poziomów oscylacyjnych i rotacyjnych czą-
277
Wyszukiwarka