P1100223
absorpcyjnego widma. Po nbsorpcji wszystkie c/ąstcczki, których energia jest od najniższego poziomu oscylacyjnego (u =* 0) wzbudzonego stanu elektronem go Su szybko tracą energię, nie emitując kwantu promieniowaniu i przechodzą ?4 poziom energetyczny odpowiadający najniższemu poziomowi oscylacyjnemu v% dzocego stanu St (rys. 21.1, proces B). Tego rodzaju rozproszenie nadmiaru e&agj oscylacyjnej - relaksacja oscylacji trwająca mniej więcej 10'11 s, może polegać* przeniesienia energii w zderzeniach cząsteczek, lub zmianie energii innych caybcj lub rotacji tej samej cząsteczki. Prawdopodobieństwo przejściu cząsteczki z podsą. wowego stanu oscylacyjnego (e — 0) wzbudzonego stanu elektronowego 5. *> podstawowego stanu SQ z emisją kwantu fluorescencyjnego jest największe. §|$$g takie na różne poziomy oscylacyjne (a także rotacyjne) stanu podstawowy trwa I0~,-I0'4s (rys. 21 A, proces F). Proces ten oczywiście nic zachodzi z lUO-pne wydajnością. Równocześnie z tym procesem zachodzi proces bczpromicnistcj relaksacji cząsteczki (na rys. 21.1 przedstawionej przerywaną linią C), która polega na stracie energii podczas zderzeń z innymi cząsteczkami. Możliwe są przejśoudr podstawowego stanu s ingfef owego, ewentualnie do stanu trypletowcgo o niżs-i energii w wyniku reakcji chemicznej z cząsteczkami otoczenia lub powstania rdą stabilnego izomeru.
Proces fluorescencyjny charakteryzuje się dwoma widmami: fluorescencji i wzte dzenia.
21.2.2. Widmo fluorescencji
Zależność natężenia fluorescencji od częstości (lub długości fali) emitować promieniowania fluorescencji nazywa się widmem fluorescencji. Widmo to jer fizyczną charakterystyką substancji i jego położenie umożliwia jakościową charat
terystykę substancji. Pomiar natężenia emisji przy danej długości fali (albo całkowitego natężenia fluorescencji) wykorzystuje się w analizie ilościowej.
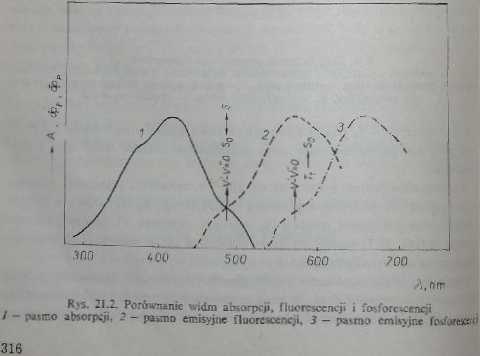
Z rysunku 21.1 wynika, ic widmo fluorescencji przesunięte jest w stronę niższych energii w porównaniu z widmem absorpcji (rys. 21.2), Jest to względnie wąskie pasmo emisyjne, jeżeli fltioresecncję bada się w zamrożonych roztworach. Ma ono zazwyczaj symetrię zwierciadlaną w stosunku do pasma absorpcji. Pasmo absorpcji ma strukturę odpowiadającą poziomom stanu wzbudzonego, podczas gdy struktura pasma fluoresecnoji (jak wynika z rys. 21.1) odpowiada poziomom podstawowego stanu elektronowego (przejścia fluorescencyjne zachodzą na różne poziomy oscylacyjne i rotacyjne stanu podstawowego). Ponieważ S9 i S, są sunami tej samej cząsteczki, to prawdopodobne jest określone ich podobieństwo. Obydwa piki pokrywają się, przy czym punkt przecięcia wyznacza przejścia (Ml, tj. przejścia między najniższymi poziomami oscylacyjnymi obu stanów elektronowych (rys. 21.2), Wyznaczenie (niekiedy tylko w sposób przybliżony) długości fali, a więc i energii odpowiadającej temu przejściu, ma duże znaczenie, ponieważ przejście 0-0 określa energetyczną odległość obu stanów elektronowych bez wpływu oscylacji (np. przy korelacji optycznych, kinetycznych wielkości z wynikami obliczeń kwantów o mechanicznych lub wzajemnej korelacji tych wielkości).
21.2.3. Widmo wzbudzenia
Zależność natężenia fluorescencji, mierzonego przy długości fali odpowiadającej maksimum fluorescencji, od długości fali promieniowania wzbudzającego jest nazywana widmem wzbudzeniu. Cząsteczka fluoryzuje po absorpcji promieniowania z zakresu swego widma wzbudzenia. Jeżeli fluorescencja jest dostatecznie intensywna, to widmo wzbudzenia można wyznaczyć za pomocą spektrofotometru (np. obserwując fluorescencję wizualnie lub za pomocą fotometru), powoli zmieniając długość fali promieniowania wzbudzającego padającego (z monochromatora) na próbkę. W ten sposób wyznaczone widmo wzbudzenia jest praktycznie identyczne z pasmem absorpcji substancji (ewentualne niewielkie różnice są spowodowane przez przyrządy). Jest zrozumiałe, żc widmo wzbudzenia jest różne od widma absorpcji w zakresie dalszych pasm substancji, które są wywołane np. innym niefluoryzującym chromoforem.
21J. ZASTOSOWANIE METOD FLUORYMETRYCZNYCH W ANALIZIE JAKOŚCIOWEJ I ILOŚCIOWEJ
21.3.1. Struktura cząsteczki substancji fluoryzującej
Koniecznym warunkiem powstania fluorescencji jest taka struktura cząsteczki badanej substancji, aby była możliwa absorpcja promieniowania. Im większa jest absorbancja, tym intensywniejsza jest fluorescencja danej substancji. Dla widu próbek natężenie emisji jest wprost proporcjonalne do molowego współczynnika absorpcji fluoryzującego związku.
317
Wyszukiwarka