P1100224
Można spodziewać się. źe fluoryzować będą cząsteczki o dużym układni sprzężonych wiązań podwójnych. Jednakże podstawniki mogą istotnie zmienić fluorcaoencję. W fluoryzujących cząsteczkach występuj© przeważnie przynajmsajj jedna grupa elektronodonorowa, która zwiększa fUiorcscencję (np. —N{CH<, — NHCHj, ■—NHj, —OH. —OCH3). Z drugiej strony elektronoakccptorowe grt* py (np.~NOa, —CN. — SOjH, —CHO, —COOH, halogenki) zmniejszają, fck całkowicie wygaszają, fluoresoencję. Promieniowanie fluorescencyjne bardzo oaęa* emitują związki aromatyczne i heteroaromatycznc.
Fiuroyzującc struktury są koplaname względem chrotnoforu. a naruacrit kopfanarttości często powoduje utratę zdolności do fluoresccncji. Dla przydać u zostaną porównane struktury fluorcsceiny i tenoloftaleiny
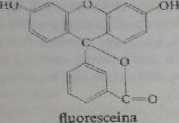
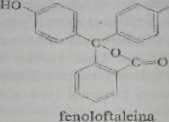
Zamknięcie pierścienia w fluoresceinie powoduje wzrost planamości jej striu-tuiy, sztywność i w znacznym stopniu zmniejsza drgania wewnętrzne. W wyr.iVu tego Huoresceina odznacza się intensywną fluorescencją, której nic obserwuje ią w przypadku fcnoloftalciny. Podobne zamykanie pierścieni prowadzące do powju-nia struktury płaskiej zna miejsce przy powstawaniu cbclatów z jonami metaj Przykładem może być reakcja często stosowana w analizie ilościowej: jon Al'* tworzy che lat z cis-izomerem 2-hydroksynaftalenoazo-2’-hydroksynaftaIcno-4'*5i';-fonianu
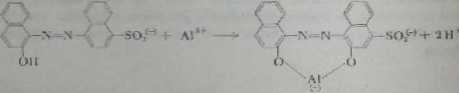
Dalszą istotną przyczyną powstawania fluoresccncji (ewentualnie okrełkwar wartości długości foli maksimum pasma emisji) jest ładunek chromoforu. Mota zauważyć duże zmiany natężenia lub położenia na osi długości fal widma fluoresco-cyjnego w zależności od pH roztworu. Przy czym zmiana pH ma tylko mały wpij* na widmo absorpcji. Dysocjacja protonu często jest przyczyną zwiększenia firnu* secncji i odwrotnie protonowanic może ją zmniejszyć lub calkowcae wygasić.
Omówione czynniki, od których zależy fluorescencją, można wykorzystać k badania struktury substancji lub do badania jej zmian podczas reakcji Itp.
21.3.2. Wskaźniki fluorescencyjne
Niektóre substancje są tak czute na zmiany pH, żc można je używać jako wskaźniki do miareczkowania alkacymctrycznego. Zaletą tych substancji jest to, że zmiana ich fluorcsccncji \v świetle nadfioletowym lub widzialnym w punkcie równoważnikowym jest widoczna nawet w przypadku miareczkowania intensywnie zabarwionych roztworów. W tym przypadku miareczkowany roztwór umieszcza się w ciemności i oświetla lumpa rtęciową, która jest źródłem światła nadfioletowego. Zmianę fiu-otcsocncji można obserwować wizualnie lub wyznaczyć za pomocą fotokomórki Przy tym zmiana fluorescencji może zachodzić w różnych zakresach pH, co umożliwia szerokie zastosowanie tych wskaźników. Niektóre / nieb podano w tabi 21.1.
Tablica 21.1. Wskaźniki fluorescencyjne
|
Nazwa |
Fluorescencją |
«r środowisku |
pH zmiany |
|
kwaśnym |
zasadowym |
fluorcsccncji | |
|
Żółcień co zy nowa |
— |
żółta |
0.0 - 3.0 |
|
/J-Nafl>!©ftimnn |
, |
fioletowa |
2,9 — 4.4 |
|
p-Naftylachinolinu 6-H C ksy lo-4.7-dv/uh ydro - |
niebieska |
4.4 - 6,3 | |
|
ksykumoryna |
niebieska |
6,2 — 7,6 | |
|
Kwas kulturowy |
m- |
zielona |
7.2 - 9,0 |
|
Orani a kry dyno wy Kwas 1,8-aintnonal'tyló- |
pomarańczowa |
żóho-zielona |
8,4 - 10.4 |
|
-2,4- <1 wusulfonowy |
brązowo-flolctowa |
iółto-brązo*a |
10.0 - 12.0 |
|
Kwas 3-nmltvonaftowy |
niebieska |
11.* ^13,0 |
Również do miareczkowania kainplcksoir.ciryczncgo stosuje się wskaźniki fluorescencyjne. Przy miareczkowaniu EDTA roztworem jonów wapniowych jako wskaźnik można użyć kalceinę. Po osiągnięciu punktu równoważnikowego roztwór silnie fluoryzuje w wyniku powstawania kompleksu kalcemy z jonem wapniowym.
Wskaźniki fluorescencyjne nic są jedynym zastosowaniem fluorcsccncji do oznaczania substancji. Bezpośrednie mierzenie natężenia fluorcsccncji umożliwia oznaczanie stężenia substancji fluoryzujących.
21.3.3. Zależność między natężeniem fluorcsccncji i stężeniem oznaczanej substancji
Przyjmuje się. że natężenie fluoicsccicji jest równe zmniejszeniu wiązki światła pomnożonemu przez wydajność kwantową fluorcsccncji ć
o-*X (21*0
Zmniejszenie natężenia światła wiązki można obliczyć na podstawie prawu
Lam berta-Be er a
~ — 10—* (21.2)
w©
fózic: c — molowy współczynnik absorpcji, / —grubość warstwy roztworu. « -
stężenie
319
Wyszukiwarka