P1100233
bolero B
B - 2,303 J e“dv
Całkowanie pasma wykonuje się planimetrycznie lub melcdą graficznego <*,. kowania.
A — 2,3#Cc* Av*,/2 , I-mol•cm~2
(2232)
gdzie
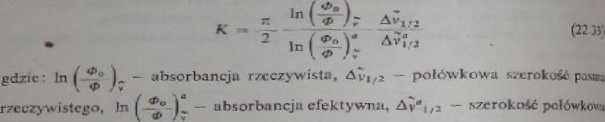
pasma efektywnego.
Wartości K zawarte są w przedziale ok. I — */2 i podane są w tablicach. lak* palne natężenie pasm można obliczyć zgodnie z równaniem
Inlegrulnc natężenie absorpcji pasm symetrycznych, których kształt odpo»u4| funkcji Lorentza, można obliczyć na podstawie absorbancji i połówkowej srcrnlcfej pasma zgodnie ze wzorem

(22.M)
przy czym
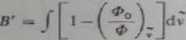
(22 35)
Wartości q dla absorbancji 0-2 podane są w tablicach.
Do określania integralnego natężenia pasma stosuje się różne jednostki. Najczęściej stosuje się miano 1 mol“1 cm-2, przy czym najczęściej stosowaną jednostką jest 104 1-mol”1 -cm"*.
Dla większości związków organicznych wartość integralnego natężenia absorpcji wynosi ok. I — 5-10* l*mol~ł - cm-2. Tylko w pojedynczych przypadkach, np. dla mocnego oddziaływania drgań, integralne natężenie absorpcji może osiągać nawet 20 104 l-mol_ł cm"*.
Ałnorbancja pasm i całkowe natężenie absorpcji zależy od zewnętrznych opływów (stanu skupienia i rozpuszczalnika). Od zdolności rozdzielczej przyrządu n-leży tylko molowy współczynnik absorpcji pasma.
22.8. POŁOŻENIE PASM ABSORPCJI
Liczby falowe charakteryzujące poszczególne pasmu, które odpowiadają drgi* niom wiązań w cząsteczkach związków organicznych, zależą od wpływów zcwuęts-nych i wewnętrznych.
Wpływy zewnętrzne. Poszczególne liczby falowe parni zaletą od sianu ikupma. asocjacji 1 solwnlucji cząsteczek.
Liczba falowa określonej grupy przesuwa się w kierunku mniejszej wartości w zależności od stanu skupienia substancji w następującym porządku:
gaz > ciecz > substancja stała
Widma wyznaczane dla stanu stałego substancji tą bardzo przydatne przy określaniu poszczególnych grup. Do badania wpływów strukturalnych i»c są one przydatne, ponieważ w stanie krystalicznym liczby falowe wiązań są zależne od występujących wiązań wodorowych, oddziaływań dipolowych ilp. Wiązania wodorowe występują również w substancjach rozpuszczonych i można je zaniedbać tylko w bardzo rozcieńczonych roztworach.
Liczba falowa wiązania substancji polarnych zmniejsza się przy przejściu od mniej polarnego do bardziej polarnego rozpuszczalnika.
Do wpływów wewnętrznych zalicza się: efekty elektryczne, efekty steryc/ne i oddziaływanie drgań.
Nazwą efekty elektryczne obejmuje się indukcyjne, mczoir.erycznc i sprzęże-aiowe efekty, przy których następuje wzajemny wpływ wiązań w cząsteczce związku. Zmiany gęstości elektronowej w wiązaniach w dużym stopniu przejawiają się w widmie w podczerwieni.
Tablica 22.2. Wpływ rozpuszczalnika na przesunięcie pasma absorpcyjnego
|
r, cm | |||||
|
Związek i grupa |
w stanic |
n-heksaa ! |
ca. |
i cś- | |
|
gazowym | |||||
|
Acetofenoo C»Q |
1709 |
1697 |
1692 |
1690 | |
|
Fenol O-H |
3654 |
1 3622 |
3611 |
3591 |
Przykładowo rozpatrzono wpływ efektów elektrycznych:
Grupa karbonylowa aldehydu octowego ma charakter polarny i atom Ucna ma ułamkowy ładunek ujemny
Cl-
Ni
v ■ 1761 cm"1
Chmura elektronowa tworząca wiązanie jest przesunięta w stosunku do geo-metrycznego środka wiązania w kierunku atomu tlenu.

leżeli wodory grupy metylowej zostaną zastąpione przez atomy chloru, to w wyniku wpływu atomów chloru zmniejsza się przesunięcie elektronów w kierunku atomu tlenu grupy karbonylowej; wywoła to wzrost liczby falowej wiązania O—O.
Przesunięcie liczb falowych pasm wiązań w związkach organicznych zależy przede wszystkim od wielkości elcktroaiodonorowcgo lub elektronoakceptorowcgo wpływu podstawników na rozpatrywane wiązanie.
22 Flzyctne metody
Wyszukiwarka