P1100268
tacja widma masowego jest oparta na rozwiązaniu układu liniowych równali. i;te5rc można zapisać w postaci
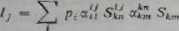
(2110)
gdzie: Ij — prąd odpowiadający pikowi o ma mc j, p, — cząstkowe ci śnienie gazu / «5i — względny współczynnik rozkładu gazu / na fragment o masie J w stosunku do masy A SJ{ - względna czułość fragmentu o masie j gazu i w stosunku do masy * wzorcowego gazu k, — względny współczynnik rozkładu gazu k na fragozat o masie /i w stosunku do masy m, Stm “ absolutna czułość gazu k o masie m.
Do rozwiązywania układu równań liniowych stosuje się metodę macierzy odwrotnych zwłaszcza gdy do rozwiązywaniu stosuje się maszyny cyfrowe.
28.3.1. Analiza jakościowa
Zasadą analizy jakościowej i strukturalnej jest stwierdzenie, że dwie róża: cząsteczki bombardowane elektronami zachowują się różnie. Nawet cząsteczki o bardzo podobnej strukturze lub izomery wykazują określone różnice w zachowaniu się poszczególnych wiązań podczas rozpadu w źródle jonowym i w ich widmach występują różne jony lub różnią się one ich względną intensywnością.
Zależności między widmem masowym i strukturą związków są jednakże harda skomplikowane i wyjaśnienie powstawania fragmentów jonowych ze związfcfr o znanej strukturze lub ustalenie struktury nieznanego związku na podstawie widm masowego wymaga dużego nakładu pracy i intuicji doświadczonego pracownika
Kinetyka procesów rozpadu jest stosunkowo mało znana i cały proces jat często skomplikowany, ponieważ wzbudzone jony przed dysocjacją ulegają różayn przemianom i obecności niektórych fragmentów w widmie nie można wyjaśnię zwykłym rozpadem. Ustalono kilka najogólniejszych reguł, które ułntwiąją interpretację widm masowych
1. Przy powstawaniu jonów fragmentarycznych występuje tendencja do tworzenia możliwie trwałych termodynamicznie produktów (o największym A//), przy czym zachodzą przeważnie procesy homolityozne, tj. powstają dodatnio naładowani' jony rodnikowe (R3C*\ R2CH+\ RCHf) albo jony dodatnie (np. R2C=OH+, CH2=NH*) i trwałe cząsteczki obojętne (C2H2, C2H2CO, H20, HCN, CS,); w widmie obserwuje się tylko dodatnio naładowane jony.
Tendencja do tworzenia stabilnych jonów łącznie ze stabilnymi obojętnym cząsteczkami, jest często związana z przebudową cząsteczki i powoduje, że widm izomerów o różnej strukturze mogą być podobne do siebie, ale różnią się np. tyfb> występowaniem jonów cząsteczkowych; albo odwrotnie, mała /miana smita? może wywołać istotne zmiany w charakterze widma masowego, np. podstawienie prostych związków aromatycznych — benzenu, tiofenu — grupą metylową.
2. Termodynamicznie trwałe związki, jak np. węglowodory aromatyczne — benzen. naftalen — tworzą jony cząsteczkowe, a mniej trwałe związki np. alkohole trzeciorzędowe tworzą jony M-X (np. X — HzO, CH*).
3. Cząsteczki zawierające heteroatomy (O, N. S) przy jonizacji tracą jeden
i wolnej pary elektronowej, a powstający jon cząsteczkowy rozpada się rsodnic z własnym mechanizmem.
4. W większości przypadków maksimum o największej wartości mje odpowiada onotn cząsteczkowy m, z których można jednoznacznie wyznaczyć względną masę jąsteczkową. Nic zawsze można identyfikować jony o największej masie z jonami cząsteczkowymi, ponieważ w przypadku, gdy potencjał jonizacyjny cząsteczki jest zbliżony do potencjału powstawania jonów fragmentarycznych może zabraknąć jlwów cząsteczkowych, lub będzie ich bardzo mało.
Wyjaśnić, czy obserwowany pik jest pikiem jonu cząsteczkowego można dwoma sposobami-
W pierwszym przypadku obniża się energię elektronów w źródle jonowym, co powoduje nieuniknione zmniejszenie się natężenia jonów fragmentarycznych i wzrost natężenia jonu cząsteczkowego w porównaniu do jonów fragmentarycznych.
Przeprowadzając pośredni dowód postępuje się tak, aby zwiększyć możliwość dwcrąsteczkowych zderzeń jonu cząsteczkowego z rodnikami (zwiększa się ilość substancji, ewentualnie przedłuża się czas przebywania próbki w komorze jonizacyjnej przez zmniejszenie napięcia odchylającego). W wyniku tego z jonu cząsteczkowego M powstaje jon M+l, na przykład
H- |
[R—O-—R] I -ł R-O-R H
M M+l
W złożonych mieszaninach nic zawsze można identyfikować w widmie pcaczcgół-oe fragmenty zwłaszcza gdy ich masy są równe (np. jon mje = M-56 może reprezentować jony M~N2CO, M-N2C2H4 i in.). W takich przypadkach do ich rozróżnienia stosuje się technikę wskaźnikową lub stosuje się przyrządy o dużej zdolności rozdzielczej.
W technice wskaźnikowej identyfikuje się jony znacząc substancję wyjściową
trwałym izotopem danego pierwiastka (D, ‘*0,13C, 15N i in.).

Technikę wskaźnikową stosuje się do oznaczania sumarycznych wzorów związków (bez atomów znaczonych); polega ona na mierzeniu udziału naturalnych trwałych izotopów pierwiastków tworzących związki. Porównuje się obserwowane względne natężenia wiązek jonów M, M+l, M+2 itd. z obliczonymi na podstawie tzw. zawartości izotopowej, tj. udziału izotopów w procentach monoizotopowego jonu M w stosunku do jonu M+1, M +2 itd. Natężenie wiązki jonu cząsteczkowego w widmie przyjmuje się na 100%, a natężenia wiązek jonów M+l, M+2 są wyrażone v stosunku do natężenia wiązki jonu cząsteczkowego (w procentach). Z możliwych wzorów sumary cznych o jednakowej liczbie masowej wybiera się następnie ten, który wykazuje dobrą zgodność zmierzonych i obliczonych wartości M+l, M+2 itd.
283.2. Analiza ilościowa
Spektrometria masowa przy założeniu, że jakościowy skład jest znany, umożliwia stosunkowo proste przeprowadzenie ilościowej analizy także złożonych miesza-
Wyszukiwarka