P1100273
Ola roztworów rozcieńczonych można stosować zamiast aktywności alężeni, i wtedy prawo podziału jest określone wyrażeniem
_ *
gdzie: ĆAor> i C\,w — stężenia substancji odpowiednio w fazie organicznej i wodnej.
Prawo Nernstn w tej najprostszej postaci jest jednak spełnione rzadko, posiew pod wpływem dysocjacji i asocjacji cząsteczek substancji rzeczywiste stosunki w rog. tworach są bardziej skomplikowane. Graficznie przedstawione prawo Nem sta ta. żywa się izotermą podziału. W idealnym przypadku izoterma podziału ma przebieg

Rys. 30.1. Izotermy podziału e,. ca — stężenia substancji w obu fazach w ittrjg równowagi; /, 2, 3 — izotermy
prostoliniowy'. Jeżeli występują odchylenia od prawo Nemsta, izoterma nic ja; prostoliniowa, ale odchyla się na korzyść jednej lub drugiej fazy. Prawdopodobni), stwo odchyleń zwiększa się głównie ze wzrostem stężenia (rys. 30.1).
Wyznaczanie współczynnika podziału
Najprostszy, ale również mało dokładny sposób wyznaczania wspólcz>iuili podziału polega na wytrząsaniu określonej ilości substancji w roztworze l oi?> więdnie dobraną drugą fazą ciekłą i na oznaczeniu równowagowych stężeń lutemcj w obu Fazach.
Dokładniejsze wyniki uzyskuje się, stosując ekstrakcję wielokrotną. Jeżeli weliny ruztwóf ekstrahuje się stopniowo n porcjami organicznego rozpuszczalnika pny stałym stosunku objętości faz Y^J Yw —r wydajność ekstrakcji
Dla
n- I, r-1 Rx - KCl+K) (3M
gdzie wydajność ekstrakcji R jest częścią wyekstrahowanej lub wydzielonej wb-stiim ji przeprowadzoną do fnzy organicznej lub innej fazy w stosunku do całkowitej jej ilości ,
R - KW('nA>n«i W
gdzie: OuW* - całkowita, początkowa ilość substancji w układzie przed roate-laniem. imA)Ma - ilość substancji w fazie organicznej po rozdzielaniu.
fFttrsąsofUc
Metodę ekstrakcji wybiera &ię w zależności od wartości znanego współczynnika ^ialu danej substancji. Jeżeli współczynnik podziału jest znacraic większy od I, (-jbttsncja przechodzi z roztworu do rozpuszczalnika w dużym stopniu, to pntk--,<niic do całkowitej ekstrakcji wystarczy jednokrotne wytrząsanie z jednakową jfcęteioą rozpuszczalniku, leżeli współczynnik podziału substancji jest bliski 1, .trnpmie nnlcźy prowadzić wielokrotnie, aby większa część substancji przeszła
.(ititwoni wodnego do rozpuszczalnika. Jeżeli wreszcie współczynnik podziału jest
^itjsiy od I, konieczna jest wielokrotna ekstrakcja lub ekstrakcja ciągła.
Przy matematycznej ocenie tych procesów wiadomo, źc żadną z wymienionych „tUdnic można osiągnąć 100% ekstrakcji substancji z roztworu do rozpuszczalnika, ife przez odpowiednie dobranie warunków doświadczalnych (A! i r) można znaleźć *b układ dwóch cieczy, że substancja przejdzie do ekstraktu praktycznie ilościowo.
Ekstrakcja ciągła
Ekstrakcja ciągła jest to specjalny przypadnie ekstrakcji, w której rozpuszczalni organiczny jest w ciągłym obiegu. Rozpuszczalnik przechodzi przez drugą fazą, •bmkt zbiera się w specjalnej kolbie, skąd rozpuszczalnik odparowuje i po skroplę-:i v chłodnicy zwrotnej ponownie jest zawracany do drugiej fazy. Substancje ekstra-iowane odzyskuje sią jako pozostałość po oddestylowaniu ekstraktu. Istnieją roz-wjj/ania aparaturowe ekstrakcji tą metodą dla rozpuszczalników lżejszych i cięż-uych od wody.
Ekstrakcja przeciwprądowa
W metodzie tej dwie substancję rozdzielają się optymalnie, gdy jest zagwarantowana następująca zależność między ich współczynnikami podziału:
&
Kd
(30-5)
łb stosunku objętości faz
•3L mm
1
Schemat rozdzielania frakcyjnego przeciwprądowego jest pokazany na rys- 30-2. Do wykonania takiego procesu użyto najprostszych rozwiązań laboratoryjnych -cmeg rozdzielaczy. Rys. 30.2 przedstawia rozwinięcie szeregu odpowiadające rozwinięciu dwumianu
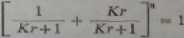
fidtic n liczba przeniesień.
Zgodnie z rys. 30.2 można dość prosto wyznaczyć ilość substancji w każdym rozdzielaczu (tabl. 30.1).
Istnieje kilka sposobów wykonania ekstrakcji tą metodą, które różnią się etfek-rywaością rozdzielania substancji przy jednakowej liczbie przeniesień.
417
U Fteycinc metody
Wyszukiwarka