P1100281
stawiona prostą określoną równaniem
«-*c H
gdzie k - stola zależna od jakości adsorbentu, rozpuszczalnika i rozpusz^ substancji.
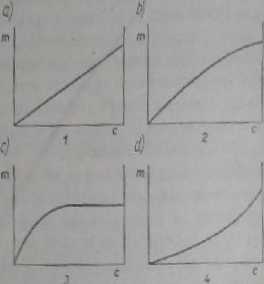
Rył. 32.1. SćhcmityczM kształty Izoterm adsorpcji: a) Izoterma liniowa, b) izoterma Frr* dlfclia, c) izoterma Langmuim, d) izoterma wklęsła; c - stężenie, m - masa adsorian
W rzeczywistych przypadkach adsorbeja wyrażona jako ilość masy subifcajj zaadsorbowanej przypadającej na jednostkę masy adsorbentu zbliża się do ch> flonej wartości, ponieważ powierzchnia adsorbentu dla dużego stężenia subta&ji w roztworze praktycznie zostaje nasycona. W takim przypadku izotermy adsapcji mają charakterystyczny kształt 2 (izoterma Frcundlicha) lub 3 (izoterma Laagjauiia)
Zrorewf Frewtdlicha (rys. 32.1.2) ujmuje równanie
m - keł/* (Sią
gdzie kin- charakterystyczne stałe adsorpcji.
Równanie to jest /godne z rzeczywistym przebiegiem adsorpcji ze stosunkowi) rozcieńczonych roztworów, ale nie sprowadza się do prostoliniowej zależności, aa też nie osiąga stałej wartości dla dużych stężeń.
Izoterma Laigmira (rys. 32.1,3) najlepiej ujmuje rzeczywisty przebieg adsorpó dla granicznych stężeń. Matematycznie wyraża ją następujące równanie
m = — albo m-i^- (32.3a,32.»)
l+fc2e l + wc v
gd/ie; kx i fc2 - stale charakterystyczne adsorpcji, m, - maksymalna masa wb stancji przypadająca na jednostkę masy adsorbentu przy całkowitym nasycać, w - masa substancji zaadsorbowanej przez jednostkę masy adsorbentu w Hue równowagi, c - stężenie
© - Kcxp (E/RT) (32.5)
gdzie: V — jest objętością cząsteczki w stanie zaadsorbowanym, E - energia adsorpcji, R - stała gazowa, T - temperatura.
Z izotermy Langmuira wynika, że przy małych stężeniach możnn w mianownika l^wnania (32.3) zaniedbać człon k2 c, cwentr.uluie «c, wtedy I I m =. || e lub m » mxcac ico (32.Sa, 32.5b)
W zakresie małych stężeń izoterma Lanftnnira jest więc izotermą prostoliniową. Na odwrót przy dużych stężeniach można we wzorze (323a, 32-3b) zaniedbać I zo względu na iloczyn k3c lub toc, powstanie więc
(32.6a, 32.6b)
k c
m
—ł — ■■ const lub m-m,- const kze
tj. maksymalna masa substancji, która może się zaadserbować na jednostce masy adsorbentu.
Powyższe zależności są słuszne dla przypadku, gdy r.a danym adsorbencie adsorbujc się tylko jedna substancja. W praktyce bit rdzo często na danym adsorbencie jednocześnie adsorbujc się kilka substancji. Toki przypadek nazywa się adsorpcją mieszaną lub adsorpcją z mieszaniny.
jeżeli założy się, że adsorpcję mieszaną można opisać izotermą rdsorpcji Lang-muira. dla części powierzchni z substancją A jest słuszna zależność
mA —
*A<A_
1 + Aaca+/cbcb
Dla powierzchni z substancją B r< dobnie
mn
(32.8)
gdzie kĄ i kD w obu równaniach są stałe.
Jeżeli stężenia obu substancji są małe można, analogicznie jak w przypadku jednej substancji, mianowniki równań (32.7 i 32.8) zastąpić l i napisać
% - *a cK I mB * kn c„ 132.9, 32.10)
Oznacza to, że w przypadku małych stężeń, kiedy oba roztwory są bardzo rozcieńczone i kiedy do adsorpcji jest dostatecznie duża powierzchnia, każda z absorbowanych substancji zachowuje się tak, jakby druga substancja nic występowała w układzie.
Jeżeli jednak iloczynu kA cA nie można zaniedbać, pcdczas gdy iloczyn kmca jest bliski zeru, zależność będzie miała pc>stać
m* —
mm. Ca - i (32.11, 32.12)
1 + AaCa l + fcACA
W tym przypadku adsorpcja substancji A przebiega według swojej izotermy a nie jest zakłócona obecnością substancji B. Natomiast ądsoi pcja sub^taicj B znjuejsza się ze wzrostem adsorpcji substancja A. Ten przypadek występuje w praktyce stosunkowo często — wypieranie jednej substancji z powierzchni adsorbentu drugą
substancją.
Przy badaniu adsorpcji mieszanin dwuskładnikowych można także zastosować inny sposób przedstawienia izotermy adsorpcji. W tym przypadku na oś x nanosi się ułamki Wagowe jednego ze składników w roztworach wodnych. Zmianę stężetua.
433
n Fizyczna metody
Wyszukiwarka