P1100306
się przesuwać w cieczy do jednej z elektrod. Ten ruch fazy stałej w cieczy pod wpływom poła elektrycznego nazywa się elektroforezą {kara- lub anafamą).
Zjawiska elektroforezy można rozważać także z punktu widzenia teorii jonowej roztworu. W myśl teorii dysocjacji elektrycznej, cząstki zawiesiny i cząstki koloidalne można uważać za cząsteczki elektrolitów z bardzo dużą względną masą cząsteczkową, które dysocjują jut jon koloidowy* z dużym ładunkiem i na grupę elektrolitycznych jonów również i dużym ładunkiem elektrycznym, aJc z przeciwnym znakiem. Z tego punktu widzenia rozróżnia sięjonoforezę, tj. ruch jonów o małych cząsteczkach, i elektroforezę, tj. ruch jonów wielkocząsteczkowych. Między nimi nie ma ostrej granicy.
W słabych kwasach i zasadach w roztworze buforowym, w którym zachodu rozdzielanie, ustala się równowaga między postacią zjonizowaną i niezjonizowaną. Podczas elektroforezy substancja jednak nic rozdziela się na składniki, ale porusza, się jako całość, więc postać niezjonizowana powoduje zmniejszenie prędkości ruchu. Zaleto ść między pH i stałą dysocjacji można wyrazić równaniem Hendcrsonn-Has-sdbaciu
|
, j ni *■“ [HA] |
(36.1) |
|
fŁJ+1 rr ,D*A] |
(36-2) |
|
pH - pK-r- Ig [M |
OM) |
z czego
i po złoearytmowaniu
gdzie pK - ujemny logaiytm stałej dysocjacji.
W arafolitach, których cząstki vr wyniku wewnętrznej jonizacji mają ładunek dodatni i ujemny, wpływ pil środowiska na jakość rozdzielenia tych substancji jest bardzo duży. Przy wysokim pH występuje dysocjacja i przejawiają się własności kwasowe grup karboksylowych. Powstają aniony R—COO~. Przeciwnie, przy niskim pH dysocjacja grup kwasowych jest ograniczona i przejawiają się tylko funkcje grup zasadowych, ładunek jonizowanej cząsteczki jest wtedy dodatnim ładunkiem grup RNHMiędzy tymi dwiema ekstremalnymi wartościami pH istnieje jednak takie pil, w którym ilość zjoiuzowanych grup kwasowych i zasadowych jest jednakowe, więc całkowity ładunek cząsteczki jest zerowy. Takie pH nazywa się puckim izotlektrycyiym; jest on wielkością charakterystyczną każdego amfolilu.
W białkach, W ych cząsteczki tworzy kilka aminokwasów, wartość punktu izoekktryczncgo mjżna obliczyć ze wzoru
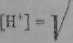
K»rbK»a+ ... 4-K^ „
(36.4)
gdzie: KtlA,m - stałe dysocjacji kwasów, ATtl>x.R - stale dysocjacji zasad, K* -stała dysocjacji wody.
Ponieważ kwasowość grup karboksylowych jest większa cd zasadowości grup aminowych wypadkowy punki izodektryemy jest mniejszy od 7. Vf punkcie izo-elektrycznym prędkość ruchu cząsteczek amfolilu jest równa zeru, u więc rondzie*
Imtew ogóle nie zachodzi, z wy tniklctn nichu C7ą»teciek /e Martu. Wartość punktu |ioolektr>czncgo zalety t«ik2e od siły jonowej roziwom buforowego, w którym r»-chodzi rozd/ielHiiie.
Własność tę wykorzystuje się do rozdzielania substanrgi sęccjaliui techniką — cltktroforczti oynisfcowanci. W metodzie tej w cdpowiedrjm roztworze buforowym w specjalnie skonstruowanej kolumnie wytwarza się gradient pH odpowiadający punktowi izcelckiryczneinu rozdzielanych substancji. Po zakończeniu rozdzielania kolumnę opróżnia się -w taki sposób, aby rozdzielone substaiwge nie zmieszały się powtórnie. Bluat analizuje się zwykłym sposobem. Metcda elcktroforezy ogniskowanej jest korzystna do rozdzielania enzymów, toksyn bakterii, białek zawartych w serze itp- Ogólnie można tą metodą rozdzielać substancje różniące się wartościami punktów izoelcktrycmych przynajmniej o 0.02 pH.
Do celów praktycznych ważniejsza jest jednak znajomość wartości pH, przy której różnica ruchliwości rozdzielanych substancji jest największa. Consdcn wyprowadzi! dla aralio)itów zależność określającą pHt przy którym różnica rzeczywistych ruchliwości dwóch substancji jest największa
pK., +pK*ł
pH —--j-
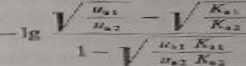
(363)
gdzie: AT.i.a — stałe dysocjacji kwasów 1 i 2. um% i2 — ruchliwość jonowa kwasów 1 i 2, pK., (J — ujemny logarytm stałej dysocjacji “kwasów 112.
Blektroforclyczne metody rozdzielania opierają się r.a niejednakowej ruchliwości substancji w polu elektrycznym. Ruchliwość subMarcji jest definiowana jako prędkość, z jaką porusza się elektrycznie naładouana cząstka przy jednostkowym gradiencie pola elektrycznego

(36.Ó)
gdzie: v — liniowa prędkość cząstki, £ — gradient pola elektrycznego.
Częściej używa się pojęcia rMtW/nwc* Ccfiniujc się ją jako stosunek
ruchliwości analizowanej substancji do ruchliwości substancji wybranej za wzorzec, której ruchliwość przyjmuje się za równą I. Podaje się np. względną ruchliwość «o wzglądem ruchliwości glukozy, której u0 — 1.
Wypadkowa prędkość cząstek oprócz elektro osmozy, której kierunek ruchu jest niekiedy przeciwny do kierunku ruchu cząstek, zależy jeszcze od innych zjawisk-Jednym z nich jest bariery. którego działanie można wyjaśnić tym, żc struk
tura porowatego środowiska działa jak sito. Sito przepuszcza bez oporu tylko cząstki o określonej wielkości; im większe cząstki napotykają w swoim ruchu makrocząsteczki środowiska, tym ruch ich będzie powolniejszy. W przeciwieństwie do tego. małe cząstki łatwiej przejdą przez, porowa tą strukturę środowiska, poniewat liczba zderzeń jest mniejsza i ruch ich jest szybszy.
Następnym zjawiskiem, które niekorzystnie wpływa na wypadkowy ruch substancji w elektroforezie, jest adsorpcją roszds i danych substancji - Oprócz zmniejs7Cftia
prędkości rozdzielanych substancji adsorpcja powoduje także trwałe straty onali-
Wyszukiwarka