P1050495
3. POTENCJOMETRIA 100
reakcji są jednakowe. Proces elektrodowy osiąga stan równowag, a elektroda wykazuje określony potencjał względem roztworu. Przez granicę faz metal-roztwór płynie wówczas w obu kierunkach jednakowy prąd elektryczny, tzw. prąd wymiany, który jest jedną z podstawowych wielkości charakteryzujących elektrodę w stanie równowagi.
Wartość potencjału elektrody zależy od właściwości metalu, stężenia kationu (ściślej — aktywności) i temperatury.
Zależność potencjału elektrody od aktywności jonu metalu w roztworze, liczby elektronów biorących udział w reakcji i temperatury przedstawia równanie Nernsta
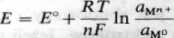
(32)
gdzie: E° — normalny potencjał elektrody, tj. potencjał elektrody w roztworze o aktywności jonów metalu aM„* = 1 (metale uporządkowane według wzrastających potencjałów normalnych tworzą szereg napięciowy); R — stała gazowa 8,31441 J• K~1 • mol"l; T — temperatura bezwzględna, K; F — stała Faradaya, 96486,7 ±0,54 O mol-1; n — liczba elektronów biorących udział w reakcji; aMn, — aktywność jonów metalu; aMo = const = 1 (zgodnie z przyjętą zasadą, że stan podstawowy ma aktywność równą 1).
Ponieważ aMo = 1, wzór przyjmuje postać
(3.3)
E = E° —— ln aMn * nF
Wzór ten, po wstawieniu wartości liczbowych stałych fizykochemicznych i przejściu do logarytmów dziesiętnych, ma postać
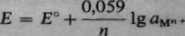
(3-4)
Współczynnik 0,059 został obliczony dla temp. 25°C, dla temp 20°C ma wartość 0,058, a dla 30°C — 0,060.
W roztworach rozcieńczonych aktywności jonów są równe ich stężeniom, więc uproszczony wzór Nernsta ma postać następującą:
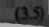
E = £» + 2!2^1g[M"+]
fl
Wyszukiwarka