P1050542
i. POTENCJOM ETUI A
Potencjał elektrody szklanej £2(M) zależy od aktywności jonów wodoru i sodu w roztworze badanym. Równanie przedstawiające tę “zatebrość-podał Nikolski ^ -- —
(3.54)
RT l l( J
^2(sz) = + ^p'*nLaH*(r) + ^H*.N«*flN«*(r)]
W równaniu tym K~ jest stałą równowagi procesu wymiany jonowej i nosi nazwę współczynnika selektywności elektrody. Jest to "Siała równowagi reakcji (3.50)
(3.55)
v _ aN**(mraHł(r)
''H*.Na* — --
Wartość K jest dużo mniejsza od jedności. Dla dobrych elektrod szklanych może wynosić 10~>s, co wskazuje, że elektroda jest bez porównania bardziej czuła na jony wodorowe niż sodowe. Oznacza to. że przy tej samej aktywności jonów wodorowych i sodowych w roztworze, aktywność jonów wodorowych w membranie (szkle) jest dużo większa od aktywności jonów sodowych w membranie.
Na podstawie równania (3.55) można przewidzieć zachowanie elektrody, rozpatrując dwa przypadki: 1) roztwory kwaśne i 2) roztwory silnie zasadowe o dużej zawartości jonów sodu.
1) Roztwory kwaśne
Jeżeli — r" i
flH * (r) ► Kh *.m»* ‘ flN« + (r)
to można pominąć iloczyn Kh*.n«' 'aN»’<r) i potencjał elektrody wyrazie wzorem
RT
I = £° + -p-lPflH-<r) (3.56)
2) Roztwory silnie zasadowe o dużej zawartości jonów sodu. Aktywność jonów wodorowych jest bardzo mała i można jej nie
uwzględniać w równaniu
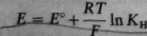
N»
afU* «r)
(3.57)
Elektroda szklana pełni w tych warunkach rolę elektrody sodowej. Zachodzi reakcia (3.50).
Wyszukiwarka