P1050552
I. POTENCJOMETRIA 154
określonym, wartościom pH (potencjały nie są ściśle odtwarzalne). Dlatego przy zastosowaniu elektrody szklanej wartość pH może być wyznaczona tylko metodą porównawczą, na podstawie zmiany potencjału elektrody. Zmiana ta następuje, gdy roztwór buforowy jest zastąpiony przez roztwór badany. Wzory na potencjał elektrody w roztworze badanym (x) i w roztworze buforowym (wz) są następujące:
£„ « ET-kpH'
E„ = £°-*pH„
stąd
« -k(pHx-pHWł)
PHX—PH« = --x~Ewz k
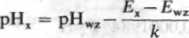
Równanie (3.77) jest podstawowym równaniem pehametrii. Nie występuje w nim E°. Pomiarowi podlega zmiana potencjału elektrody (Ewr—£J spowodowana przeniesieniem elektrody szklanej wraz z elektrodą kalomelową z roztworu wzorcowego do roztworu badanego. Zmiana potencjału elektrody jest proporcjonalna do różnicy pH roztworów. Pehametr jest więc w zasadzie przyrządem do pomiaru różnic pH dwóch roztworów. Może on być używany jako miliwol-tomierz wyrażający zmianę napięcia mierzonego w jednostkach pH. Wobec tego, że zmiana potencjału elektrody wskaźnikowej przy zmianie pH roztworu o 1 ma ściśle określoną wartość (lc2o*c = 58,1 mV). można łatwo obliczyć pH roztworu z otrzymanej różnicy potencjałów lub wyskalować pehametr wprost w jednostkach pH.
Współczynnikiem przeliczeniowym we wzorze (3.77) jest wielkość 1 /k. która zależy od temperatury. Dlatego przed przystąpieniem do pomiaru należy gałkę kompensatora temperatury ustawić _w położenie odpowiadające temperaturze roztworu buforowego ±2,5°. 'Kompensatorem temperatury nazywa się urządzenie umożliwiające dostosowanie pehametru do wartości współczynnika k w danej tempe-
Wyszukiwarka