P1050639
PODSTAWOWE Z ELEKTROLIZY 239
wzorze (4.44) zasadniczą rolę odgrywa potencjał normalny jy £° (potencjał elektrody w roztworze o stężeniu, a ściślej e^,r°ości. jonów metalu 1 mol/1). Metale uporządkowane według wzra-^ Ij potencjałów normalnych tworzą szereg napięciowy (tabl. 4.3).
<13
4J. Szeret napięciowy metali
Reakcja elektrodowa
Metal
Potencjał normalny £° V
li
Rb
K
Ba
Sr
Ca
Na
Mg
Ce
Al
Mn
Zn
fc
Cd
n
Co
K
Sn
Pb
H*ą
a"
Bi Cn Cu Hg *1 Pd
%
Pt
At
At
Li*+e-*Li
Rb*+e-*Rb
K*+e-*K
Ba2++2e-+Ba
Sr2*+2e-*Sr
Ca2++2e->Ca
Na* +e -»Na
MgJ*+2e-»Mg
CeJ*+3e-*Ce
AlJ*+3e-Al
Mn2* +2e -* Mn
Zn2*+2e-»Zn
Fe2*+2e-»Fe
Cd2*+2e-*Cd
Tl*+e-»Tl
Co2*+2e-»Co
Ni2*+2e-»Ni
Snł*+2e-»Sn
Pb2*+2e-*Pb
SbJ+3e-*Sb Bis*+3e-»Bi Cu2++2e-*Cu Cu*+e-+Cu Hgi*+2e-*2Hg Ag++e-» Ag Wa++2e-+Pd Hg2++2e-*Hg Ptł++2e-»Pt
Au,++3e-* Au
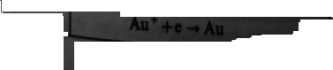
-3,00 -iyi -222 -222 -2,89 -2,84 -2,71 -2,34 -1,68 -1,66 -1,05 -0,76 -N),44 —0,4(5 -0.34 -008 -004 -0,14 -0,13

Wyszukiwarka