P1050662
1 ELEKTROGRAW1METR1A, ELEKTROGRAFIA I KULOMETRIA 260
zanurzona katoda. Po skończonej elektrolizie roztwór zawierający jod, wydzielony na anodzie, spuszcza się do kolby i miareczkuje roztworem tiosiarczanu wobec skrobi. 1 C odpowiada 1,315 mg jodu.
W czasie elektrolizy na katodzie zachodzi reakcja (4.56), a na anodzie reakcja
2I~ -»I2 + 2e
Kulometr alkacymetryczny składa się ze spirali z drutu srebrnego, stanowiącego anodę i blaszki platynowej będącej katodą (rys. 4.11).
Elektrody zanurzone są w roztworach KBr i K2S04. W czasie elektrolizy zachodzą reakcje
|
katoda: 2H20 + 2e-» |
H2+20H" |
(4.56) |
|
anoda: -Ag Ag+ +e |
(reakcja elektrodowa) |
(4.57) |
|
Ag+ +Br" -* AgBr |
(reakcja następcza) |
(4.58) |
|
Ag + Br“ -* AgBr+e |
(reakcja sumaryczna) |
(4.59) |
|
Reakcję sumaryczną przebiegającą w kulometrze |
otrzymuje się | |
przez dodanie równań (4.56) i (4.59)
2Ag+2Br“+2HzO Jl 2AgBr+H2 + 20H~
Utworzone jony OH- miareczkuje się pehametrycznie roztworem HC1. Kulometr odznacza się dużą precyzją nawet przy pomiarze małych ładunków ok. 1 C.

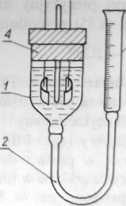
Ryn. 4.11. Kulometr alkacymetryczny Rys. 4.12. Kulometr llenowo-wodorowy
Wyszukiwarka