P1050667

*. ELEKTROGRAWIMETR1A, ELEKTROGRAF1A I KULOMETRIA
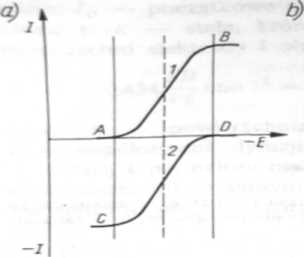
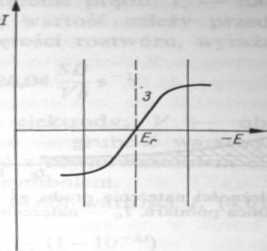
Rys. 4.14. Zależność natężenia prądu od potencjału elektrody dla formy utlenionej (krzywa /) i dla formy zredukowanej (krzywa 2) odwracalnego układu redoks. Krzywa 3 (rys. 4.14b>) przedstawia tę zależność dla układu zawierającego zarówno postać utlenioną, jak i zredukowaną (o równych stężeniach)
Gdy w roztworze będą występowały zarówno postać utleniana, jak i zredukowana układu w jednakowych stężeniach, to otrzyma się krzywą 3 (rys. 4.14b), w której występuje zarówno część katodowa jak i anodowa. Krzywa ta przecina oś odciętych w punkcie Er odpowiadającym potencjałowi równowagi reakcji elektrodowej (potencja! rozkładowy formy utlenionej jest równy potencjałowi rozkładowemu formy zredukowanej).
Zależność natężenia prądu od stężenia substancji, która ulega redukcji przy stałym przyłożonym potencjale £t przedstawiona jest na rys- 4.15. Stężenie substancji w kolejnych roztworach od cx do cs było stopniowo zmniejszane i natężenie prądu było odpowiednio mniejsze. W trakcie prowadzenia elektrolizy przy stałym potencjale, natężenie prądu ulega zmniejszeniu na skutek zmniejszania się stężenia substancji, która wydziela się na elektrodzie. Elektrolizę prowadzi się do natężenia prądu bliskiego zeru, a ściślej do wartości natężenia prądu szczątkowego [2.33.
Jeżeli w roztworze występują dwa składniki różniące się dostatecznie potencjałami redoks (nie mniej niż 0,2 V), to jest możliwe oznaczenie tych składników przy dwóch kolejno przykładanych potencjałach (rys. 4.16), początkowo £’A. a następnie £„ [4.63-
Wyszukiwarka