P1050688
4. ELEKTROGRAWIMETRtA. ELEKT* OGRA FI A I KULOMETKIA /o4
Ponieważ nadnapięcie można w tym przypadku pominąć, potencjały wydzielania będą równe odwracalnemu potencjałowi, wynikającemu z równania Nemsta
4. ELEKTROGRAWIMETRtA. ELEKT* OGRA FI A I KULOMETKIA /o4

034+~?lg<U =0,799 + ^lg[Ag+]
lg[Ag+] = -8,13 [Ag*] = 7,41-10"* mol/1
Srebro zacznie wydzielać się z miedzią, gdy jego stężenie będzie wynosić 7,41 • 10~9 mol/1, stanowi to 7,41 • 10-6% początkowego stężenia srebra i jednocześnie początkowego stężenia miedzi. Ilość srebra, która pozostała w roztworze i będzie się wydzielała razem z miedzią jest więc tak mała, że nie ma praktycznie wpływu na wynik oznaczenia miedzi.
Przykład 17_£_
Podczas kulometrycznego oznaczania składnika elektroaktywnego o wzorze ogólnym B, wydzieliło się w kulometrze srebrowym mA, gramów srebra. Ile gramów składnika B było w próbce? Rozwiązanie. Równoważnik elektrochemiczny k wyraża ilość składnika wydzieloną na elektrodzie przez ładunek 1 C — (wzór 4.6a).
Odwrotność równoważnika elektrochemicznego l/k wyraża liczbę kulombów potrzebną do wydzielenia 1 g składnika, zatem
j—mA, wyraża ładunek elektrolizy.
*Ag.....
Jeżeli ładunek elektryczny zużyty w czasie elektrolizy pomnoży się przez ilość składnika, którą wydziela ładunek 1 C ^kB = to otrzyma się masę składnika wydzieloną na elektrodzie
1

«l
*9
ładunek wyznaczony w kuto-attrze srebrowy"
• K
B
hu oznaczanego składnika B wydzielona przez 1C
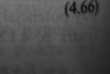
Wyszukiwarka