2

e uo tojjJ*t fc.n^urce
Z- Ol ' u.
id pc' k** q aulo msoócC a oto Kt|Af? •" do p > * N
f
Analiza instrumentalna
Reakcje elektrodowe Roztwory zasad
katoda: 2H+ + 2e -*■ H2
_2H2Q -» 2H* + 20H -
2H20 + 2e -> H2 + 20H-
anoda: 4GH~ -* 02 + 2H20 + 4e
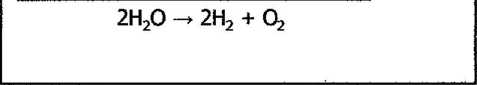
eMUvou£a 4La?v2cx -te^eł* ete^M/2^
HOCpj
~Lcq cCOuó
Z&-
Analiza Instrumentalna
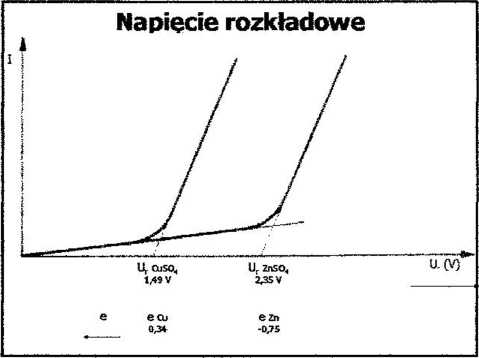
Polaryzacja elektrolityczna -* zmiana potencjału elektrody w stosunku do stanu równowagi pod wpływem doprowadzonego napięcia
r] = Ę - E
gdzie: r\ — nad na pięcie (nadpotencjał)
E — potencjał elektrody w stanie równowagi Ej — potencjał elektrody spolaryzowanej
Analiza Insirumenialna
Nadnapięcie
n = na + n* + ne + ns,
opór ei.tśid(Vi cu ^
gdzie: ąQ — nadnapięcie oporowe x 1
H'Q — nadnapięcie pseudooporowe óf k&m He — nadnapięcie etektroaktywacyjne (aktywacyjne)
Hs — nadnapięcie stężeniowe
lo
^Vk
'fcoc*- Cłz-ii cOcid-ćJ-A S-u. Ci
/Y1 6 •y!^ł2/ŁAA iC /\\a£śk\ Cu*. asy. .j-5 iOo|vC'CWvA
—~ fd-j-y, ryrf •
|
jj||^ Analiza Instrumentalna Nadnapięcie stężeniowe |
JB& Analiza Instrumentalna Techniki eiektrograwimetryczne | |
|
ns = Hd + n* + nK . | ||
|
• elektrograwimetria klasyczna Lv | ||
|
gdzie: rid “ nadnapięcie dyfuzyjne ^ J | ||
|
Hr — nadnapięcie reakcyjne nK — nadnapięcie krystaiizacyjne • A |
• elektrograwimetria z kontrolowanym | |
|
potencjałem elektrody czynnej U) | ||
|
rL-; Jv>-V xA Ci-i Cj. rug >-ó" 7Z ‘ j\ o. CL <y\Ctid |
• elektrograwimetria wewnętrzna |
ę^K^ćc^cJJc- h^jęOitiCi tog j /YuMi* £su*q o.-.
Gd*!/
^ w-iA^CŁLtA
^ *» \. w<, V<wCm
- \C >"t O n OlC. va. l
q (j) cicŁ ad- pj<^vu cou.uj jp> ic~ f-jsjj^oct.
ocoo
Wyszukiwarka
Podobne podstrony:
save0029 (4) i£fvewAL U jM.ypcvdU^ 6u^w>j i a ndMiuCyĄiAA^(A pw c/^u^i^ol, ęoikodl ~> M^pc ^
IMGX89 (2) Wwttk W T»7i- K j ocjin ęot.to. loM mwm >«***»* 6*4«*fc £>OL*~2m3> - *%ir ^Vh
S7307235 1,0 £Mb=@ ,4iw m3^ — r&<jd&’-A?UO mm(m H I fc*V- GO«a!ŚK.
zad4 P - UkK fCIcK/ fc*r * <j F/- C i>(Us-c < <j Ol ^ A rw ^4j ^ N^ t
2 (260) n**0V*3 KM1H O ią«*« (fejOMii «u uo
pccnt2 05 r*p«r tmot-j </40S6>FC O-conn pin 13 PC O-conn pin 12 03 •rror </l> PC 0“CQnn
pccnt2 05 r*p«r tmot-j </40S6>FC O-conn pin 13 PC O-conn pin 12 03 •rror </l> PC 0“CQnn
431 2C3 431CHOJNICE GRUDZIĄDZ — DZIAŁDOWO lOpł KKMumo « l» JB Udi&o.fc MMM (Ol MMaik ICn— I
save0029 (4) i£fvewAL U jM.ypcvdU^ 6u^w>j i a ndMiuCyĄiAA^(A pw c/^u^i^ol, ęoikodl ~> M^pc ^
& ih. Z ą OL im pć ł-O t**Je R1=100Q R2=200Q R3=500Q) j odt ii s jF 4 3 V
& ih. Z ą OL im pć ł-O t**Je R1=100Q R2=200Q R3=500Q) j odt ii s jF 4 3 V
Scan00080005 >**£•*) xW-O = 3 W* -ąkv(H -dcxH), c* -fc C,,g,c łij.u Ol! dr) =
DSC09176 . —1■ O* CJ ZQ^ j 11 "><>ika r - vO
DSC09176 . —1■ O* CJ ZQ^ j 11 "><>ika r - vO
więcej podobnych podstron