image2 (9)

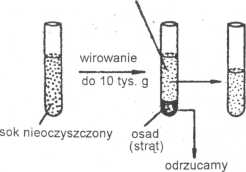
wirowanie do 10 tys. g
rozpuszczony osad odrzucamy P° ultra wirowaniu.
Rotory uchylne to rotory o równo na obwodzie rozmieszczonych ramionach, na których swobodnie zawieszane są pionowo metalowe pojemniki, do których dopiei o wkłada * się probówki zawierające mieszaniną, którą chcemy wirować. W czasie wirowania pojemniki z probówkami stopniowo odchylają się do poziomu, w miarę wzrostu prędkości] obrotowej i dość szybko przyjmują położenie poziome. Siła odśrodkowa działa w tym przypadku prostopadle do dna probówki. Po wyłączeniu napędu probówki wracają łagodnie do położenia pionowego w miarę spadku prędkości obrotowej wirówki. Nie grozi to zmianą położenia poszczególnych rozdzielonych w czasie wirowania frakcji. Takich rotorów używa się we wszystkich przypadkach, w których szczególnie zależy nam na uniknięciu ryzyka wymieszania rozdzielonych w czasie wirowania frakcji po zakończeniu procesu wirowania. Są one szczególnie przydatne do wirowania w gradientach gęstości (zob. dalej). Zawsze jednak należy starać się jak najszybciej odebrać poszczególne oddzielone w czasie wirowania frakcje, aby zapobiec ich swobodnemu mieszaniu się po ustaniu działania siły odśrodkowej. Probówki z rotom trzeba wyjmować ostrożnie starając się unikać jakichkolwiek wstrząsów, które mogłyby doprowadzić do wymieszania rozdzielonych frakcji.
Zwykłe wirowanie, czyli wirowanie z małą szybkością (przyspieszenie do 10 tys. g) j przez niezbyt długi czas (10-30 min) doprowadza do sedymentacji (osadzenia się) więk- 1 szych fragmentów komórek roślin, np. jąder komórkowych, mitochondriów, plastydów i innych organelli lub fragmentów komórek o wymiarach większych niż 250 nm średnicy, i Cząstki wirusa pozostają w supernatancie, czyli w płynnej zawiesinie nad osadem (pel- I letem). Ultrawirowanie z przyspieszeniem rzędu 40-80 tys. g umożliwia już sedymenta-cję cząstek o wymiarach i gęstości odpowiadających cząstkom wimsa.
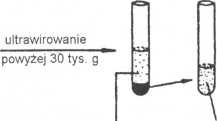
Wirowanie naprzemienne (ang. differential centrifugation) jest najprostszą metodą oczyszczenia wimsa przy użyciu wirówek. Zawiesina zawierająca cząstki wirusa wirowana jest w kilku cyklach, z których każdy składa się z etapu wirowania zwykłego i ultrawirowania (rys. 3).
supernatant
Rys. 3. Zasada wirowania naprzemiennego - schemat
W pierwszym cyklu zawiesinę wimjemy najpierw przy małym przyspieszeniu (do 10 tys. g). Większe fragmenty komórki sedymentują tworząc pellet. Wims pozostaje w supernatancie. Supernatant ostrożnie zbieramy i przenosimy do innej probówki, a niepotrzebny pellet wyrzucamy. Supernatant uzyskany w pierwszym cyklu ultrawimjemy z przyspieszeniem powyżej 30-40 tys. g. Wims powinien się strącić do pelletu, a w supernatancie pozostają mniejsze od niego zanieczyszczenia, np. substancje rozpuszczalne. Tym razem wylewamy supernatant, a pellet rozpuszczamy w niewielkiej ilości rozpuszczalnika o dobrze znanym nam i przyjaznym dla wimsa składzie. Uzyskaną zawiesinę wimsa należy poddać drugiemu cyklowi wirowania zaczynając znów od wirowania z małym przyspieszeniem i odrzucając pellet, w którym zgromadzą sie większe od wimsa zanieczyszczenia, które nie osadziły się w pierwszym cyklu. Supernatant z dmgiego cyklu znów ultrawimjemy. Po kilku (na ogół 3-4) takich cyklach można uzyskać preparat wimsa o dostatecznej czystości.
Wirowanie naprzemienne jest stosunkowo prostą metodą oczyszczania wimsów, może jednak spowodować dość znaczne straty wirusa w pierwszym etapie wirowania. W odrzuconym osadzie po pierwszym niskoobrotowym wirowaniu może się znaleźć sporo cząstek wimsa związanych ze strąconymi większymi fragmentami materiału roślinnego. Ryzyko strat można zmniejszyć dobierając odpowiednie metody ekstrakcji wimsa oraz wstępnego klarowania soku, które uwolnią cząstki wimsa związane z materiałem komórkowym. Ultrawirowanie, z kolei, nie jest w stanie wyeliminować związków rozpuszczalnych w wodzie i mających niewielkie cząsteczki. Preparaty takie można doczyścić np. przez dializę. Zaletą procedur naprzemiennego wirowania jako metody oczyszczania wimsów jest natomiast to, że metoda ta nie powoduje istotnych zmian ważnych właściwości cząstek wimsa, np. infekcyjności, struktury powierzchni itp.
Wirowanie w gradiencie gęsfości (ang. density gradient centrifugation) może posłużyć do rozdzielenia cząstek, które nieznacznie różnią się między sobą wielkością i masą i nie mogą być rozdzielone mniej precyzyjnymi metodami.
Probówkę wirówkową napełnia się roztworem sacharozy (w pewnych przypadkach lepiej jest użyć siarczanu cezu) w taki sposób, że w słupku roztwom w probówce wytwarza się gradient gęstości, na przykład nakłada się na siebie kolejno takie same objętościowo porcje roztworów sacharozy o malejących stężeniach (np. 40,30,20 i 10%). Nie dochodzi do wyrównania stężeń w drodze swobodnej dyfuzji sacharozy z niższych, bardziej stężonych warstw do wyższych, bardziej rozcieńczonych, bo nie pozwala na to Przyspieszenie działające na cząsteczki sacharozy w czasie wirowania. Z drugiej strony, wirowanie nie doprowadza do zatężenia niższych stref przez przemieszczanie się cząsteczek sacharozy w dół zgodnie z kierunkiem i zwrotem siły działającej w czasie wirowa-nia’ bo siła ta jest równoważona zbyt dużą gęstością roztworu. W czasie wirowania stężenia sacharozy w poszczególnych warstwach gradientu pozostają więc niezmienione ub zmieniają się bardzo powoli i nieznacznie i gradient utrzymuje się. Jeśli na taki gradient
Wyszukiwarka
Podobne podstrony:
prezydenta miasta - w gminie do 5 tys. mieszkańców - 150 podpisów, do 10 tys.- 300, do 20 tys.- 600,
Slajd7 Paleolit (1) Starsza epoka kamienna (od 2 min do 10 tys. Lat temu) pokrywa się z okresem wiel
DSC09374 ❖Ospa pojawiła się prawabpodobnie pomiędzy 5 tys. do 10 tys. lat p.n.Ch, kiedy to czło
Powojenne zmiany ludnościowe 109 szych — do 10 tys. mieszk., liczba ludności miast
111.19 Umowy licencyjne - za każde 10 tys. zł opłaty licencyjnej dla Uczelni (proporcjonalnie do wkł
Matem Finansowa$0 240 Odpowiedzi do zadań i testów 5.3. Odpowiedzi do zadań i testów 1.
-odrzucono pierwsze 100 cm3 wody (przy pomocy zaworu Z W), -pobrano wodę do oznaczenia tlenu rozpusz
46337 IMG(55 [slajdy] Epoka kamienia łupanego Rozpoczęła się ok. 600 tyś temu i trwała do ok. 10 tyś
(6) W budownictwie uprzemysłowionym stosuje się elementy wielkoprzestrzenne ( o masie od 10 tys. do
więcej podobnych podstron